5.3 Nomenclatura tradizionale
L’assegnazione di un nome ad un composto chimico può seguire diverse regole.
| Nomenclatura tradizionale | Richiesta nei quiz |
| Nomenclatura IUPAC | Richiesta solo in alcuni casi |
| Nomenclatura di Stock | Finora mai richiesta |
Abbiamo inoltre anche nomi storici attribuiti ad alcuni composti come l’acqua H2O, l’ammoniaca NH3, ecc.
Esiste la possibilità di classificare i composti in binari, ternari ecc. sulla base del numero di specie presenti. Ad esempio l’anidride solforica SO3 è un composto binario perché è composta da due elementi chimici, lo zolfo S e l’ossigeno O; l’acido solforico H2SO4 è un composto ternario perché è composta da tre elementi chimici, lo zolfo S, l’ossigeno O e l’idrogeno H.
Mentre la nomenclatura IUPAC è utilizzata nella letteratura scientifica internazionale, la nomenclatura tradizionale è la più diffusa e soprattutto è maggiormente utilizzata nei quiz dei test di ammissione.
Per comprendere la nomenclatura tradizionale suddividiamo gli elementi in metalli e non metalli (paragrafo 3.5.6) e seguiamo una serie di reazioni che avvengono prima con l’ossigeno, poi con l’acqua ed infine nella ricombinazione metalli-non metalli.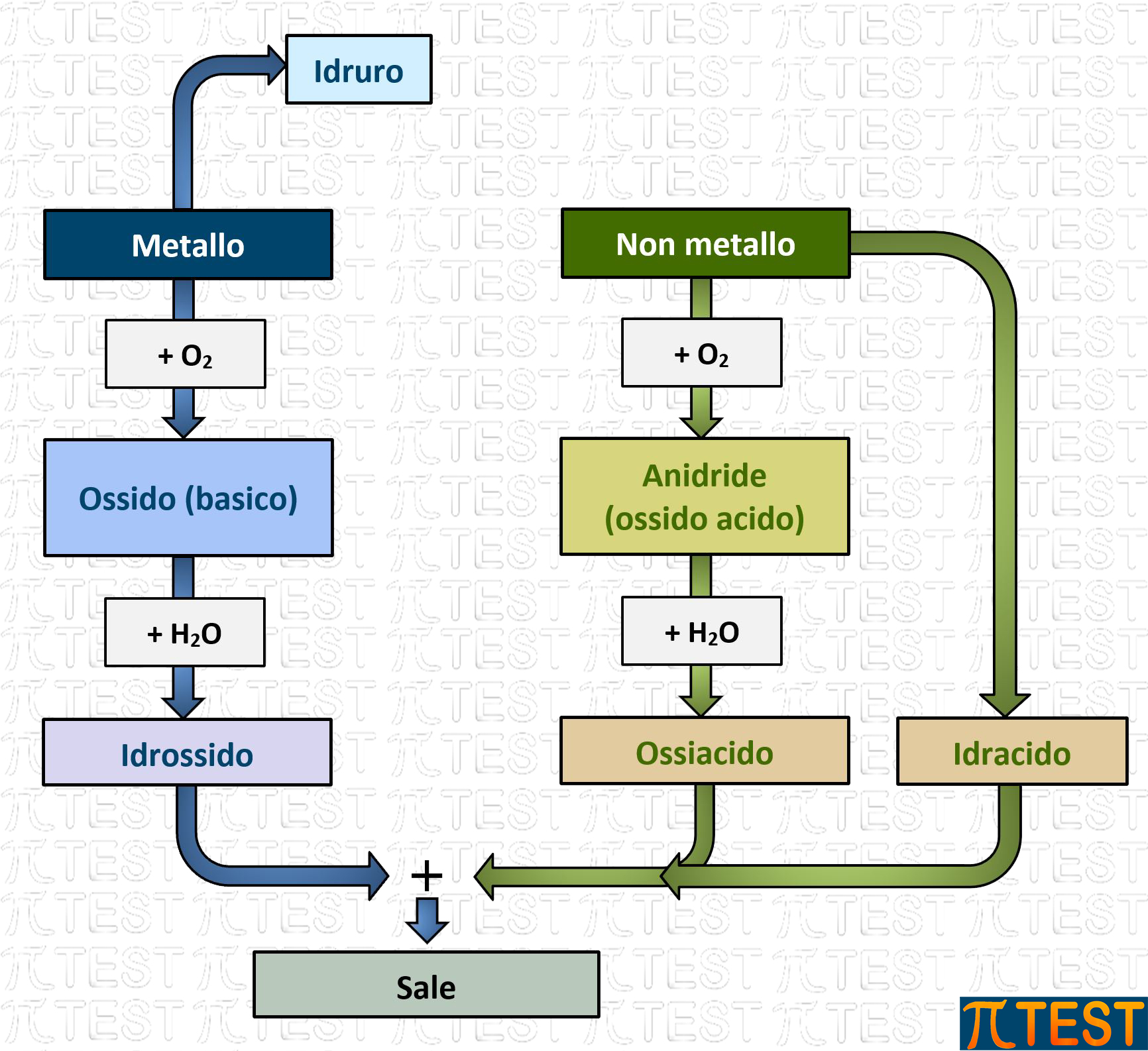
Visualizza questo post su Instagram
5.3.1 Metallo + O2 ➞ Ossido
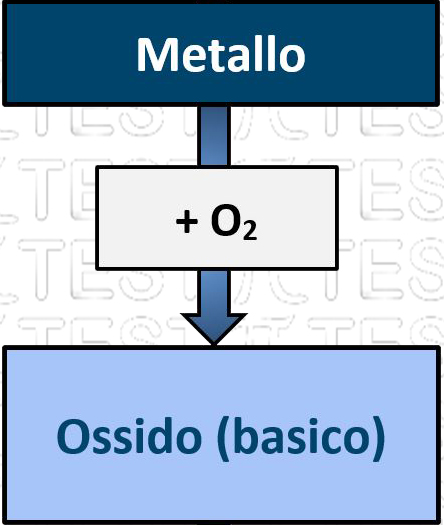 un metallo reagisce con l’ossigeno formando un composto binario, l’ossido (detto anche ossido basico perché da questi in future reazioni si formeranno composti basici). La formula chimica dipende dal numero di ossidazione del metallo.
un metallo reagisce con l’ossigeno formando un composto binario, l’ossido (detto anche ossido basico perché da questi in future reazioni si formeranno composti basici). La formula chimica dipende dal numero di ossidazione del metallo.
Vediamo alcuni esempi:
Metalli del primo gruppo della tavola periodica, detti anche metalli alcalini.
Il loro unico possibile numero di ossidazione è +1.
La formula dell’ossido sarà: LiO2, NaO2, KO2. Il nome sarà semplicemente “ossido di ……”.

Metalli del secondo gruppo della tavola periodica, detti anche metalli alcalino terrosi.
Il loro unico possibile numero di ossidazione è +2.
La formula dell’ossido sarà: BeO, MgO, CaO, SrO. Il nome sarà semplicemente “ossido di ……”.

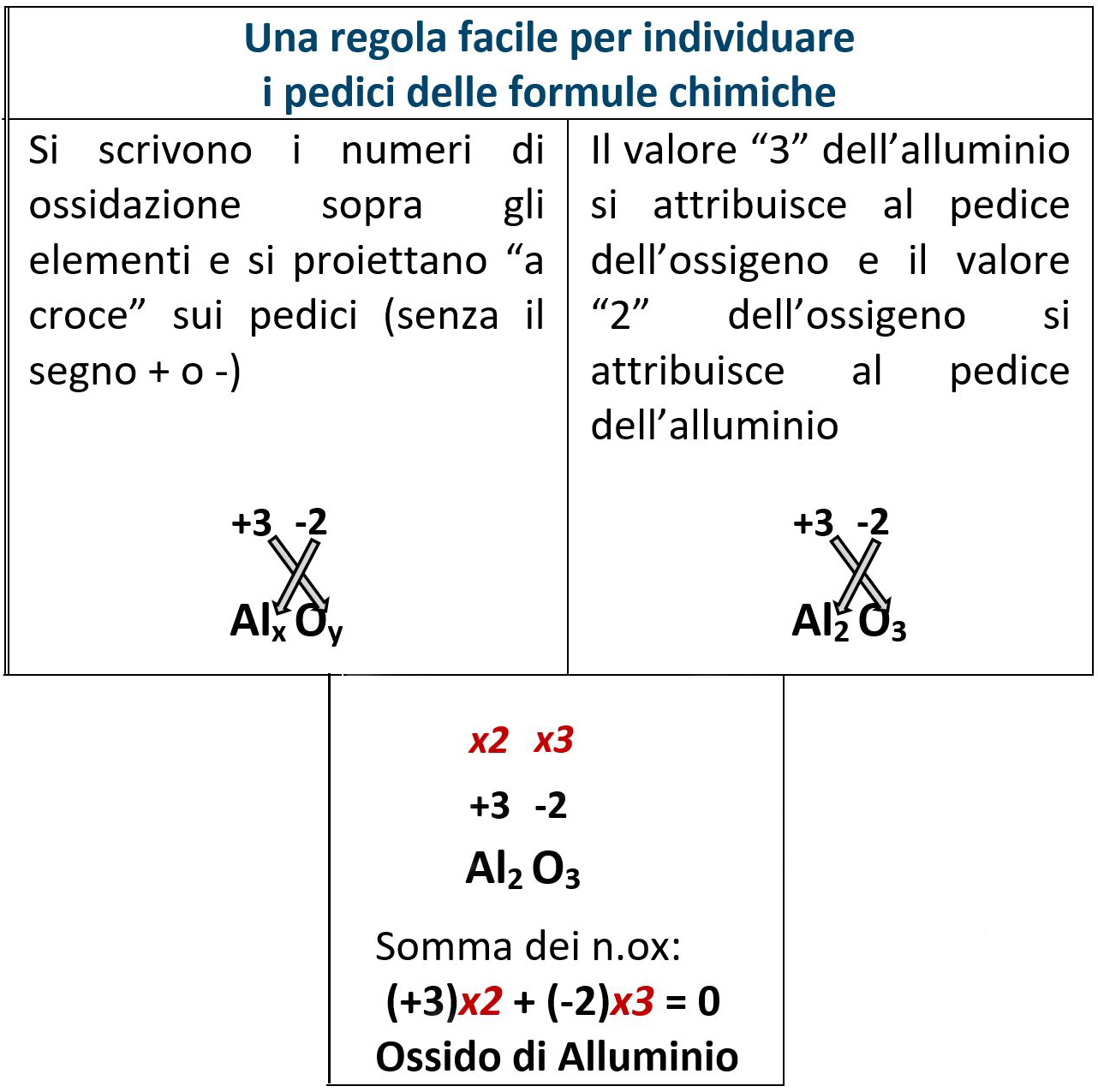
Metalli del terzo gruppo della tavola periodica.
Il loro unico possibile numero di ossidazione è +3.
La formula dell’ossido sarà: Al2O3 (anche se appartenente al terzo gruppo non consideriamo il boro perché è un semimetallo).
Il nome sarà semplicemente “ossido di alluminio”.
Metalli di transizione. Possono avere due diversi possibili numeri di ossidazione e andranno così a formare due diversi ossidi. La nomenclatura tradizionale distingue i due ossidi ponendo le desinenze –oso e –ico al nome del metallo.
La desinenza –oso si usa per il numero di ossidazione minore dei due; –ico per il maggiore.

Il ferro Fe possiede i numeri di ossidazione +2 e +3; si formeranno così rispettivamente l’ossido ferroso e l’ossido ferrico. Il rame Cu possiede i numeri di ossidazione +1 e +2; si formeranno così rispettivamente l’ossido rameoso e l’ossido rameico.

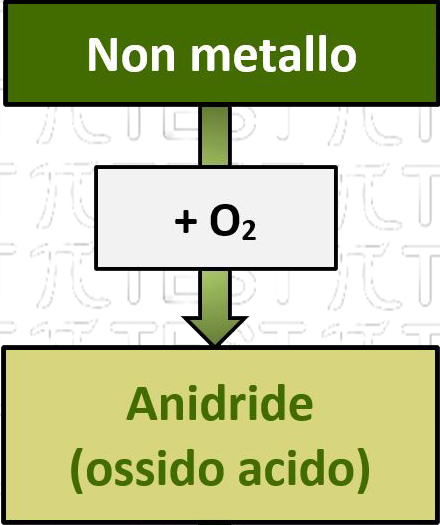
5.3.2 Non metallo + O2 ➞ Anidride
Un non metallo reagisce con l’ossigeno formando un composto binario, l’anidride (detto anche ossido acido perché da questa in future reazioni si formeranno composti acidi) la cui formula chimica dipende dal numero di ossidazione del non metallo.
I non metalli possono avere una serie di numeri di ossidazione più ampia e per le desinenze da utilizzare nella nomenclatura non bastano le due desinenze –osa e –ica ma si adottano anche prefissi secondo il seguente schema:

Lo zolfo S posside i numeri di ossidazione +4 e +6. Formerà così l’anidride solforosa e l’anidride solforica

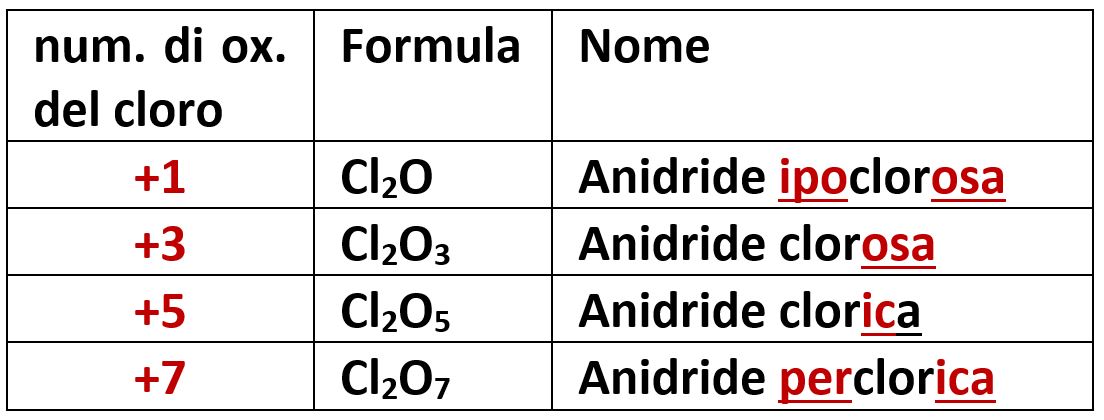
Gli alogeni possiedono tutti il numero di ossidazione -1 (che vedremo tra poco nella formazione degli idracidi) e alcuni tra i valori +1, +3, +5, +7. Tra gli alogeni solo il cloro Cl possiede tutti questi valori ed avremo quattro diverse anidridi.
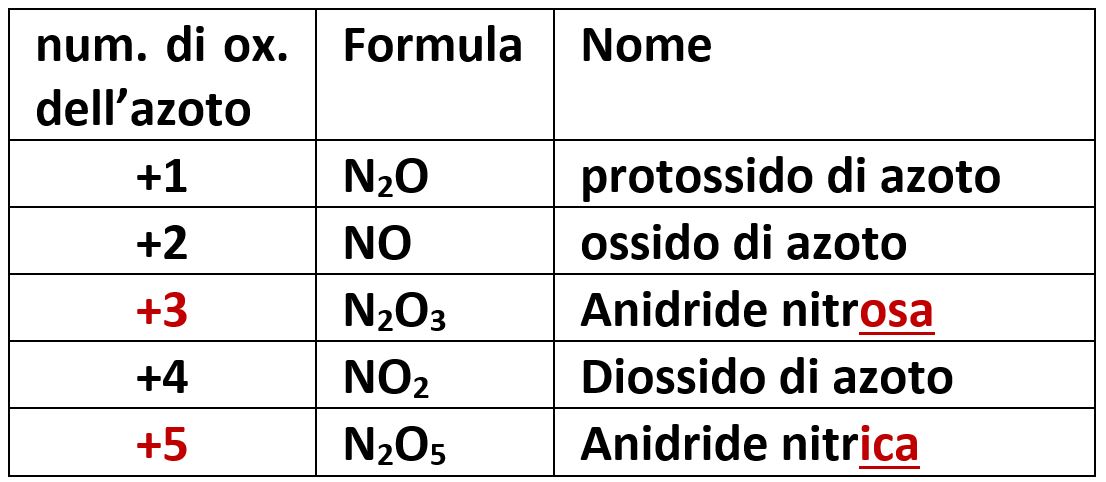
L’azoto N possiede i numeri di ossidazione +1, +2, +3, +4, +5 e con l’ossigeno diversi ossidi. Con i valori +3 e +5 forma N2O3 e N2O5 che chiamiamo anidride nitrosa e anidride nitrica, con gli altri valori forma altri tipi di ossidi.
5.3.3 Reazioni chimiche di formazione di ossidi e anidridi

5.3.4 Ossido + H2O ➞ Idrossido
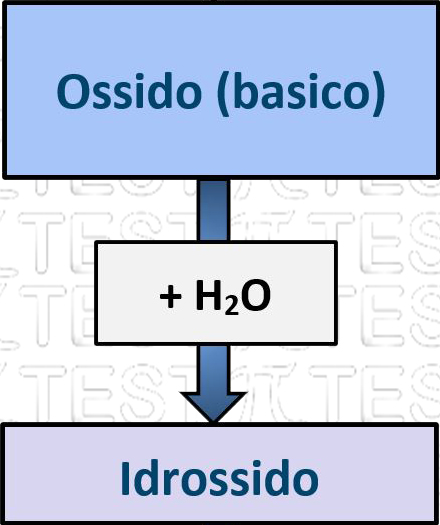
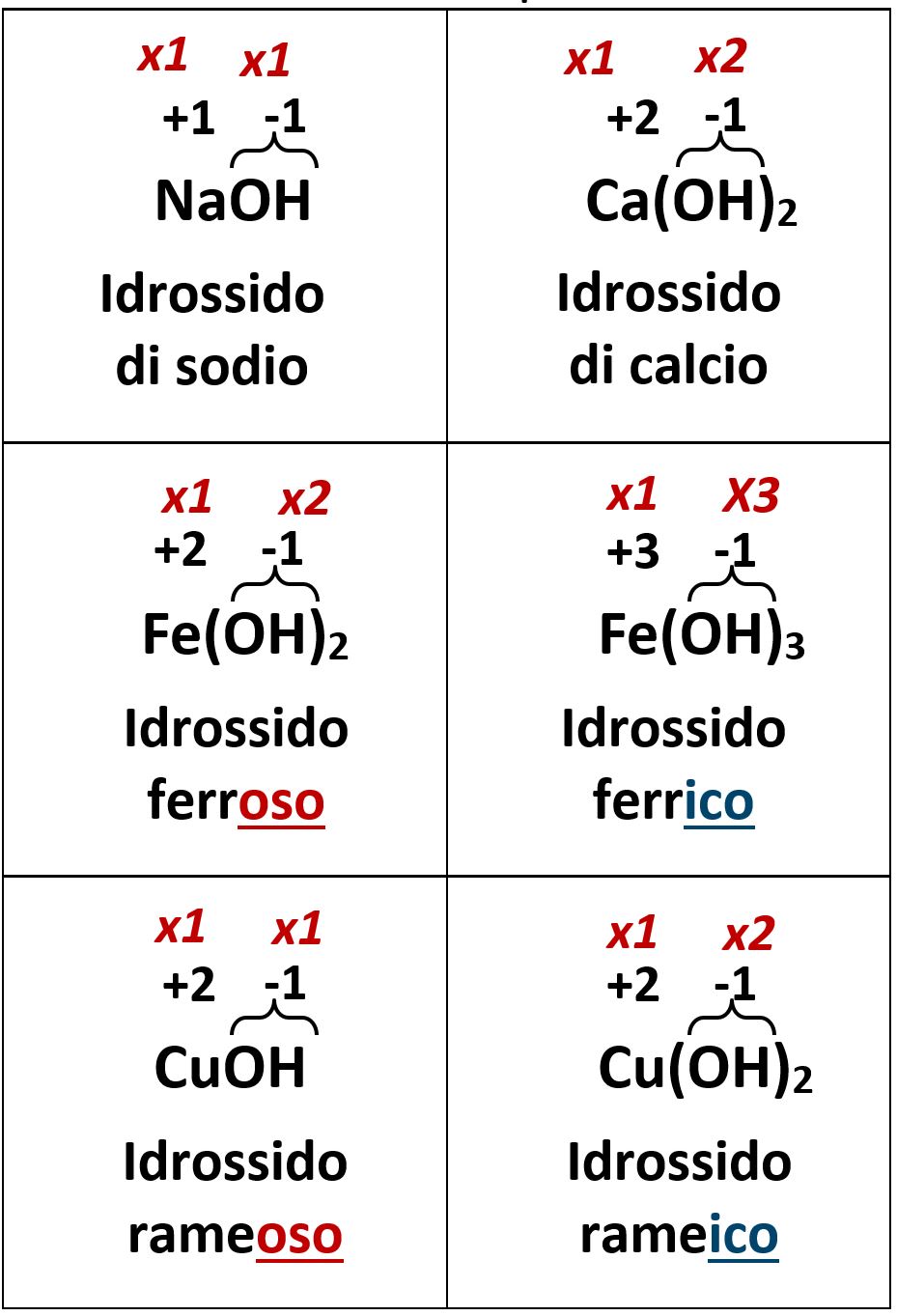
Un ossido metallico reagisce con l’acqua formando un composto ternario, l’idrossido. Un idrossido è costituito da un atomo di un metallo che lega un certo numero di ossidrili –OH.
| L’ossidrile –OH è costituito da un atomo di ossigeno fortemente legato ad un atomo di idrogeno; complessivamente formano un’entità unica, difficilmente scindibile. Complessivamente un ossidrile possiede un unico numero di ossidazione pari a -1. | 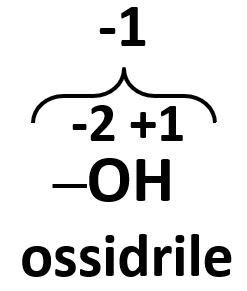 |
Il numero di ossidrili legati al metallo in un idrossido è esattamente uguale al numero di ossidazione del metallo stesso. Per i metalli che possiedono due possibili numeri di ossidazione si usano le desinenze –oso e –ico che abbiamo già visto per gli ossidi.
Vediamo alcuni esempi di idrossidi:
5.3.5 Reazioni chimiche di formazione di idrossidi.
Secondo lo schema della nomenclatura tradizionale un idrossido si ottiene facendo reagire un ossido con l’acqua:
 Si può pervenire alla formazione dell’idrossido anche facendo reagire direttamente un metallo con l’acqua. Avremo in questo caso lo sviluppo di idrogeno gassoso H2 .
Si può pervenire alla formazione dell’idrossido anche facendo reagire direttamente un metallo con l’acqua. Avremo in questo caso lo sviluppo di idrogeno gassoso H2 .
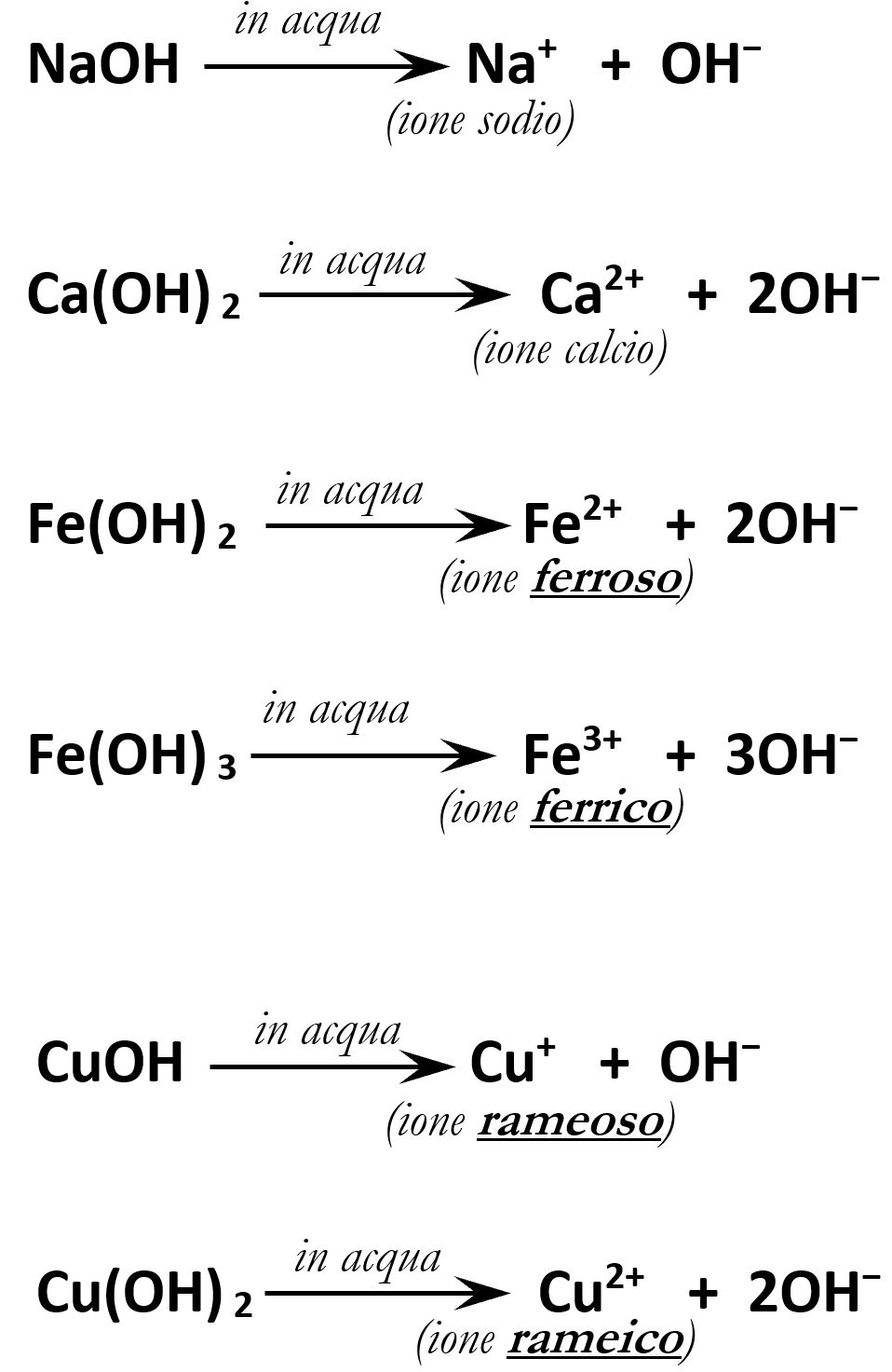
5.3.6 Idrolisi basica
Gli idrossidi in acqua tendono ad avere una reazione di rottura del legame esistente tra il metallo e l’ossidrile che è nota con il nome di idrolisi (=“rottura in acqua”). Si formano così due ioni: il catione metallico e lo ione ossidrile. La presenza di ossidrili OH– rende l’acqua basica; per questo morivo questa reazione di dissoluzione è detta “idrolisi basica”.
5.3.7 Anidride + H2O ➞ ossiacido
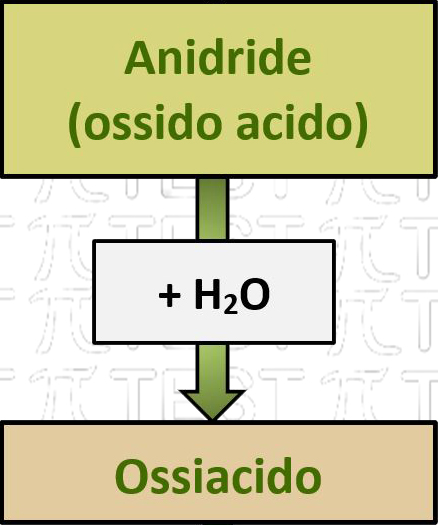
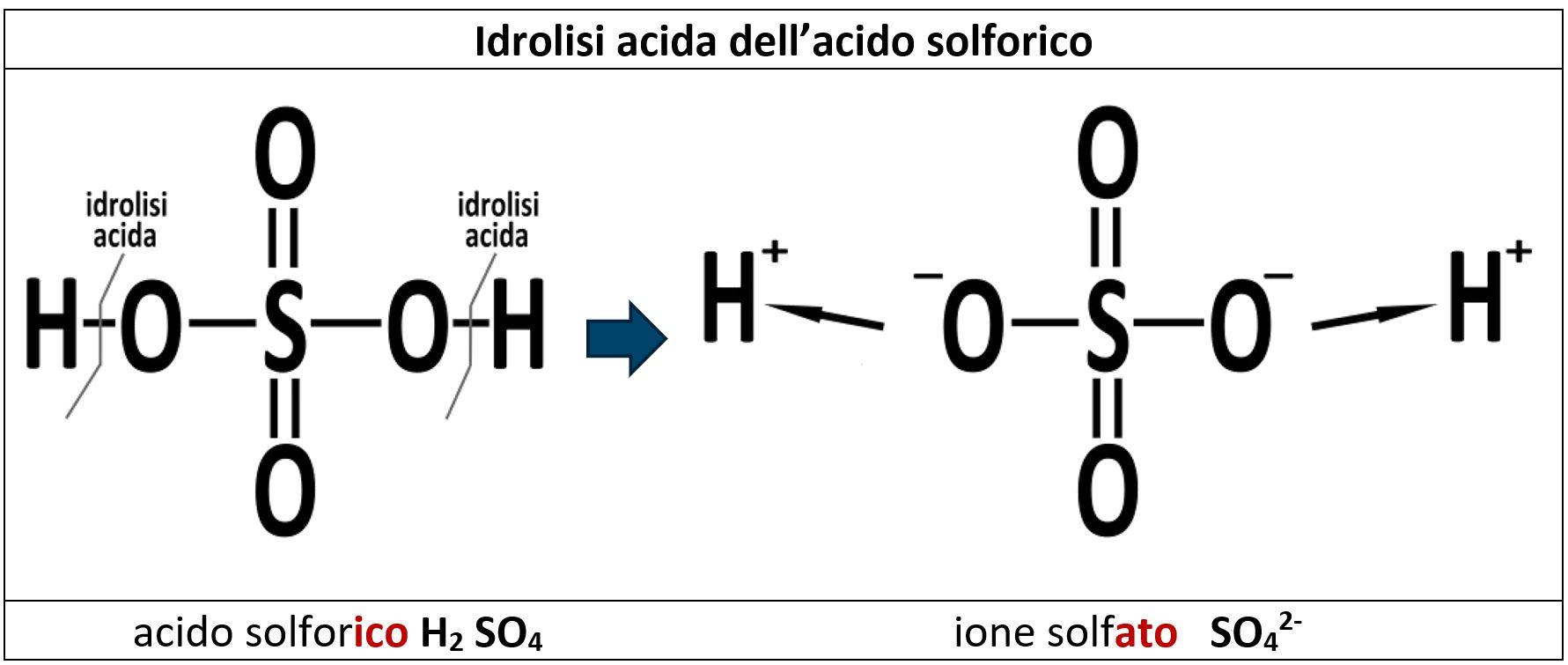
Una anidride reagisce con l’acqua formando un composto ternario detto ossiacido. Un ossiacido è costituito da un atomo di un non metallo che lega un certo numero di atomi di ossigeno, dei quali alcuni sono legati ad atomi di idrogeno.
| Nell’acido solforico H2SO4 l’atomo di zolfo è legato a quattro atomi di ossigeno. Due atomi di ossigeno sono legati a loro volta ad atomi di idrogeno, mentre gli altri due sono legati allo zolfo con doppio legame. | 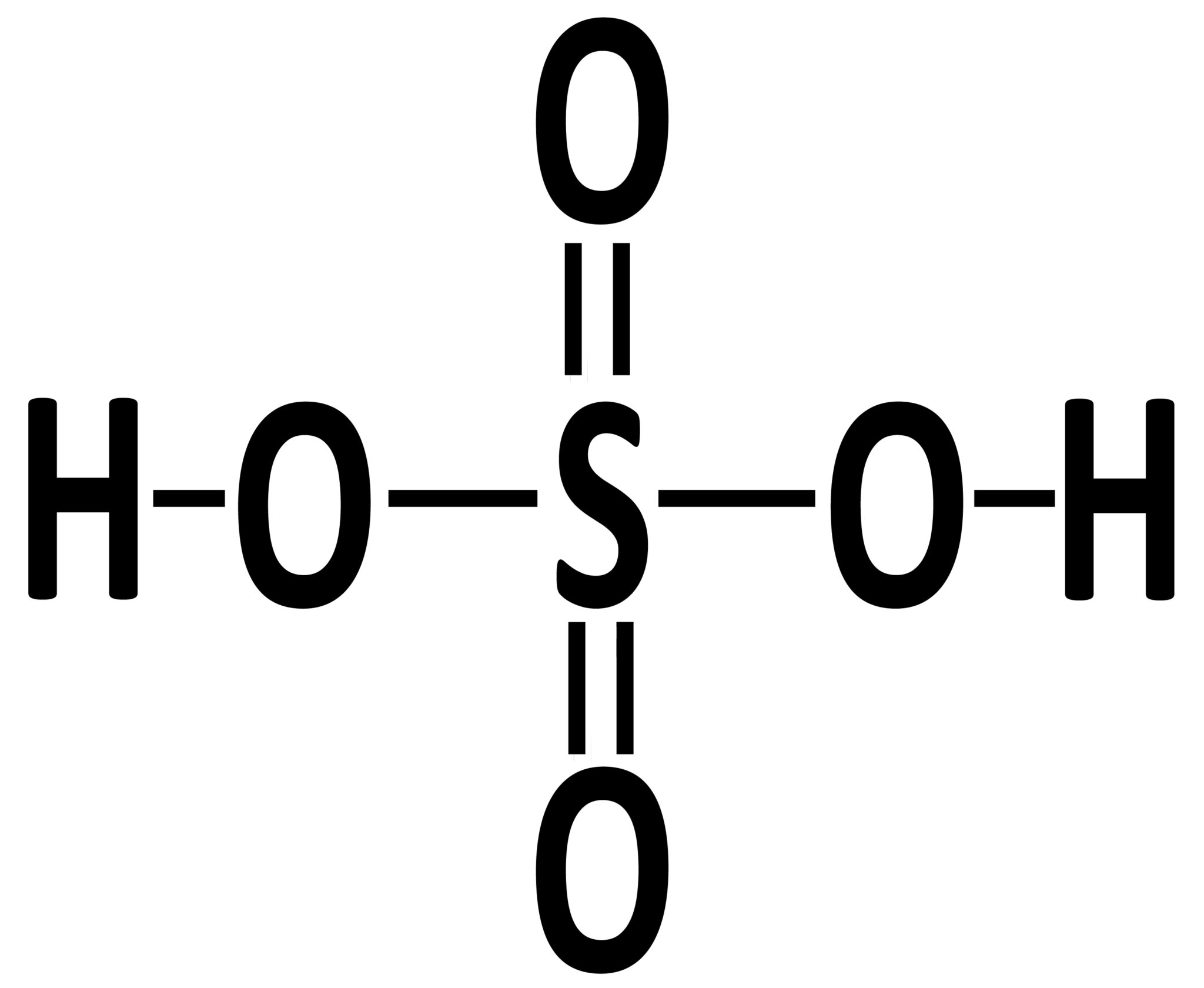 |
In funzione dei diversi possibili numeri di ossidazione del non metallo gli ossiacidi prendono lo stesso sistema di desinenze e suffissi visto per le anidridi.
Per determinare la formula di un ossiacido scriviamo la reazione tra una molecola di anidride ed una molecola d’acqua. Nella molecola in formazione consideriamo la presenza di tutti gli atomi delle due molecole di partenza. In questo modo la composizione dei pedici della molecola dell’ossiacido viene determinata automaticamente.
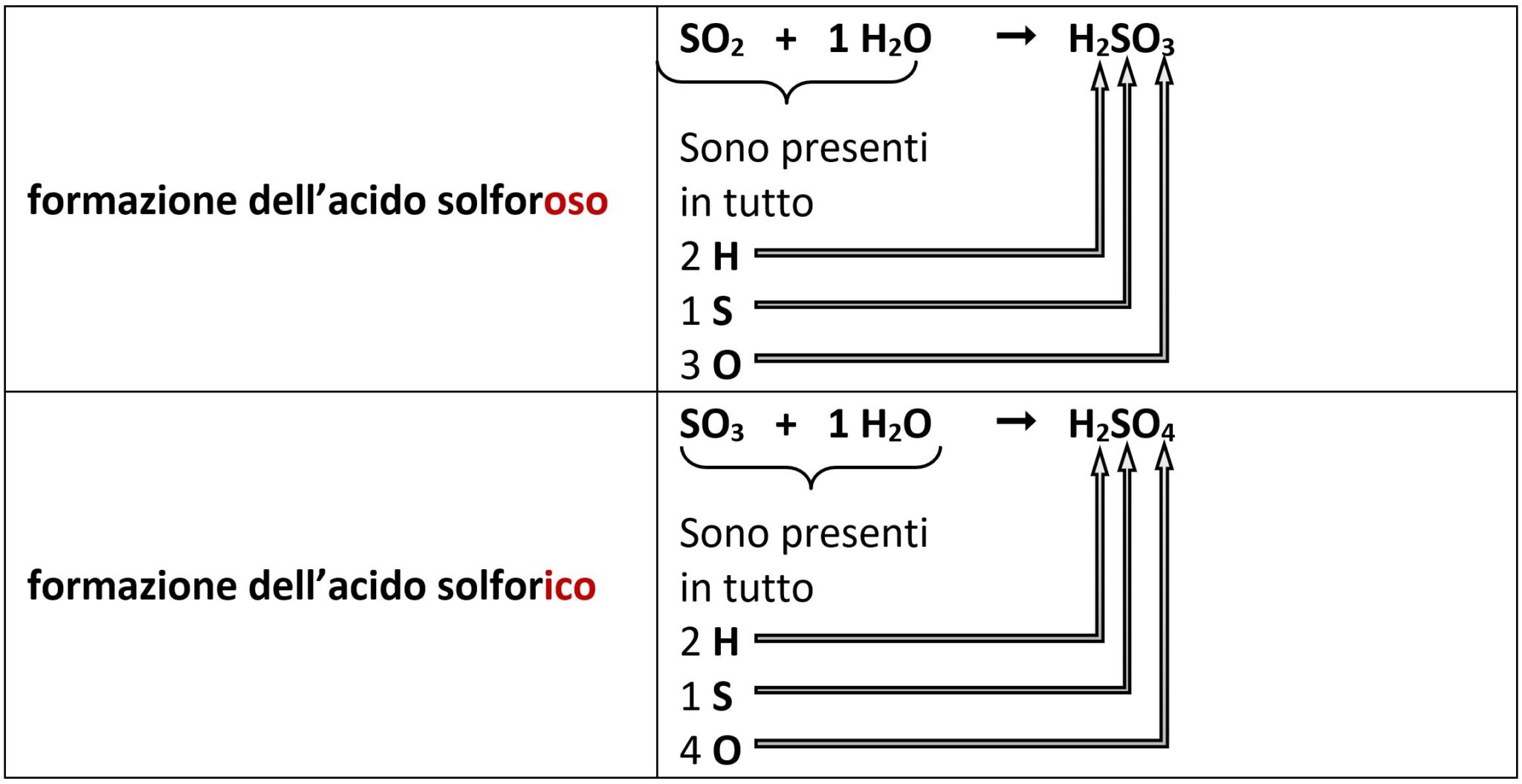
Zolfo S
Lo zolfo S, che possiede i numeri di ossidazione +4 e +6 e forma le anidridi solforosa e solforica, formerà così l’acido solforoso e l’acido solforico.
Alogeni
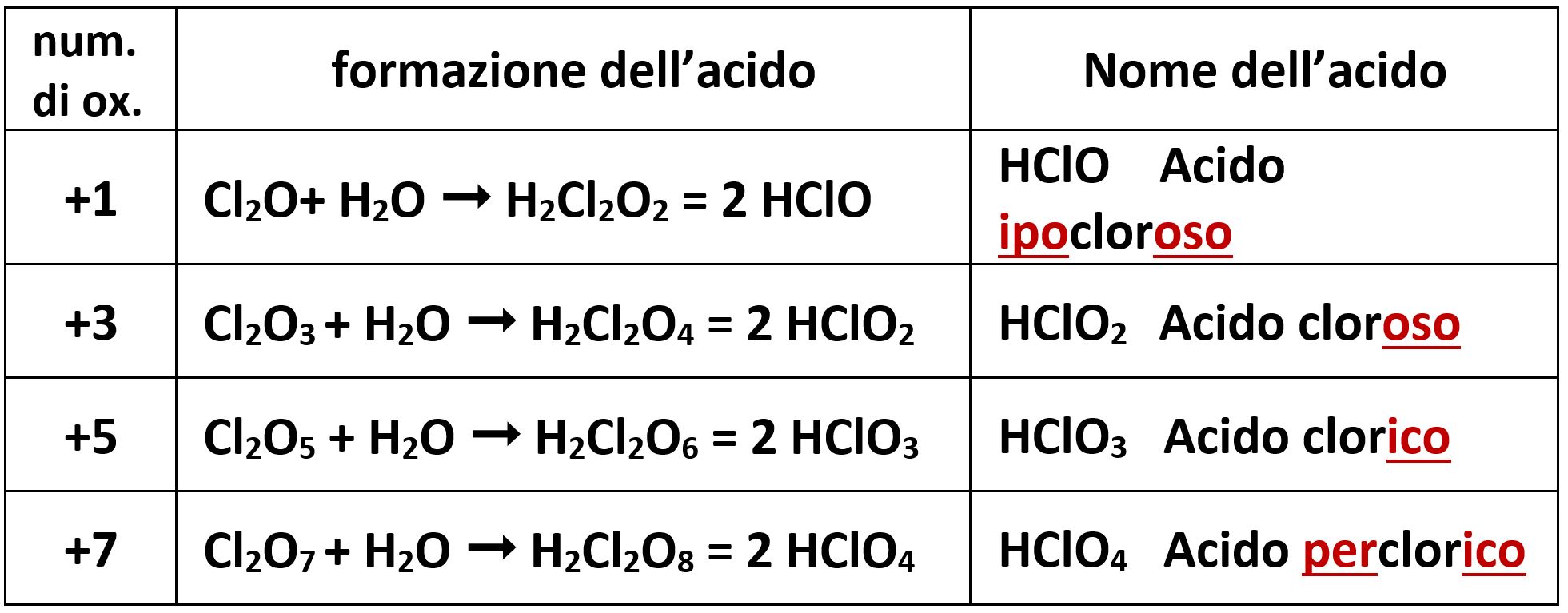
Gli alogeni che possiedono alcuni tra i valori +1, +3, +5, +7, formeranno ossiacidi che avranno il relativo nome. Tra gli alogeni prendiamo ad esempio il cloro Cl possiede tutti i valori ed avremo quattro diversi acidi.
Azoto
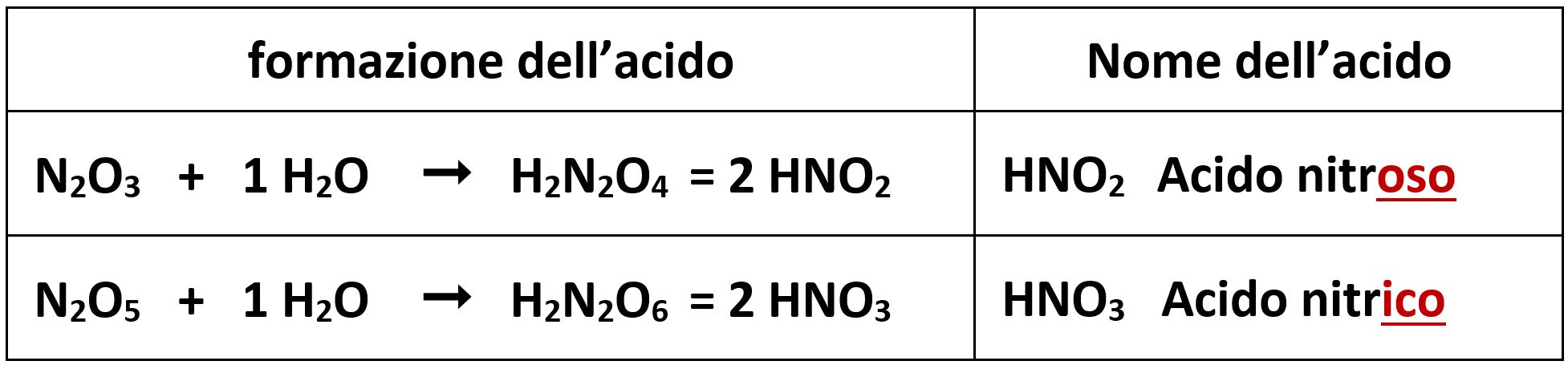
Per l’azoto N facciamo riferimento solo ai numeri di ossidazione +3 e +5 collegati all’anidride nitrosa N2O3 e all’anidride nitrica N2O5 che reagiscono con una molecola d’acqua per dare i rispettivi ossiacidi.
Fosforo
Per il fosforo P facciamo riferimento solo ai numeri di ossidazione +3 e +5 collegati all’anidride fosforosa P2O3 e all’anidride fosforica P2O5 che reagiscono con una molecola d’acqua per dare i rispettivi ossiacidi.
Il fosforo appartiene allo stesso gruppo dell’azoto ed ha infatti lo stesso tipo di composti.

Carbonio
Per Il carbonio C facciamo riferimento solo al solo numero di ossidazione +4 che troviamo nell’anidride Carbonica CO2.

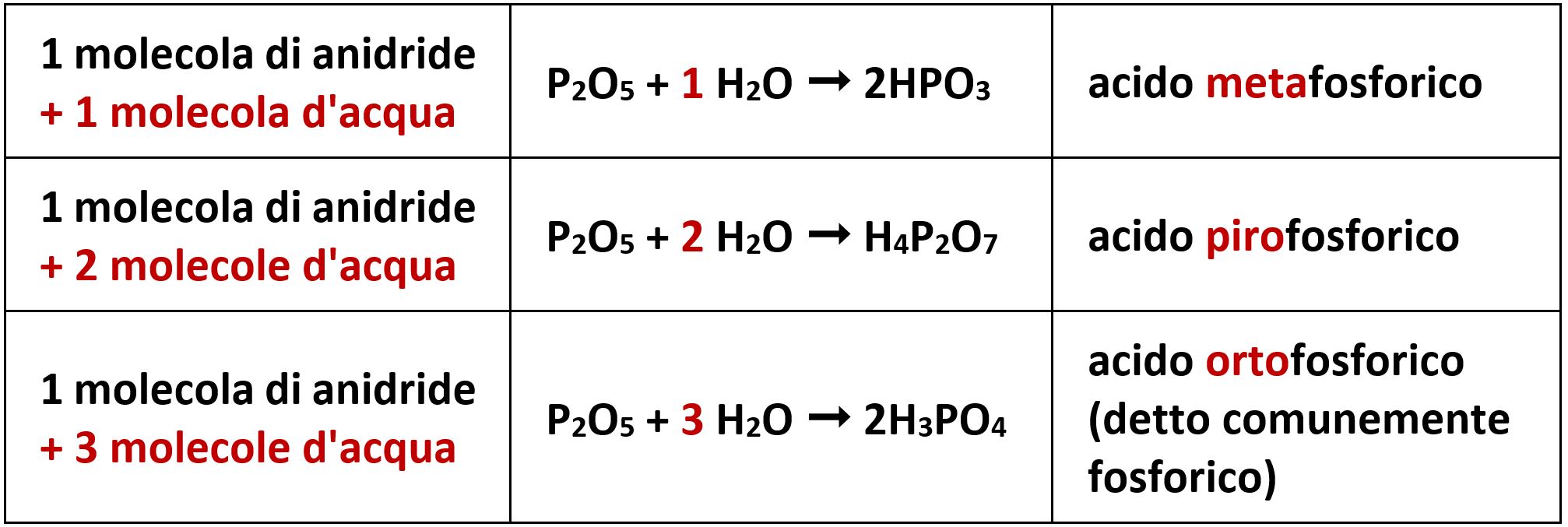
5.3.8 Acidi meta-, piro- e orto-
In generale per ottenere un ossiacido facciamo reagire una anidride con una molecola d’acqua. In alcuni casi però la reazione può avvenire sommando anche due o tre molecole d’acqua ottenendo diversi ossiacidi. Per distinguerli si usa il prefisso meta-, piro- e orto-. Il caso tipico richiesto a volte nei quiz si ha con l’anidride fosforica.
5.3.9 ossiacidi di particolari metalli di transizione
A livello di eccezione due metalli di transizione, il cromo Cr ed il manganese Mn si comportano come non metalli formando ossiacidi. In particolare ricordiamo l’acido permanganico HMnO4 che forma il sale permanganato di potassio KMnO4.
5.3.10 Idrolisi acida
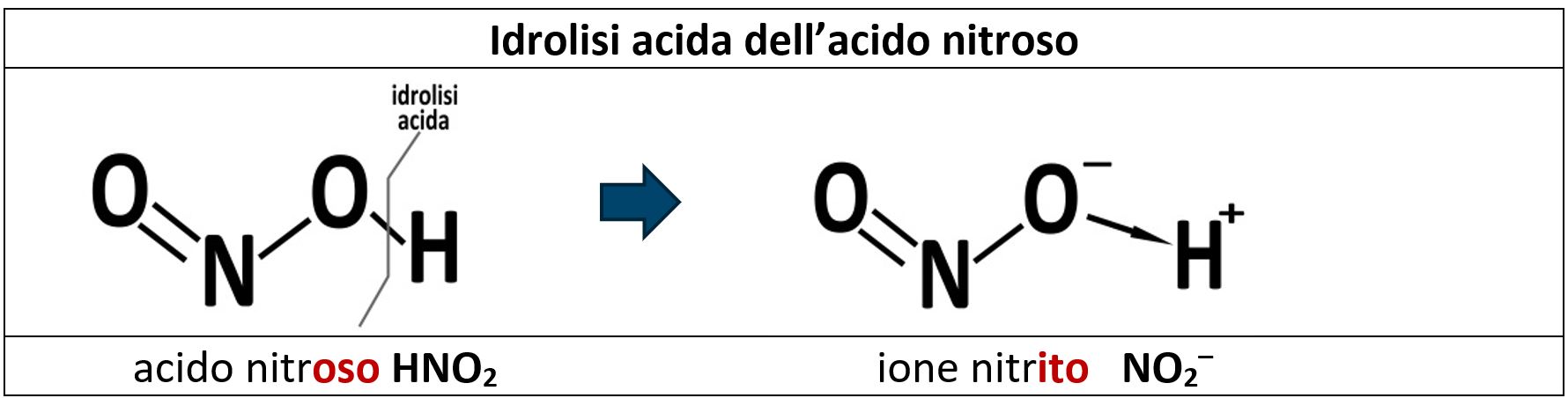
Gli ossiacidi in acqua tendono ad avere una reazione di idrolisi (=“rottura in acqua”) di rottura del legame esistente tra l’idrogeno e l’ossigeno. Si formano così due ioni: il catione H+ e l’anione residuo. La presenza di H+ rende l’acqua acida; per questo morivo questa reazione di dissoluzione è detta “idrolisi acida”.
L’anione che si forma quando si distaccano gli H+ prende un nome che deriva dall’acido di partenza.
La regola da ricordare vuole che da un acido –oso viene un anione –ito e da un acido –ico viene un anione –ato.
Per gli ossiacidi del cloro abbiamo:

Per gli ossiacidi dell’azoto abbiamo:
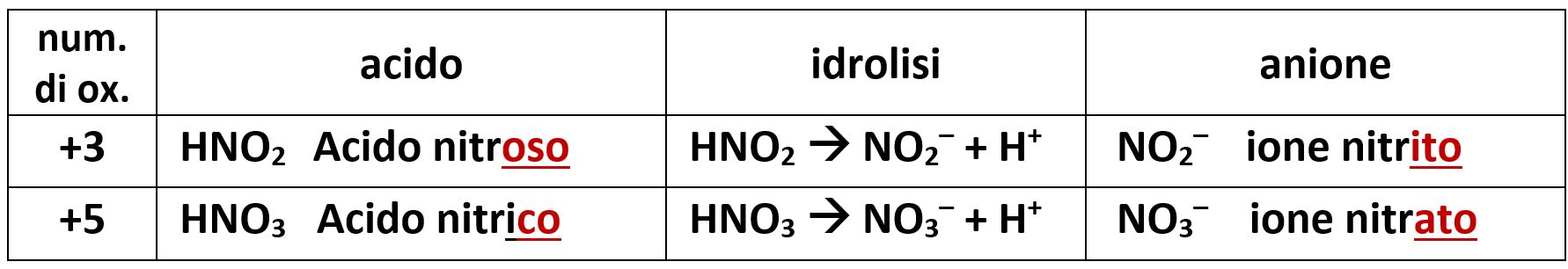
Per gli ossiacidi dello zolfo abbiamo:
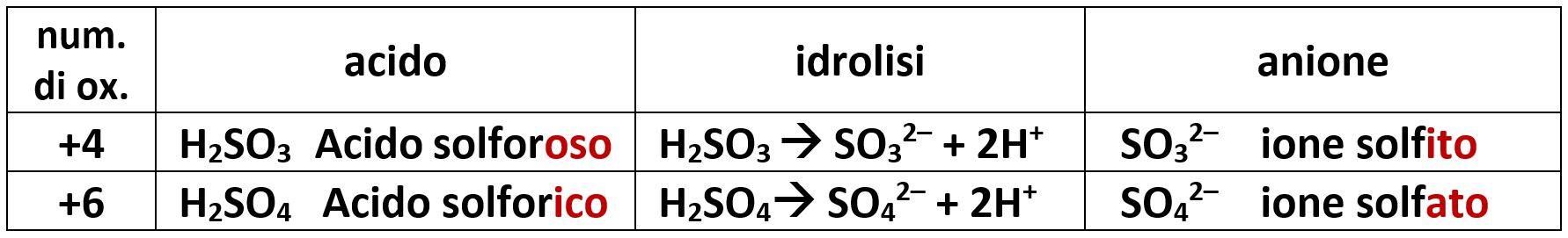
5.3.11 acidi mono- e poliprotici
Lo ione H+ è detto anche «protone» perché se ad un atomo di H si toglie l’unico elettrone presente, rimane solo il protone nel nucleo.
Denominiamo gli acidi in funzione del numero di atomi di idrogeno presenti. Ad esempio l’acido nitrico HNO3 è un acido monoprotico, mentre l’acido solforico H2SO4 è un acido biprotico e l’acido fosforico H3PO4 è un acido triprotico.
Gli acidi poliprotici possono subire una deprotonazione progressiva. Per deprotonazione intendiamo la perdita degli H+.
Gli acidi forti perdono subito tutti gli H+. Gli acidi deboli invece possono anche fermarsi alla perdita del primo H+ mantenendo nella molecola gli altri atomi di idrogeno.
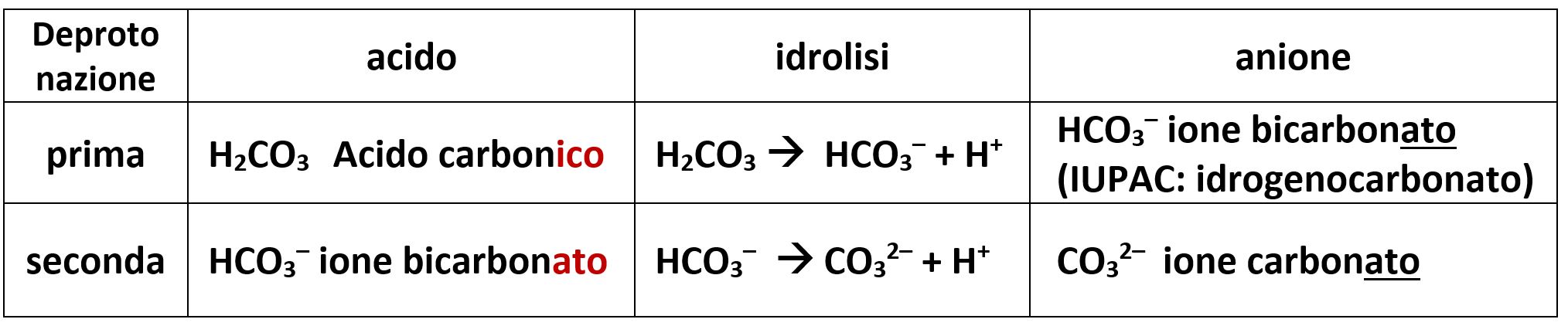
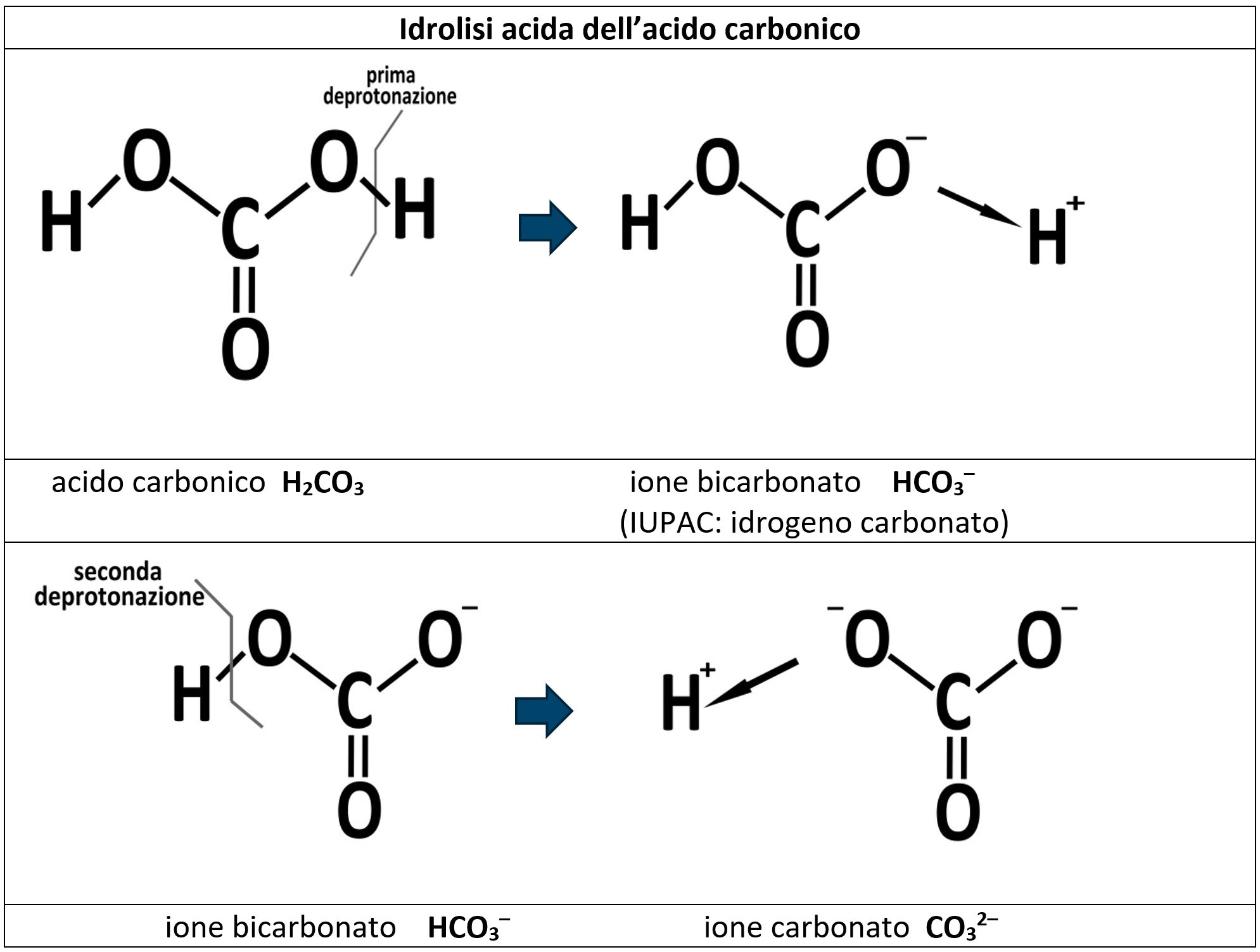
Il classico esempio è quello dell’acido carbonico H2CO3 che subisce in momenti diversi la prima e la seconda deprotonazione. Gli anioni che si vengono a formare sono lo ione bicarbonato HCO3– e lo ione carbonato CO32–. lo ione bicarbonato HCO3– nella nomenclatura IUPAC si chiama idrogenocarbonato, il prefisso idrogeno− sta a significare che nella struttura ionica è presente ancora un atomo di idrogeno.
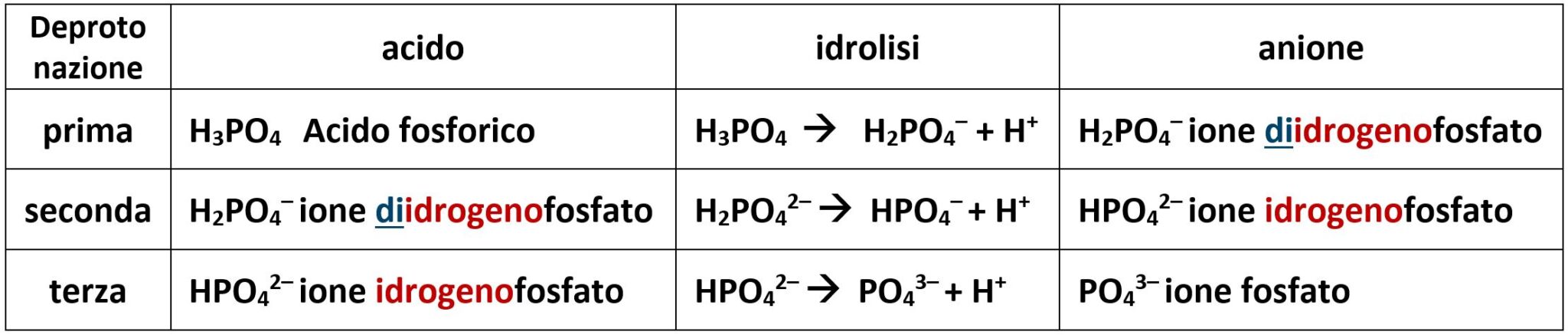
Un altro tipico esempio si ha con l’acido fosforico H3PO4 che è sottoposto a tre deprotonazioni. In questo caso si adotta solo la nomenclatura IUPAC.
5.3.12 Idracidi
Gli acidi visti nel precedente paragrafo sono detti ossiacidi dove il prefisso ossi- sta ad indicare la presenza di atomi di ossigeno all’interno della molecola.
I non metalli possono però formare acidi con la presenza di idrogeno, ma senza l’ossigeno. Li chiamiamo idracidi.
Si formano con tutti gli elementi del sesto e del settimo gruppo (alogeni).
La nomenclatura tradizionale prevede la desinenza in –idrico per gli acidi e in –uro per gli anioni che ne derivano.
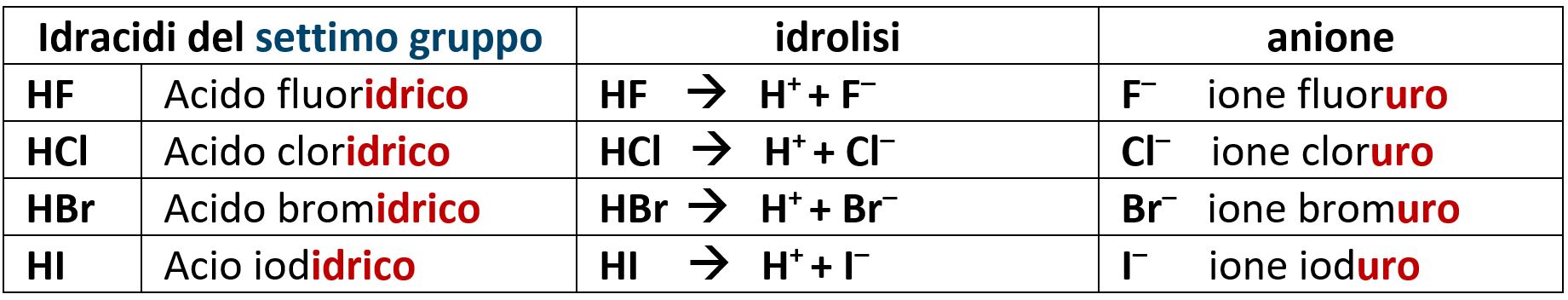 Per il sesto gruppo nei quiz è richiesta solo la conoscenza dell’acido solfidrico H2S che per idrolisi acida dà lo ione solfuro S2–
Per il sesto gruppo nei quiz è richiesta solo la conoscenza dell’acido solfidrico H2S che per idrolisi acida dà lo ione solfuro S2–
 Inoltre esiste l’acido cianidrico HCN che per idrolisi acida libera l’anione cianuro.
Inoltre esiste l’acido cianidrico HCN che per idrolisi acida libera l’anione cianuro.
 Il gruppo ciano –CN formato da un atomo di carbonio unito con triplo legame ad un acido di azoto è un gruppo di due atomi molto stabile che spesso cine considerato come un unico elemento similmente a quanto abbiamo già osservato per il gruppo ossidrile –OH.
Il gruppo ciano –CN formato da un atomo di carbonio unito con triplo legame ad un acido di azoto è un gruppo di due atomi molto stabile che spesso cine considerato come un unico elemento similmente a quanto abbiamo già osservato per il gruppo ossidrile –OH.
5.3.13 I Sali
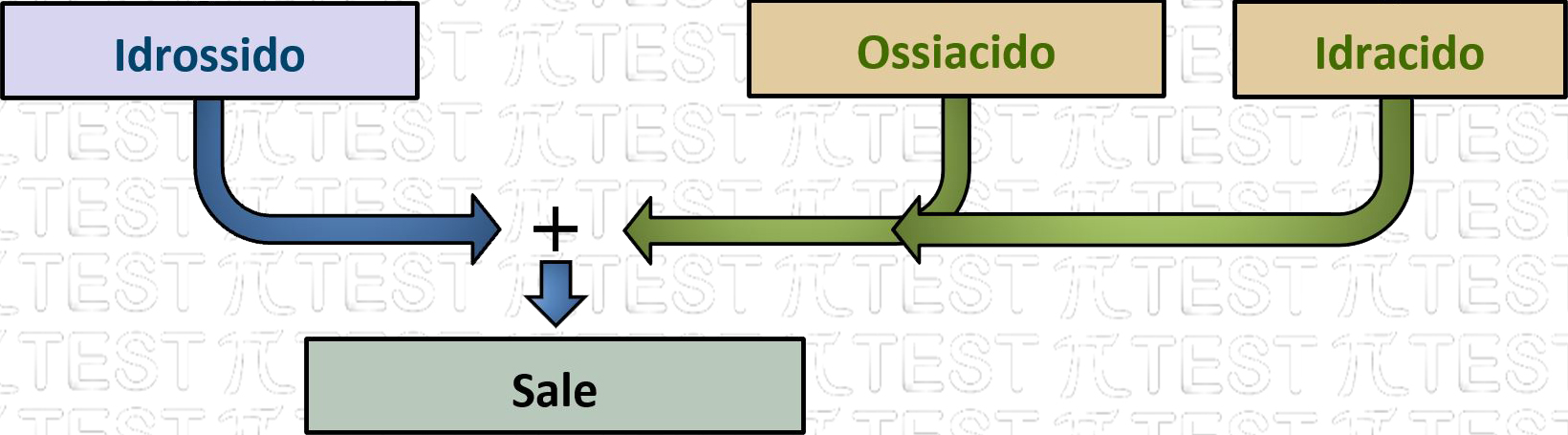
Basi ed acidi, composti tra di loro opposti nel comportamento in acqua (le basi liberano ioni ossidrile OH– e gli acidi liberano ioni H+), reagiscono tra di loro per dare una reazione di sintesi che da luogo ai sali.
L’esempio più semplice che viene spesso citato nei quiz prevede la reazione tra l’idrossido di sodio NaOH e l’acido cloridrico HCl.
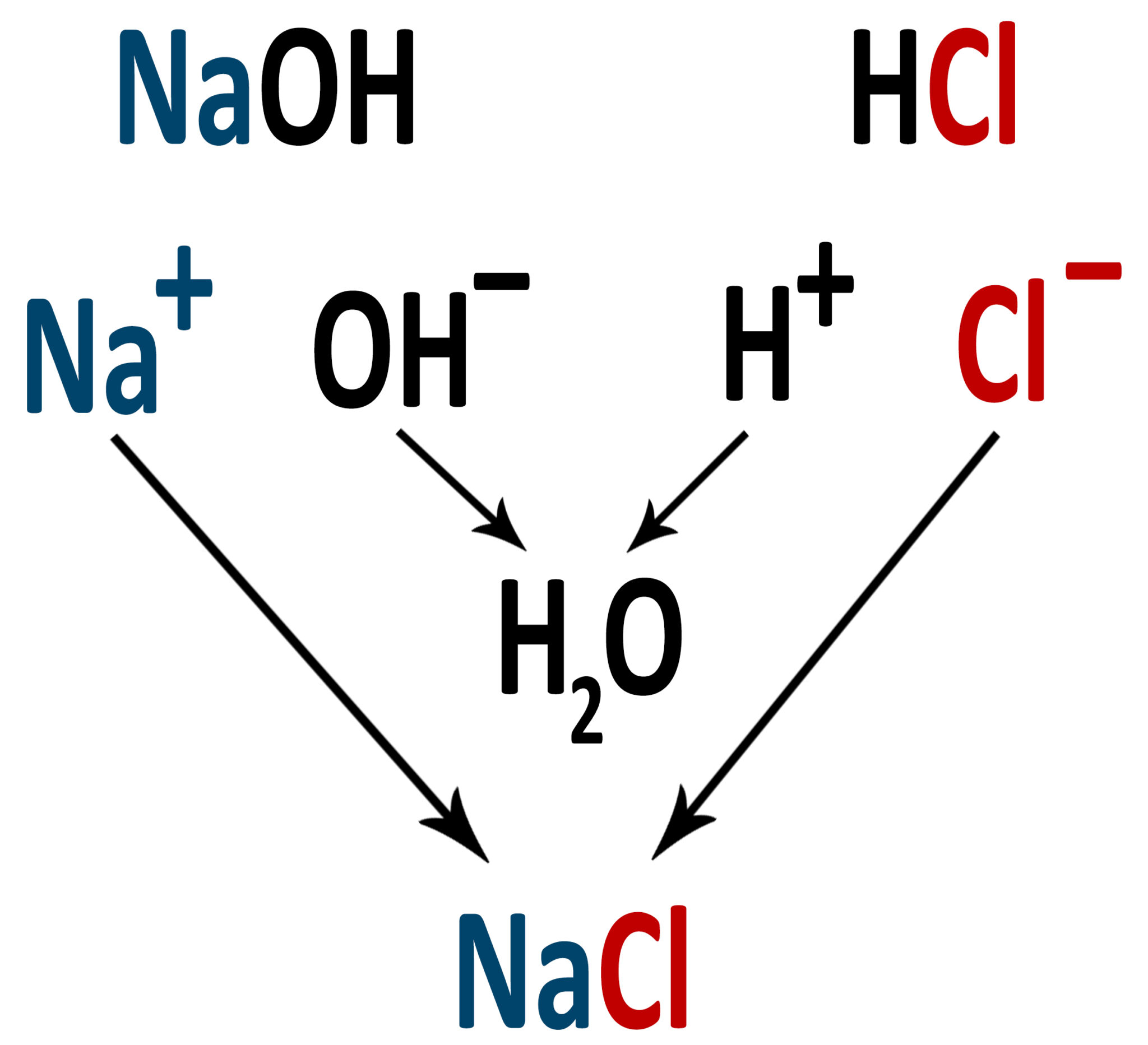
In acqua i due reagenti danno entrambi idrolisi:
| NaOH → Na+ + OH− | HCl → H+ + Cl− |
OH− e H+ si uniscono neutralizzandosi a vicenda e creando una molecola d’acqua:
OH− + H+ → H2O
Lo ione sodio Na+ e lo ione cloruro Cl− formano il sale cloruro si sodio NaCl.
La reazione complessiva è:
NaOH + HCl → NaCl + H2O
Nella scrittura del sale compare a sinistra il catione e a destra l’anione.
Vediamo, come altro esempio, la reazione tra l’idrossido di sodio NaOH e l’acido solforico H2SO4.
In acqua i due reagenti danno entrambi idrolisi:
| NaOH → Na+ + OH− | H2SO4 → 2H+ + SO42− |
Nella formazione del sale il catione sodio Na+ possiede carica +1 e l’anione solfato SO42− possiede carica −2.
Nel sale che si formerà saranno perciò presenti due Na+ per dare una carica complessiva +2 che compenserà la carica −2 del SO42−. Si formerà il sale solfato si sodio Na2SO4.
OH− e H+ si uniscono neutralizzandosi a vicenda e creando due molecole d’acqua:
2OH− + 2H+ →2H2O
La reazione complessiva è:
2NaOH + H2SO4 → Na2SO4+ 2H2O
Vediamo, come ultimo esempio, la reazione tra l’idrossido ferrico Fe(OH)3 e l’acido solforico H2SO4.
In acqua i due reagenti danno entrambi idrolisi:
| Fe(OH)3 → Fe3+ + 3OH− | H2SO4 → 2H+ + SO42− |
Nella formazione del sale le cariche dovranno equilibrarsi. Avremo così due atomi del catione ferrico Fe3+ con una carica complessiva +6 e due ioni solfato SO42− con una carica complessiva -6.
Si può giungere alla determinazione del rapporto tra numero di cationi e numero di anioni con uno schema a croce come in figura.
OH− e H+ si uniscono neutralizzandosi a vicenda e creando sei molecole d’acqua:
6OH− + 6H+ →6H2O
Lo ione ferrico Fe3+ e lo ione solfato SO42− formano il sale solfato Ferrico Fe2(SO4)3.
La reazione complessiva è:
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3+ 6H2O
Casi particolari
Nella formazione dei sali possono partecipare anche lo ione ammonio NH4+ e lo ione cianuro CN−.
Abbiamo così ad esempio il cloruro di ammonio NH4Cl e il cianuro di potassio KCN.
Sali di acidi organici
Tra gli acidi organici il più utilizzato nei quiz è l’acido acetico CH3COOH che con il suo ione acetato CH3COO− può formare sali come ad esempio l’acetato di sodio CH3COONa. Nei sali organici il catione metallico non viene scritto all’inizio della formula come nei sali inorganici.
5.3.14 Idruri metallici
Gli idruri sono composti contenenti idrogeno ed elementi metallici fino al quinto gruppo. Quando gli idruri si formano con elementi metallici (più frequentemente del primo e secondo gruppo)si parla di idruri metallici. In questi l’idrogeno possiede un numero di ossidazione -1.
Lo ione H− è detto ione idruro.
© il testo è di esclusiva proprietà dell’autore ed è sottoposto a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito
QUIZ sulla Nomenclatura tradizionale |
|||
|---|---|---|---|