3.4 La Tavola Periodica
Gli atomi che abbiamo studiato in sequenza nel paragrafo 3.2 vengono rappresentati in modo schematico nella tavola degli elementi ideata dal chimico russo Mendeleev nel 1907 per raggruppare proprietà simili che ricorrono in modo periodico. Per questo prende il nome di Tavola Periodica.
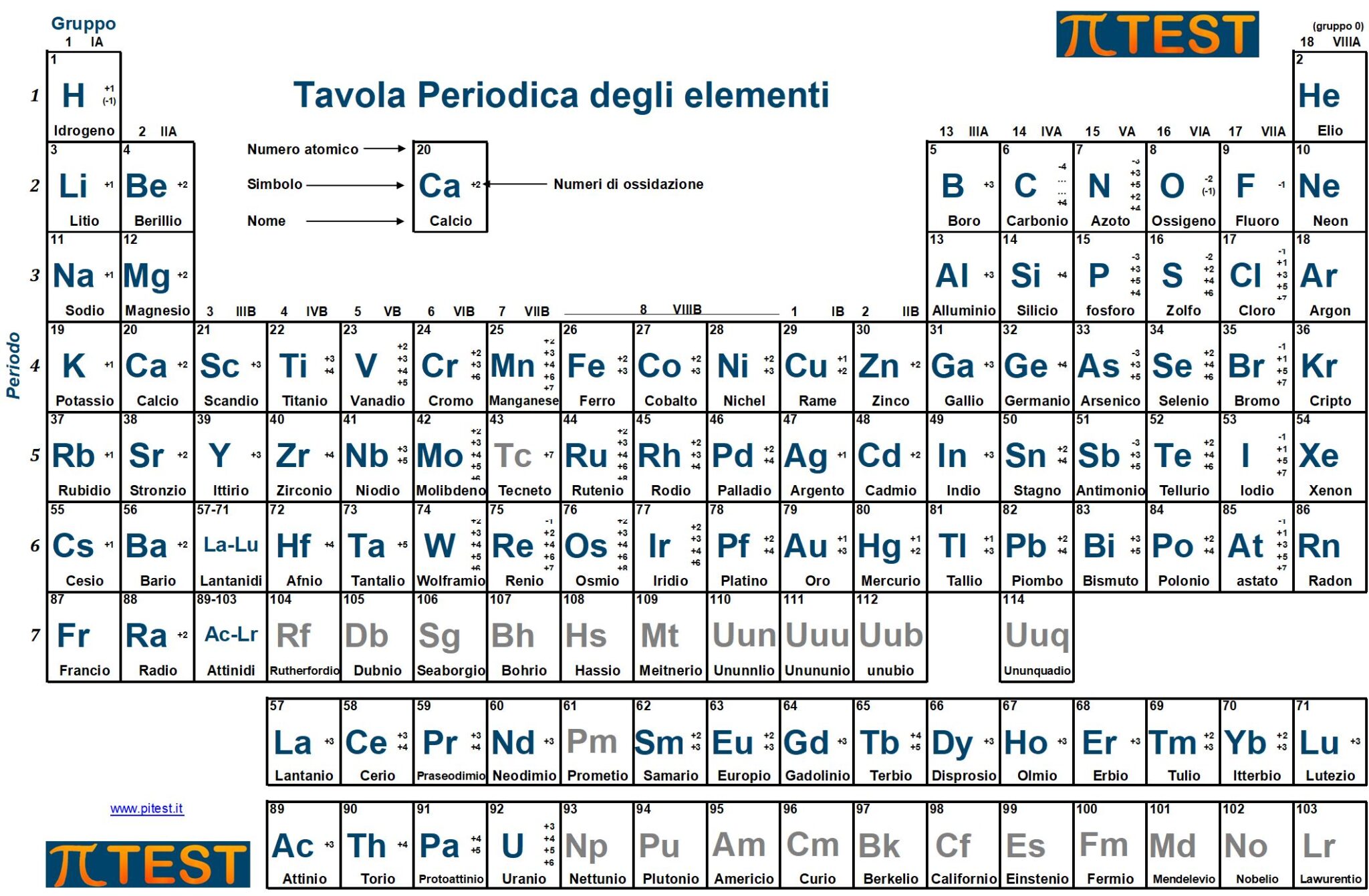
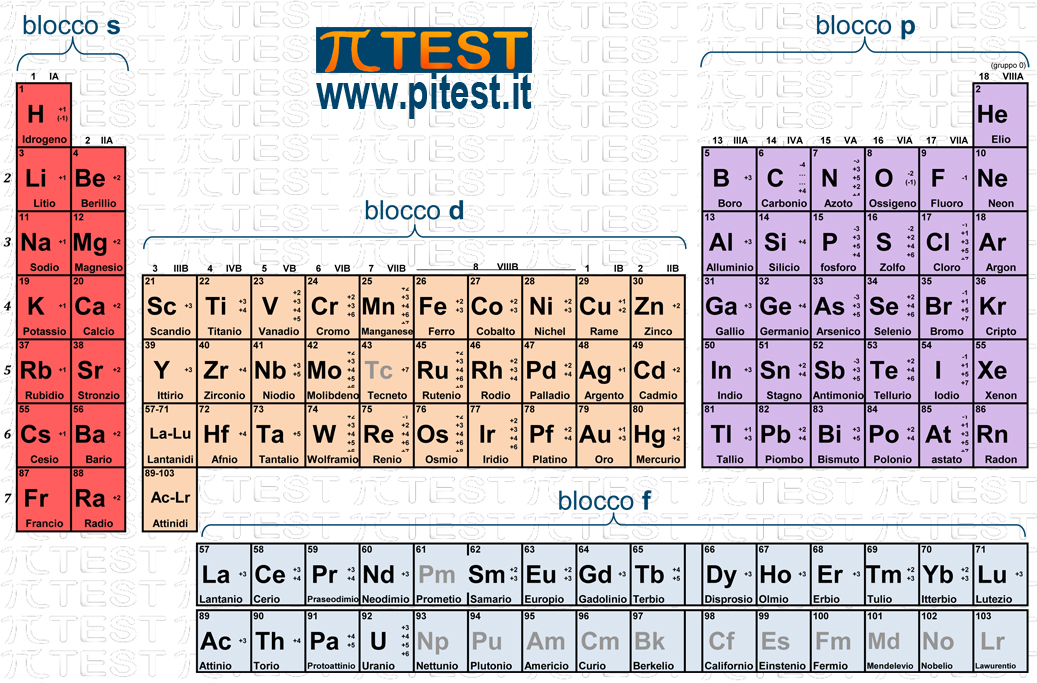
Poiché durante lo svolgimento del test non sarà possibile consultare una tavola periodica, è opportuno memorizzare il nome e la posizione nella tavola periodica di alcuni elementi chimici indicati nella seguente immagine.
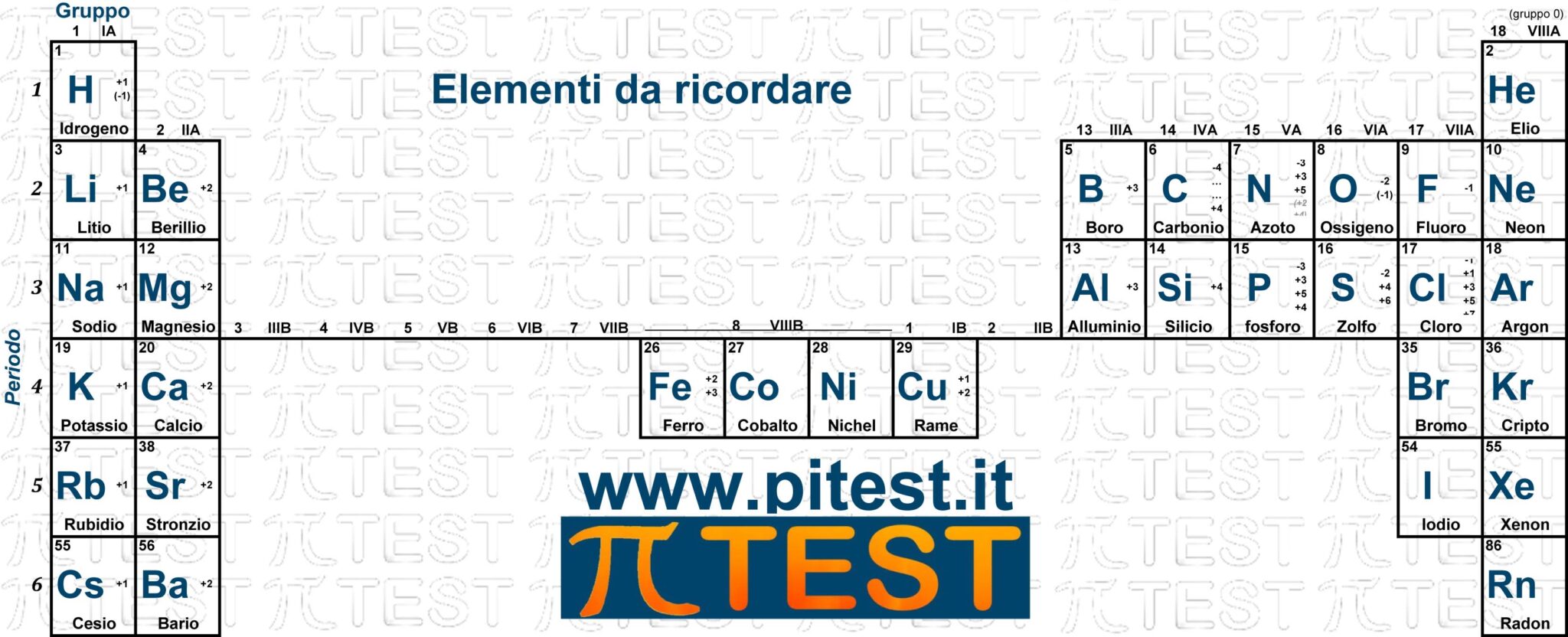
Usa il seguente schema vuoto scaricabile per esercitarti nella memorizzazione.
Visualizza questo post su Instagram
3.4.1 Periodi, livelli e sottolivelli
La Tavola Periodica è costruita riportando gli atomi con numero atomico crescente secondo righe. Ogni riga, chiamata periodo, contiene tutti gli elementi che possiedono elettroni nel guscio esterno corrispondente. A sinistra troviamo l’elemento con un solo elettrone nell’orbitale s e a destra troviamo l’elemento che possiede otto elettroni nel guscio esterno ripartiti tra l’orbitale s e i tre orbitali p. Di quest’ultimo elemento diciamo che possiede l’ottetto completo.
Il primo periodo ha solo due elementi: l’idrogeno H e l’elio He. Nel caso del primo periodo diciamo che l’elio He possiede il duetto completo.
Per il secondo periodo abbiamo a sinistra il litio Li e all’ultimo posto in neon Ne che possiede l’ottetto completo.
Per i periodi successivi vale lo stesso ragionamento.
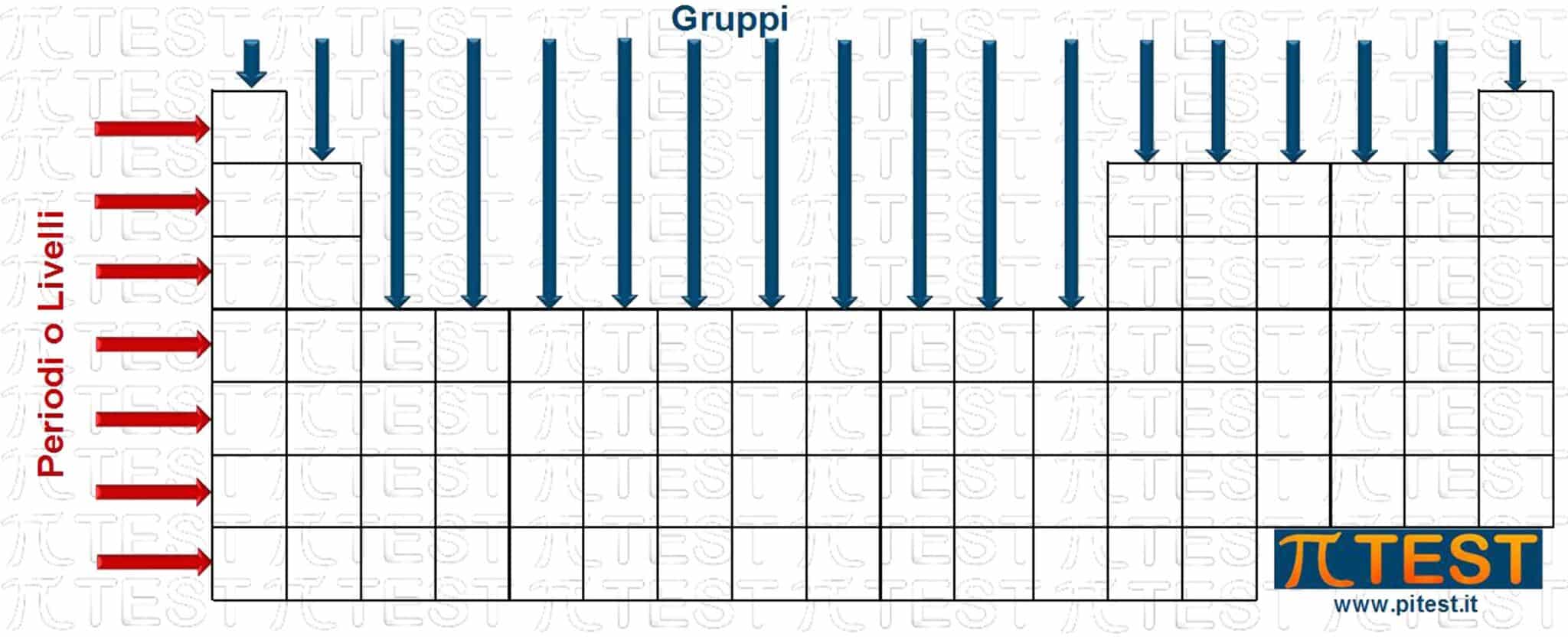
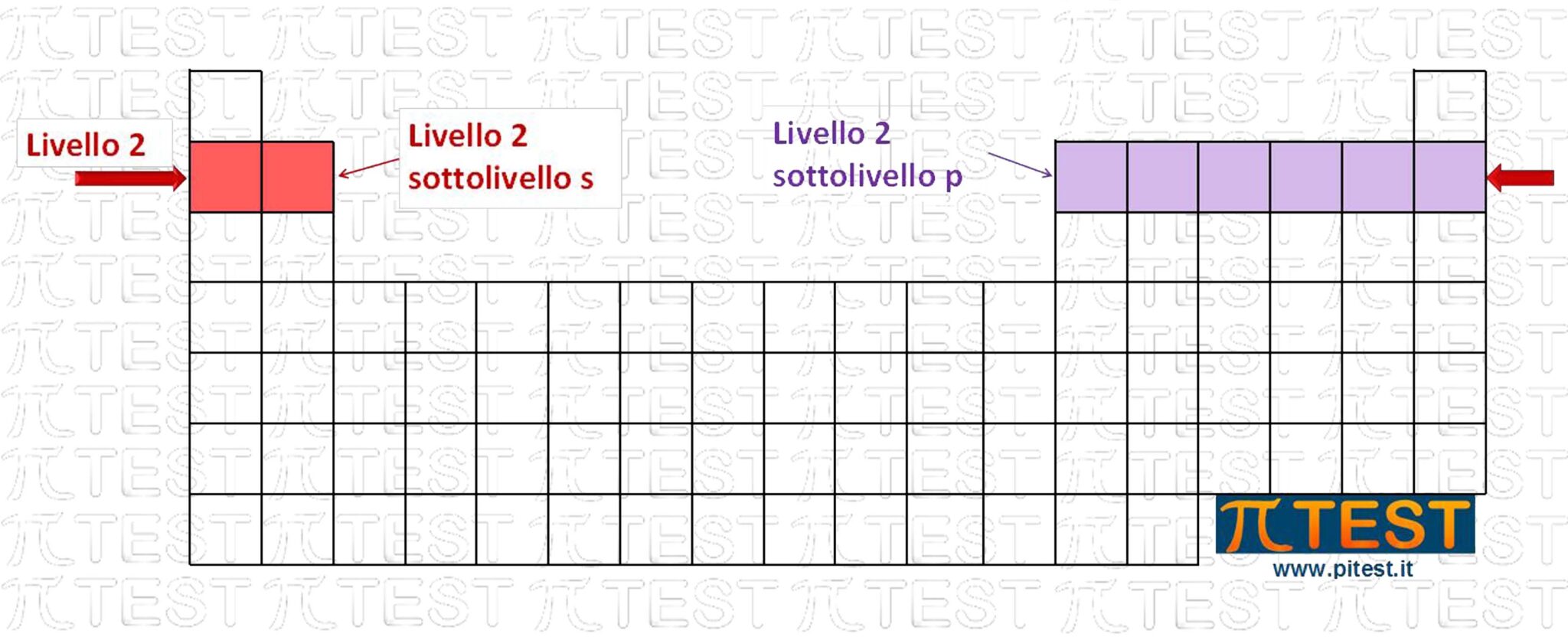
Un periodo può essere chiamato anche livello. Utilizziamo il concetto di stato energetico, come configurazione di una posizione possibile di un elettrone in un orbitale da un punto di vista energetico. Tale configurazione è caratterizzata dall’insieme dei quattro valori dei quattro numeri quantici.
Un livello viene definito come l’insieme degli stati energetici che possiedono lo stesso numero quantico principale n. All’interno di un livello possiamo distinguere anche i sottolivelli che corrispondono all’insieme di tutti gli stati energetici che hanno lo stesso numero quantico principale n e lo stesso numero quantico secondario l.
Ad esempio consideriamo il secondo periodo nel quale troviamo un orbitale s occupato da due possibili elettroni e tre orbitali p occupati da sei possibili elettroni. I due elettroni in 2s costituiscono il sottolivello 2s ed i sei elettroni nei tre orbitali 2p costituiscono il sottolivello 2p.
3.4.2 Gruppi
Nella Tavola Periodica distinguiamo anche le colonne che chiamiamo gruppi. I gruppi sono numerati in due modi diversi.
1. Nella numerazione tradizionale si utilizzano i numeri ordinali romani. Le prime due colonne si chiamano gruppo IA e IIA. La serie “A” continua saltando dieci colonne e termina con il gruppo VIIIA. Tra il gruppo IIA e il IIIA troviamo i dieci gruppi B come risulta in figura.
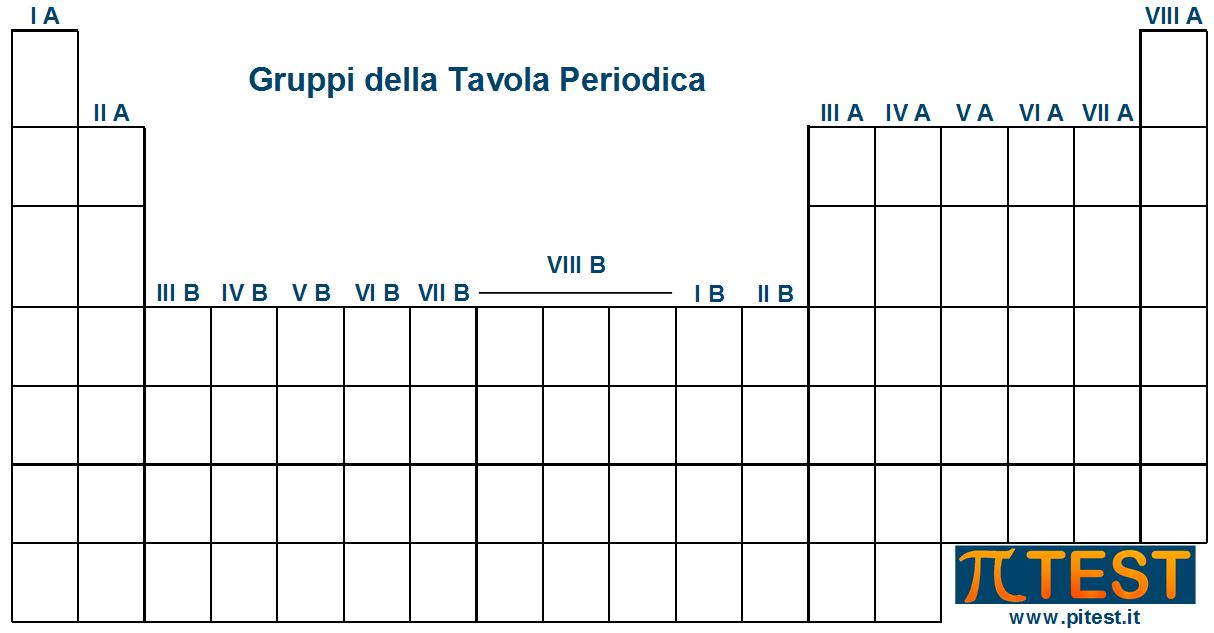
2. Nella numerazione più moderna IUPAC i gruppi sono numerati in modo sequenziale da 1 a 18.
 Tutti gli elementi di uno stesso gruppo hanno caratteristiche simili nel comportamento chimico.
Tutti gli elementi di uno stesso gruppo hanno caratteristiche simili nel comportamento chimico.
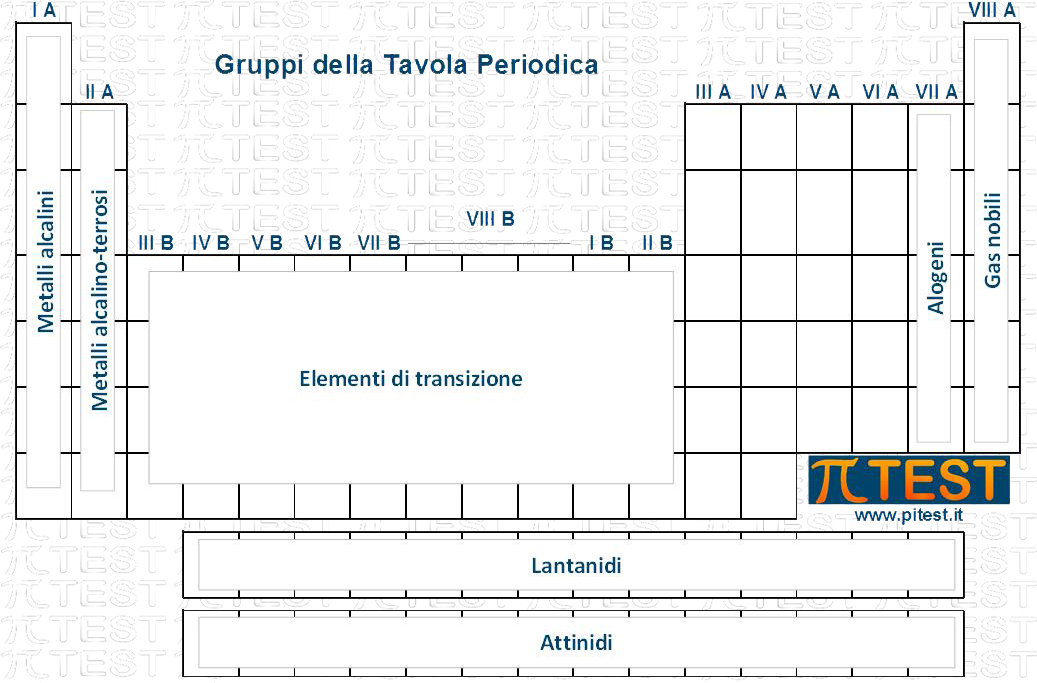
IA – Metalli Alcalini
Il gruppo IA, detto anche “metalli alcalini” è caratterizzato dall’avere un solo elettrone nel guscio più esterno detto guscio di valenza. [La denominazione “alcalini” deriva dal fatto che gli elementi del primo gruppo quando reagiscono con l’acqua formano composti basici che rendono l’acqua alcalina]
| Litio | Li | 1s22s1 |
| Sodio | Na | 1s22s22p63s1 |
| Potassio | K | 1s22s22p63s23p63d104s1 |
| Rubidio | Rb | 1s22s22p63s23p63d104s24p65s1 |
Quest’unico elettrone conferisce a tutti gli elementi del primo gruppo la caratteristica di formare facilmente uno ione positivo monovalente:
| Li ➞ Li+ + e– | Na ➞ Na+ + e– | K ➞ K+ + e– |
Perdendo l’unico elettrone presente nel guscio esterno, l’atomo rimane con una configurazione elettronica uguale all’elemento dell’ottavo gruppo del periodo precedente con un ottetto elettronico completo. Questo conferisce allo ione una particolare stabilità. Il litio Li perdendo un elettrone si trasforma in Li+ che ha la stessa configurazione elettronica dell’elio He. Similmente il sodio Na perdendo un elettrone si trasforma in Na+ che ha la stessa configurazione elettronica del neon Ne. E così via per tutti gli elementi dello stesso gruppo.
La denominazione “alcalini” deriva dal fatto che gli elementi del primo gruppo quando reagiscono con l’acqua formano composti basici che rendono l’acqua alcalina.
IIA – Metalli Alcalino Terrosi
Il gruppo IIA, detto anche “metalli alcalino-terrosi” è caratterizzato dall’avere due elettroni nel guscio più esterno detto guscio di valenza. [La denominazione “alcalino-terrosi” deriva dal fatto che gli elementi del secondo gruppo, similmente a quelli del primo gruppo, quando reagiscono con l’acqua formano composti basici che rendono l’acqua alcalina. Il termine “terrosi” deriva al fatto che compongono molte rocce del pianeta e si trovano facilmente nella terra. ]
| Berillio | Be | 1s22s2 |
| Magnesio | Mg | 1s22s22p63s2 |
| Calcio | Ca | 1s22s22p63s23p63d104s2 |
| Stronzio | Sr | 1s22s22p63s23p63d104s24p65s2 |
Questi due elettroni conferiscono a tutti gli elementi del secondo gruppo la caratteristica di formare facilmente uno ione positivo bivalente:
| Be ➞ Be2+ + 2e– | Mg ➞ Mg2+ + 2e– | Ca ➞ Ca2+ + 2e– |
Perdendo i due elettroni presenti nel guscio esterno, l’atomo rimane con una configurazione elettronica uguale all’elemento dell’ottavo gruppo del periodo precedente con un ottetto elettronico completo. Questo conferisce allo ione una particolare stabilità. Il berillio Be perdendo due elettroni si trasforma in Be2+ che ha la stessa configurazione elettronica dell’elio He. Similmente il magnesio Mg perdendo due elettroni si trasforma in Mg2+ che ha la stessa configurazione elettronica del neon Ne. E così via per tutti gli elementi dello stesso gruppo.
IIIA IVA VA VIA
All’interno di ciascun gruppo gli elementi presentano caratteristiche di comportamento simile nel formare composti.
VIIA – Alogeni
Negli elementi del settimo gruppo VIIA, detto anche “alogeni”, sono presenti sette elettroni nel guscio esterno; ne manca solo uno per completare l’ottetto.
| Fluoro | F | 1s22s22p5 |
| Cloro | Cl | 1s22s22p63s23p5 |
| Bromo | Br | 1s22s22p63s23p63d104s24p5 |
| Iodio | I | 1s22s22p63s23p63d104s24p65d105s25p5 |
Gli alogeni accettano con facilità un ottavo elettrone per formare uno ione negativo monovalente:
| F + e‒ ➞ F‒ | Cl + e‒ ➞ Cl‒ | Br + e‒ ➞ Br‒ | I + e‒ ➞ I‒ |
Acquistando un elettrone, l’atomo raggiunge una configurazione elettronica uguale all’elemento successivo dell’ottavo gruppo con un ottetto elettronico completo.
VIIIA
Gli elementi dell’ottavo gruppo VIIIA, detto anche “gas nobili”, presentano l’ottetto completo.
Non hanno bisogno di combinarsi in molecole poliatomiche e sono presenti in natura sotto forma di molecole gassose monoatomiche. A volte l’ottavo gruppo è stato chiamato “gruppo zero”.
IB IIB … XB
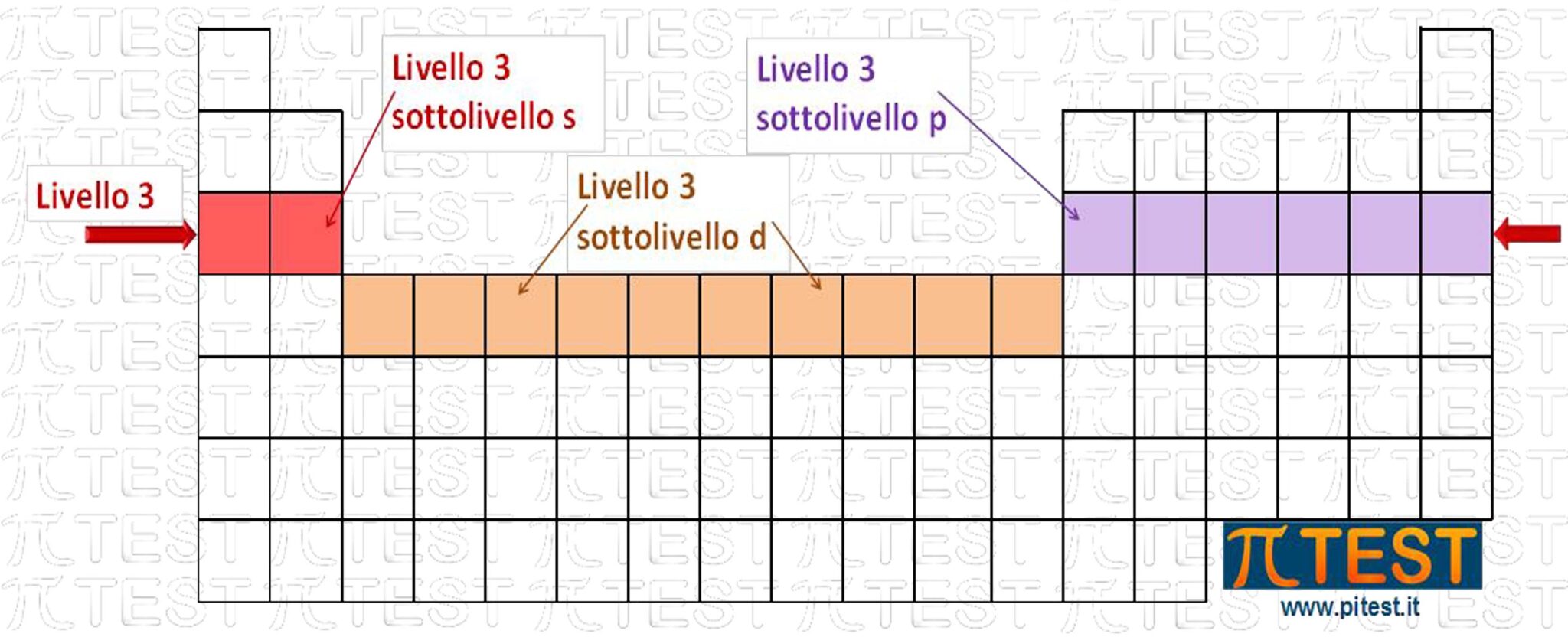
I dieci elementi del gruppo B sono detti elementi di transizione o metalli di transizione. Sono caratterizzati dall’avere elettroni in fase di completamento nel blocco degli orbitali d. Hanno tra di loro caratteristiche simili in quanto gli orbitali s e p sono completi (con alcune eccezioni che non approfondiamo), sono tutti metalli e possono formare leghe metalliche (miscugli omogenei allo stato solido).
LANTANIDI E ATTINIDI
Il riempimento degli orbitali f che rispetta il principio dell’Aufbau porta a individuare il sottolivello f dei livelli 4 e 5. Il riempimento degli orbitali f avviene con modalità simile al riempimento dei sottolivelli d, cioè con una specie di “ritardo” per rispettare il principio di riempimento dei livelli con più bassa energia.
Questi elementi prendono il nome di lantanidi e attinidi.
Nota bene: La famiglia di elementi Lantanidi e la famiglia degli attinidi sono sottolivelli f e non sono gruppi.
3.4.3 Blocchi
Al fine di completare la classificazione vediamo che la Tavola Periodica può essere suddivisa in blocchi.
Distinguiamo così:
il blocco s che comprende i primi due gruppi nei quali avviene il riempimento degli orbitali s.
il blocco p che comprende i gruppi dal terzo all’ottavo nei quali avviene il riempimento degli orbitali p.
il blocco d che comprende gli elementi di transizione nei quali avviene il riempimento degli orbitali d.
3.4.4 Informazioni presenti nella tavola periodica
Nelle diverse versioni in commercio della tavola periodica sono presenti molte informazioni che riguardano gli elementi chimici. I dati che si ritrovano di solito sono quelli in figura:
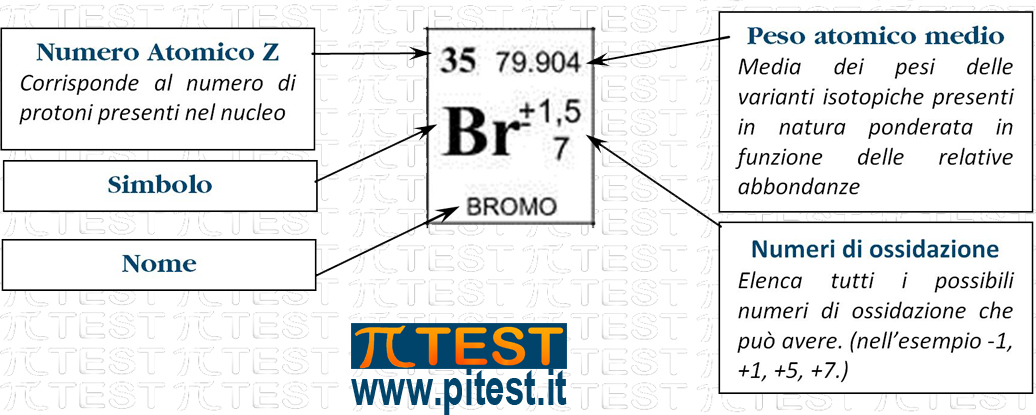
In versioni più complete possiamo trovare anche:
- la configurazione elettronica (per il bromo avremmo 1s22s22p63s23p63d104s24p5 oppure [Ar] 3d104s24p5)
- la temperatura di fusione ( o punto di fusione)
- l’energia di prima ionizzazione
- l’elettronegatività
- la densità
© il testo è di esclusiva proprietà dell’autore ed è sottoposto a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito
QUIZ su La Tavola Periodica |
|||
|---|---|---|---|