5.1 Il numero di ossidazione
Abbiamo già visto nel paragrafo 4.1 il numero di valenza, cioè la capacità che un atomo possiede di scambiare un certo numero di elettroni per formare legami. Ora estendiamo questo concetto associando a tale numero anche un segno positivo o negativo. Chiameremo questo valore numero di ossidazione.
In un orbitale di legame il doppietto elettronico che lo occupa può trovarsi uniformemente distribuito tra i due atomi solo nel caso che gli atomi siano uguali. Ad esempio nell’ossigeno gassoso O2 il doppio legame O=O è puro (o omopolare) e gli elettroni presenti sono equamente distribuiti tra i due atomi di ossigeno. In tal caso diciamo che il numero di ossidazione è zero. Al contrario nell’acido fluoridrico HF abbiamo due atomi con diversa elettronegatività (Per H vale 2,20 e per F vale 3,98). H e F sono legati da un legame singolo ed hanno perciò entrambi valenza 1. Il numero di ossidazione vale +1 per l’idrogeno, il meno elettronegativo dei due, e –1 per il fluoro, il più elettronegativo dei due. Il doppietto elettronico di legame è spostato prevalentemente sul fluoro che quindi tende a possedere una polarità negativa, mentre l’idrogeno avrà una polarità positiva.
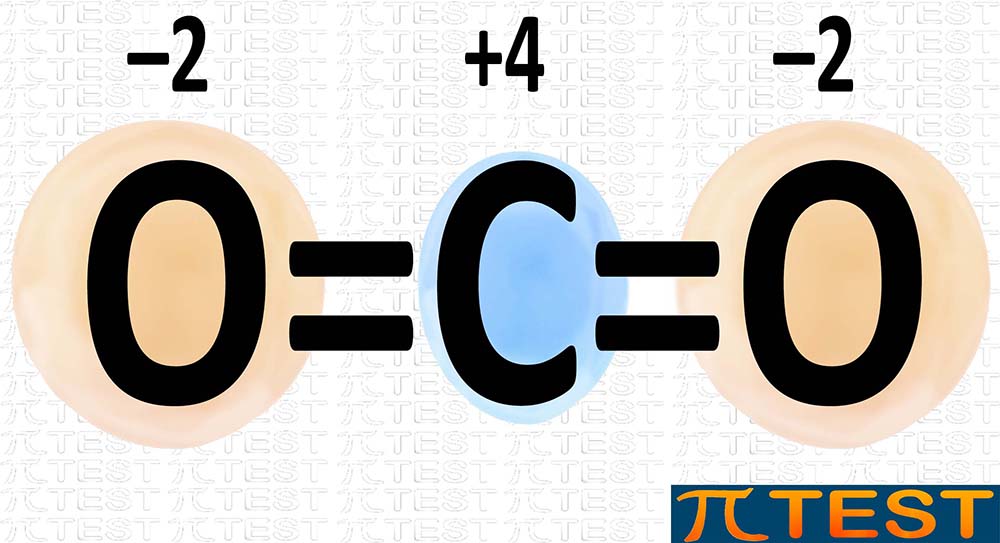
In base ai numeri di ossidazione che possiedono gli elementi che compongono le molecole possiamo stabilire quali e quanti legami si possono formare e di conseguenza anche quale sia il corretto rapporto tra i numeri di atomi presenti. Ad esempio se consideriamo il carbonio con numero di ossidazione +4 e l’ossigeno con numero di ossidazione –2, potremo capire che la molecola che può formarsi è CO2 perché è con questa combinazione di atomi il valore +4 del carbonio si bilancia con i due valori –2 dell’ossigeno.
| Esempi di attribuzione del numero di ossidazione nelle molecole |
 |
|
CO2 Anidride carbonica L’ossigeno è più elettronegativo del carbonio; di conseguenza gli elettroni di legame sono più spostati verso l’ossigeno. Numero di ossidazione degli elementi presenti: C +4 O ‒2 La somma di tutti i numeri di ossidazione degli atomi presenti vale zero: +4‒2‒2=0 |
 |
|
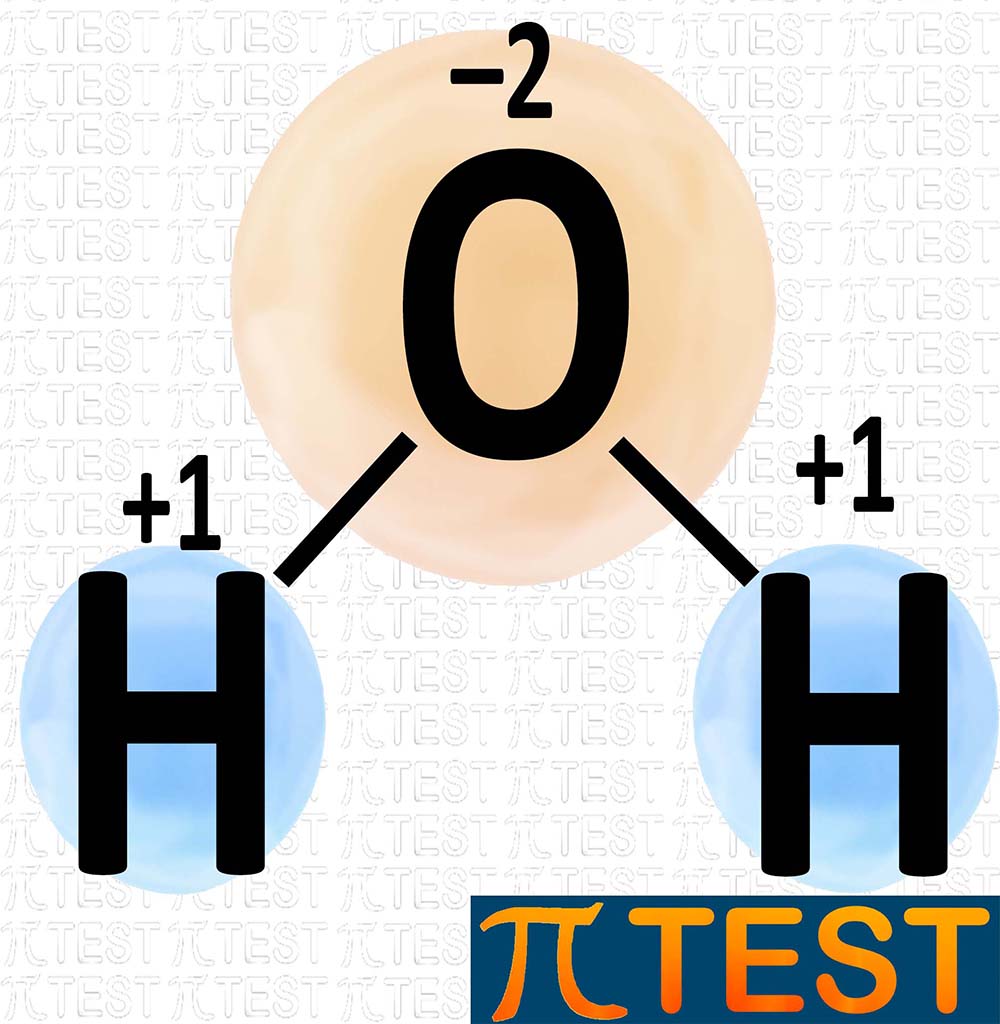
H2O Acqua L’ossigeno è più elettronegativo dell’idrogeno; di conseguenza gli elettroni di legame sono più spostati verso l’ossigeno. Numero di ossidazione degli elementi presenti: H +1 O ‒2 La somma di tutti i numeri di ossidazione degli atomi presenti vale zero: ‒2+1+1=0 |
 |
|
O2 Ossigeno gassoso Sono presenti atomi di uno stesso elemento, il legame covalente è puro; di conseguenza gli elettroni di legame sono equidistribuiti. Numero di ossidazione degli elementi presenti in questo caso (elemento puro) vale zero. |
QUIZ sul numero di ossidazione
© il testo è di esclusiva proprietà dell’autore ed è sottoposto a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito
5.2 Regole del numero di ossidazione


