10.6.6 ETERI
Un etere è formato da un atomo di ossigeno che collega due radicali. Possiamo immaginare una molecola d’acqua nella quale i due idrogeni sono sostituiti da due radicali organici.
La formula generica di un etere è:
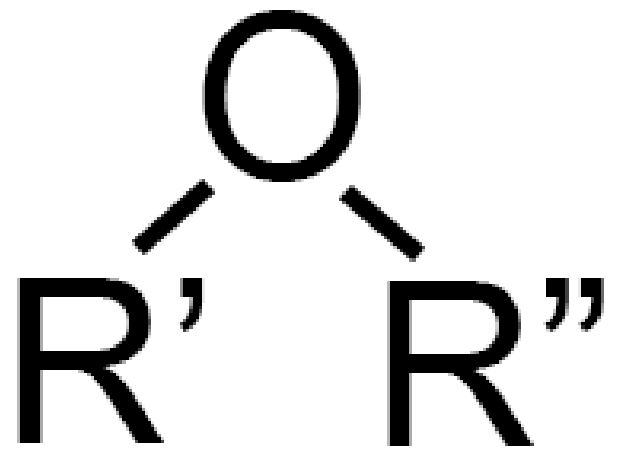
I due radicali sono disegnati con legami inclinati a ricordare la struttura tridimensionale piegata della molecola d’acqua (vedi) che conserva la forma anche quando i due atomi di idrogeno sono sostituiti.
Nei quiz dei test di ammissione finora gli eteri sono stati sempre nominati solo con la nomenclatura tradizionale. Negli esempi seguenti riportiamo, per completezza, anche la nomenclatura IUPAC.
| Formula | Nome IUPAC | Nome tradizionale |
CH3−O−CH3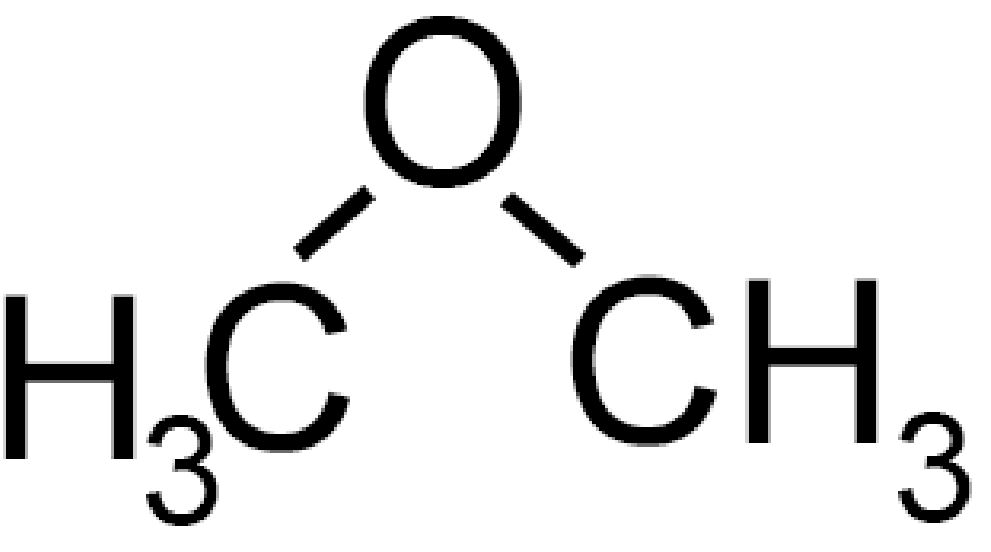 |
Dimetiletere (etere dimetilico) | Met ossi metano |
CH3−O−C2H5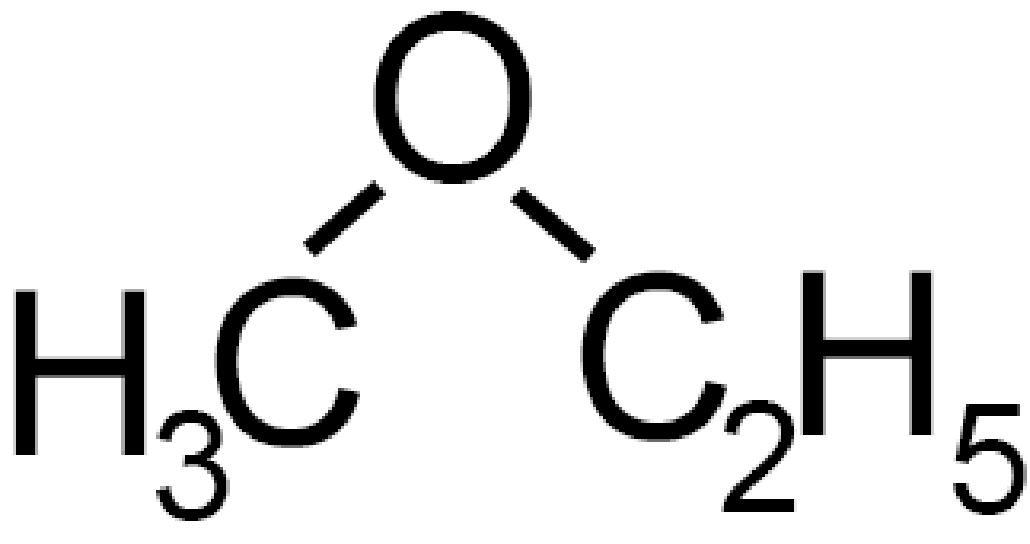 |
Metil-etil-etere | Met ossi etano |
C2H5−O−C2H5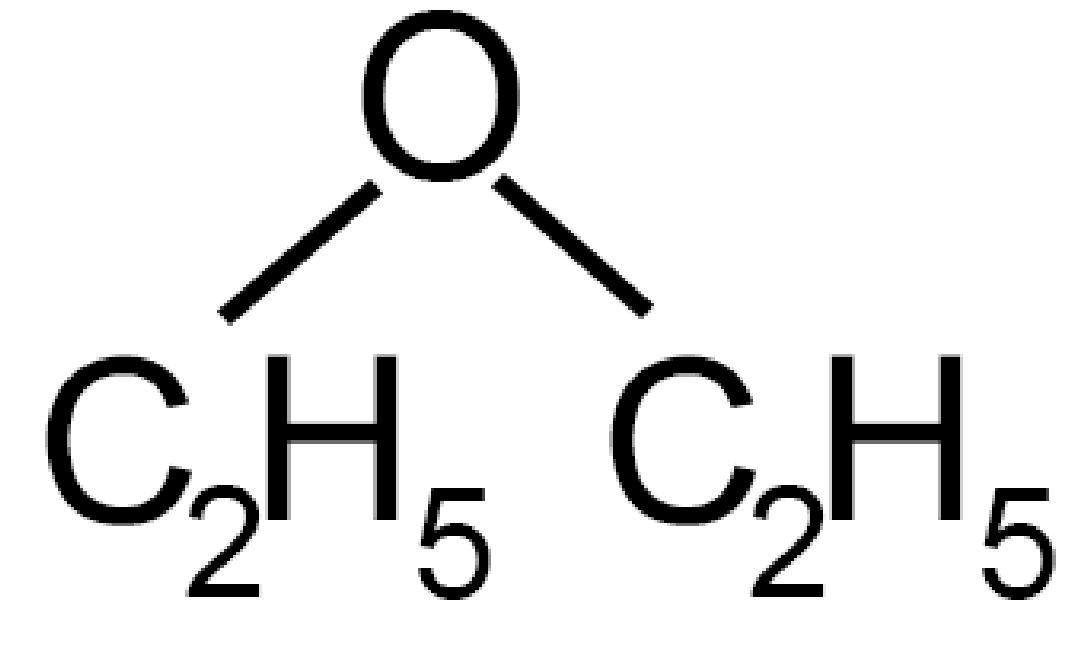 |
Dietiletere (etere dietilico) | Et ossi etano |
C6H5−O−CH3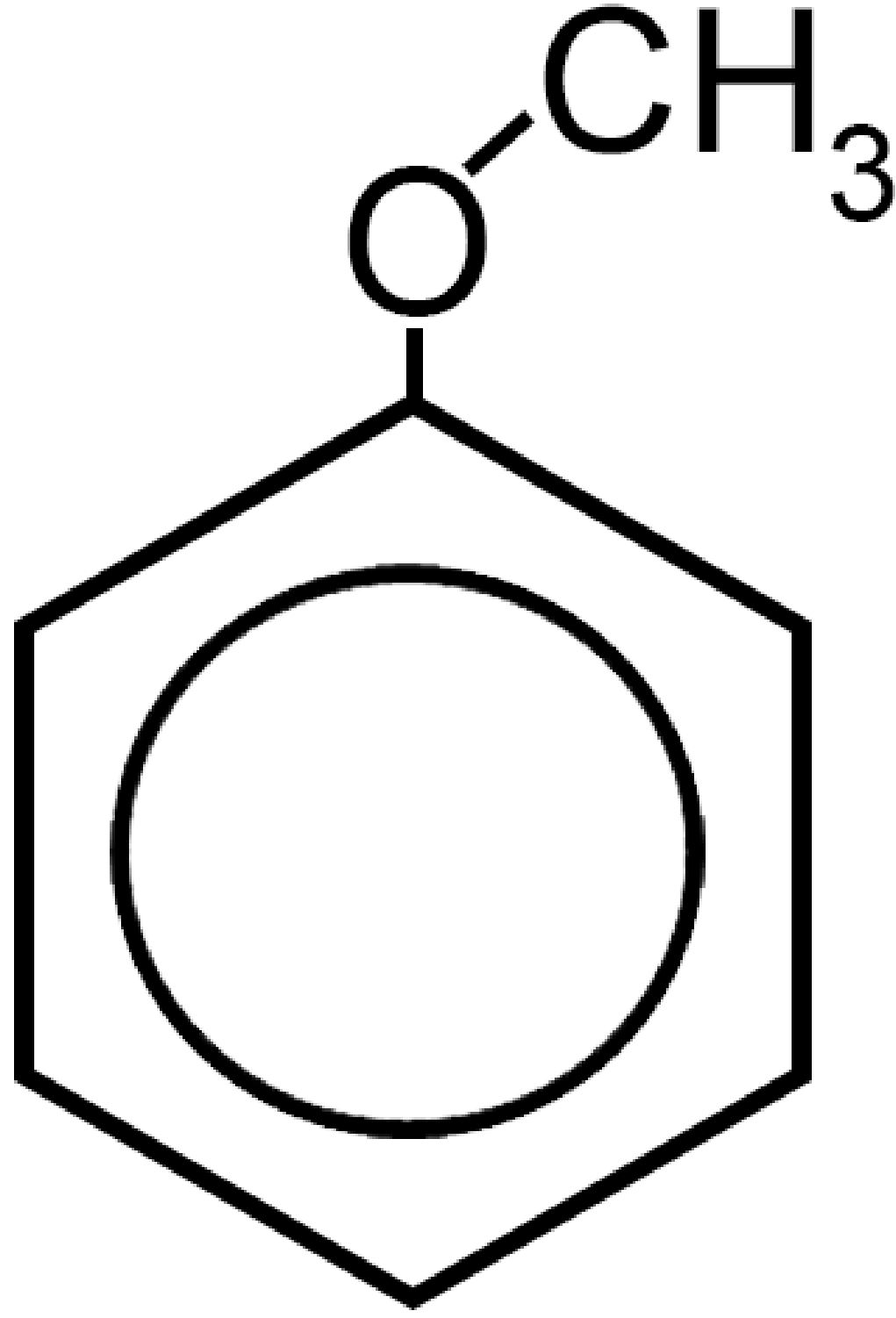 |
Metil-fenil-etere | Fen ossi metano |
PROPRIETÀ FISICHE DEGLI ETERI
L’atomo di ossigeno che lega i due radicali deriva idealmente da una molecola d’acqua (ibridazione sp3) e può dare legami intermolecolari a idrogeno (ponte idrogeno) con l’acqua con la quale sono perciò leggermente miscibili (a differenza degli idrocarburi dei radicali dai quali l’etere deriva). Sono comunque buoni solventi degli idrocarburi per la natura a polare delle due catene radicaliche. Se confrontiamo un etere con l’alcol suo isomero, hanno un punto di ebollizione più basso (sono più volatili) perché, a differenza con l’etere, l’alcol sui gruppi alcolici −OH forma ponti idrogeno tra molecola e molecola.
Per esempio consideriamo due molecole che possiedono la stessa formula bruta C2H6O: l’alcol etilico CH3−CH2OH e l’etere dimetilico CH3−O−CH3
L’alcol etili bolle a 78°C, valore discretamente elevato dovuto ai forti legami intermolecolari a idrogeno che si realizzano sui gruppi alcolici −OH. L’etere dimetilico, più volatile, bolle a −24°C, valore sensibilmente più basso.
PREPARAZIONE DEGLI ETERI
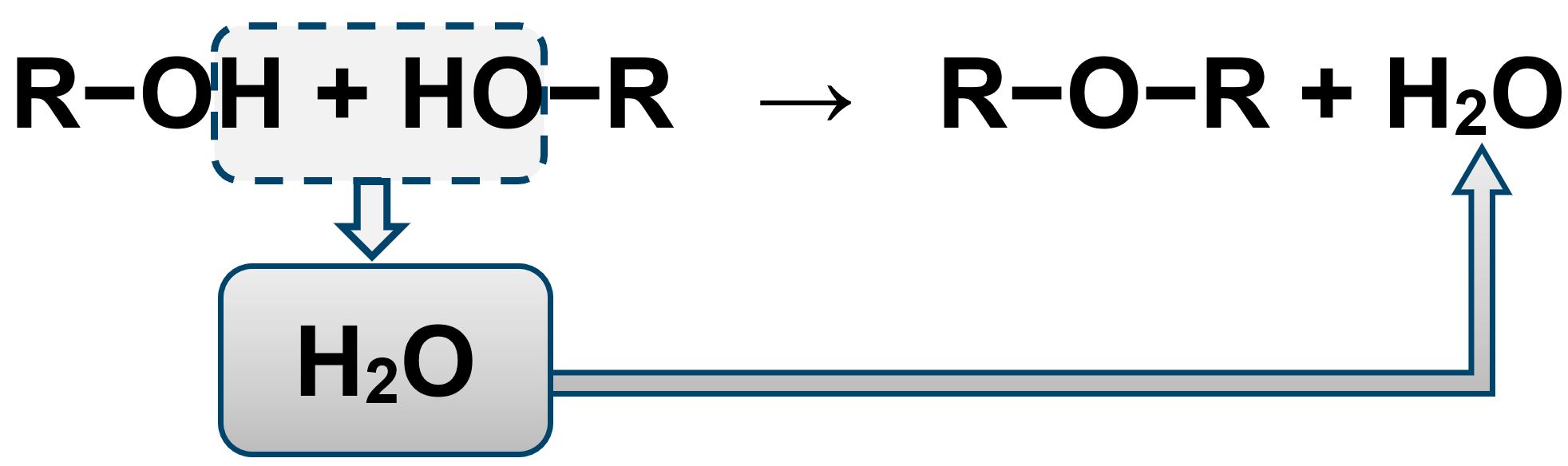
Un etere si prepara facendo reagire due alcoli con eliminazione di una molecola d’acqua. Quando due composti organici reagiscono sintetizzando una molecola più complessa ed eliminando una molecola d’acqua, la reazione è nota come “condensazione”.
© il testo è di esclusiva proprietà dell’autore ed è sottoposto a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito
CONTINUA LO STUDIO DELLA CHIMICA ORGANICA
10.1 Idrocarburi
10.2 Idrocarburi alifatici
10.2.1 Idrocarburi alifatici saturi: gli ALCANI
10.2.2 Radicali alchilici
10.2.3 Idrocarburi ramificati
10.2.4 Proprietà fisiche e chimiche degli alcani
10.2.5 Idrocarburi insaturi: ALCHENI
10.2.6 Proprietà fisiche e chimiche degli alcheni
10.2.7 Idrocarburi insaturi: ALCHINI
10.2.8 Proprietà fisiche e chimiche degli alchini
10.2.9 POLIENI
10.2.10 CICLOALCANI, CICLOALCHENI E COCLOALCHINI
10.2.11 Composti ETEROCICLICI SATURI
10.3 Gli isomeri
10.3.1 Isomeri COSTITUZIONALI DI CATENA
10.3.2 Isomeri COSTITUZIONALI DI POSIZIONE
10.3.3 Isomeri COSTITUZIONALI DI FUNZIONE
10.3.4 Stereoisomeri CONFORMAZIONALI
10.3.5 Stereoisomeri CONFIGURAZIONALI GEOMETRICI
10.3.6 Stereoisomeri CONFIGURAZIONALI OTTICI
10.4 IDROCARBURI AROMATICI
10.4.1 BENZENE
10.4.2 I PRINCIPALI COMPOSTI AROMATICI DERIVANTI DAL BENZENE ‒ ARENI
10.4.3 IDROCARBURI POLICICLICI AROMATICI
10.4.4 COMPOSTI ETEROCICLICI INSATURI
10.5 ADDIZIONE E SOSTITUZIONE ELETTROFILA
10.5.1 ADDIZIONE ELETTROFILA
10.5.2 SOSTITUZIONE ELETTROFILA
10.6 GRUPPI FUNZIONALI
10.6.1 ALOGENURI ALCHILICI E ARILICI
10.6.3 ALCOLI
10.6.4 Proprietà fisiche e chimiche e preparazione degli ALCOL
10.6.5 POLIALCOLI (POLIOLI)
10.6.6 ETERI
10.6.7 CARBONILE – ALDEIDI E CHETONI
10.6.8 CARBOSSILE – ACIDI ORGANICI
10.6.9 ANIDRIDI
10.6.10 ESTERI
10.6.11 LIVELLI DI OSSIDAZIONE DELLE MOLECOLE ORGANICHE
10.6.12 SAPONIFICAZIONE
10.6.13 FOSFOLIPIDI
10.6.14 LIPIDI O GRASSI
10.6.15 AMMINE
10.6.16 AMMIDI
10.6.17 AMMINOACIDI – PROTEINE
10.7 POLIMERI
10.8 CARBOIDRATI


