7,9K
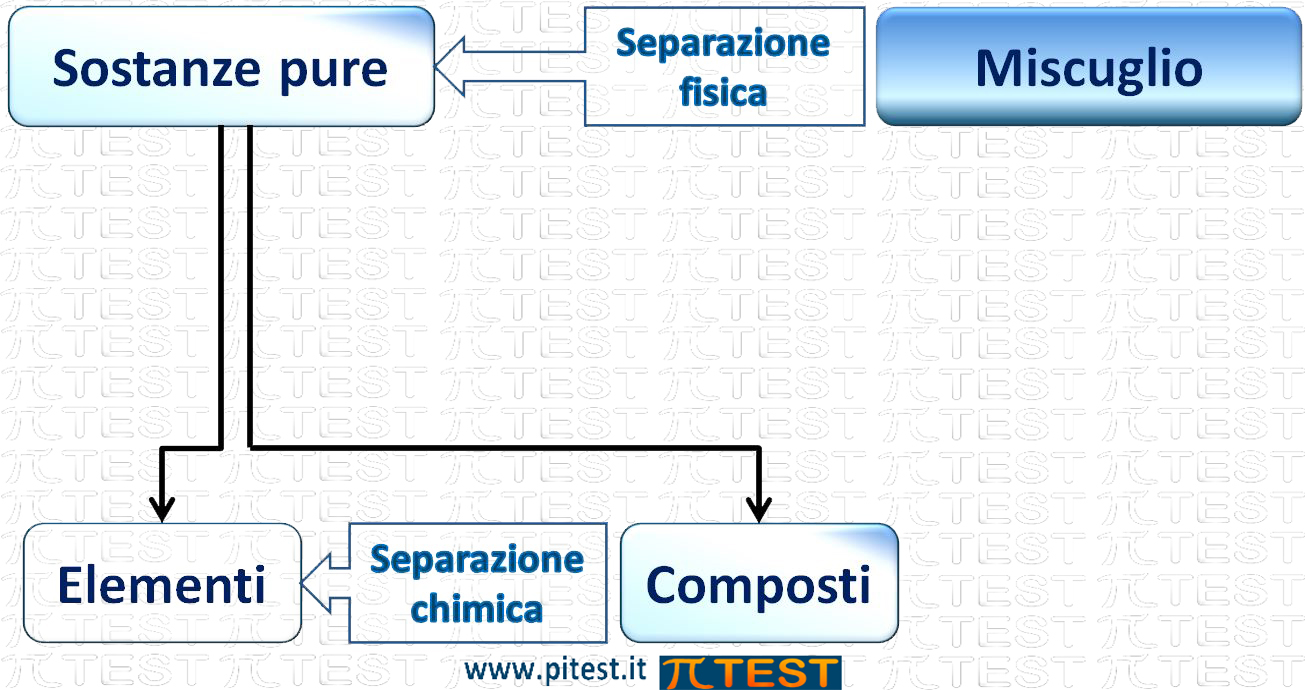
1.2 I metodi di separazione
1.2.1 Separazione fisica
In un miscuglio le diverse sostanze presenti si possono separare con diverse metodologie. Le più impostanti sono:
| Distillazione |
| La distillazione permette di separare soluzioni di due o più liquidi, ad esempio acqua ed alcol etilico. Si basa sulla diversa volatilità dei componenti, ovvero sulle diverse temperature di ebollizione [un liquido è tanto più volatile quanto più alto è il punto di ebollizione]. Il vapore sovrastante la miscela è sempre più ricco del componente più volatile rispetto a quanto lo sia la miscela liquida. Tale vapore viene fatto condensare per raffreddamento ottenendo una nuova miscela liquida che avrà la stessa concentrazione del vapore e sarà perciò più ricca del componente più volatile rispetto alla miscela di partenza. L’operazione viene ripetuta più volte fino ad ottenere da solo il componente più volatile. |
| Cromatografia |
| La cromatografia si basa sulla diversa velocità di propagazione di diverse sostanze attraverso un mezzo. Le molecole delle varie sostanze hanno la stessa temperatura e di conseguenza hanno la stessa energia cinetica. A parità di energia cinetica molecolare di un miscuglio, le sostanze con un peso molecolare più alto (massa maggiore) hanno una velocità inferiore e viceversa. Alla fine della propagazione del miscuglio iniziale le sostanze più leggere arrivano prima e quelle più pesanti arrivano dopo. |
| Filtrazione |
| La filtrazione si utilizza per separare le sostanze solide disperse in un fluido liquido o gassoso. |
| Decantazione e Centrifugazione. |
| La decantazione e la centrifugazione si utilizzano per separare le sostanze solide disperse in liquido in forma eterogenea quando le parti solide hanno una diversa densità rispetto al mezzo liquido. Le particelle solide si sedimentano sul fondo oppure affiorano in superficie separandosi dalla fase liquida dando luogo al fenomeno della decantazione. Per velocizzare il tempo di decantazione si provvede ad un processo di centrifugazione che provvede a fornire al sistema una forza apparente superiore alla forza di gravità che velocizza il fenomeno. |
| Estrazione con solvente |
| L’estrazione con solvente si utilizza per separare da una miscela a base acquosa un soluto , di solito poco solubile in acqua ma ben solubile in un liquido organico completamente immiscibile con l’acqua. Dopo aver unito tale solvente al miscuglio acquoso iniziale, e dopo avere sufficientemente agitato il tutto, si lascia a riposo. Il solvente si separerà dall’acqua formando due fasi e conterrà disciolto il soluto che prima era in acqua. |
| Cristallizzazione |
| Una sostanza solida solubilizzata in una soluzione acquosa, cristallizza quando la temperatura scende o quando il solvente evapora. Si utilizza questo fenomeno quando si vuole purificare una sostanza che presenta impurezze. Viene sciolto nel solvente e, quando avverrà la cristallizzazione, il solido cristallino così ottenuto non conterrà più le impurezze iniziali. |
1.2.1 Separazione chimica
In un composto è possibile intervenire chimicamente facendo avvenire opportune reazioni chimiche che ottengono gli elementi presenti nel composto in forma di sostante pure. Ad esempio con una reazione di elettrolisi possiamo ottenere idrogeno puro ed ossigeno puro dall’acqua secondo la reazione:
2H2O ➝ 2H2 +O2
| QUIZ 1.2 I metodi di separazione | |
| QUIZ 1 | QUIZ 2 |
© il testo è di esclusiva proprietà dell’autore ed è sottoposto a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito


