2.2 La mole
Quando vogliamo passare dalla singola particella, atomo o molecola che sia, ad una quantità discreta di materia, si utilizza la mole. Una mole rappresenta un certo numero di elementi. È un numero molto grande che chiamiamo numero di Avogadro NA e vale 6,023·1023. Tale numero è stato scelto in modo tale che una mole di nucleoni corrisponde ad 1 grammo di materia. Avremo così che una mole di atomi ci carbonio 12C corrisponde a 12 grammi. La mole è una delle unità di misura fondamentali del Sistema internazionale, il suo simbolo è “mol”.
Se consideriamo un composto come ad esempio il carbonato di calcio CaCO3 avremo che la sua massa molare MM (1) è composta da 100 u.m.a.:
| Massa atomica | |
| Ca | 40 u.m.a. |
| C | 12 u.m.a. |
| O | 16 u.m.a. x 3 atomi = 48 u.m.a. |
| Totale | 40+12+48=100 u.m.a. |
Se consideriamo una mole di molecole di CaCO3, dal momento che 1 u.m.a. corrisponde ad un grammo, avremo 100 grammi. Possiamo così affermare che la massa molare MM, detta anche peso molecolare PM, vale 100 g/mol.
MMCaCO3 = 100 u.m.a. = 100 g/mol
Quando nei quiz si parla di massa atomica MA espressa in u.m.a. in realtà si parla di massa atomica relativa, cioè si fa riferimento alla massa unitaria di 1 u.m.a. . Invece il peso atomico PA (o massa atomica) possiede lo stesso valore numerico della massa atomica relativa e si misura in g/mol. Ad esempio il carbonio 12 12C ha una massa atomica relativa di 12 u.m.a. ed una massa atomica (o peso atomico) di 12 g/mol.
Può capitare che in un quiz ci sia un uso non propriamente esatto dei termini MA — PA e MM — PM . L’importante è di considerarli, quando devono essere utilizzati per i calcoli, con l’unità di misura g/mol.
| Massa Atomica relativa MA | ← Riferito ad una molecola | (misurato in u.m.a. ) |
| Massa Atomica MA o Peso Atomico PA | ← Riferito ad una mole | (misurato in g/mol ) |
– – –
| Massa Molecolare MM | ← Riferito ad una molecola | (misurato in u.m.a. ) |
| Massa molare MM o Peso Molecolare PM | ← Riferito ad una mole | (misurato in g/mol ) |
Per quanto riguarda le relazioni tra le grandezze fisiche è bene conoscere la relazione fondamentale che definisce il peso molecolare:
| Grandezza | Unità di misura | |
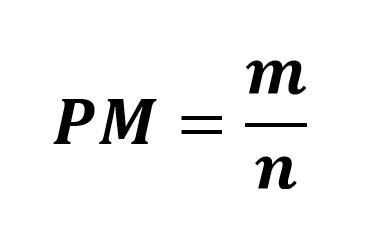 |
m = massa | g (grami) |
| n = numero di moli | mol (moli) | |
| PM = peso molecolare | g/mol |
E le relative formule inverse: m=PM ⋅ n e n=m/PM
QUIZ sulla mole |
|||
|---|---|---|---|
| QUIZ 2.2 La mole | |||
| QUIZ 1 | QUIZ 2 | QUIZ 3 | QUIZ 4 |
| QUIZ 5 | QUIZ 6 | QUIZ 7 | QUIZ 8 |
| QUIZ 9 | QUIZ 10 | QUIZ 11 | QUIZ 12 |
| QUIZ 13 | QUIZ 14 | QUIZ 15 | QUIZ 16 |
| QUIZ 17 | QUIZ 18 | QUIZ 19 | QUIZ 20 |
© il testo è di esclusiva proprietà dell’autore ed è sottoposto a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito
2.3 Percentuale in massa degli elementi presenti in una sostanza


