10.6.17 AMMINOACIDI
Gli amminoacidi sono molecole organiche che hanno sia il gruppo funzionale amminico −NH2, sia quello carbossilico −COOH. La parola amminoacido deriva dall’unione dei nomi di questi due gruppi funzionali.
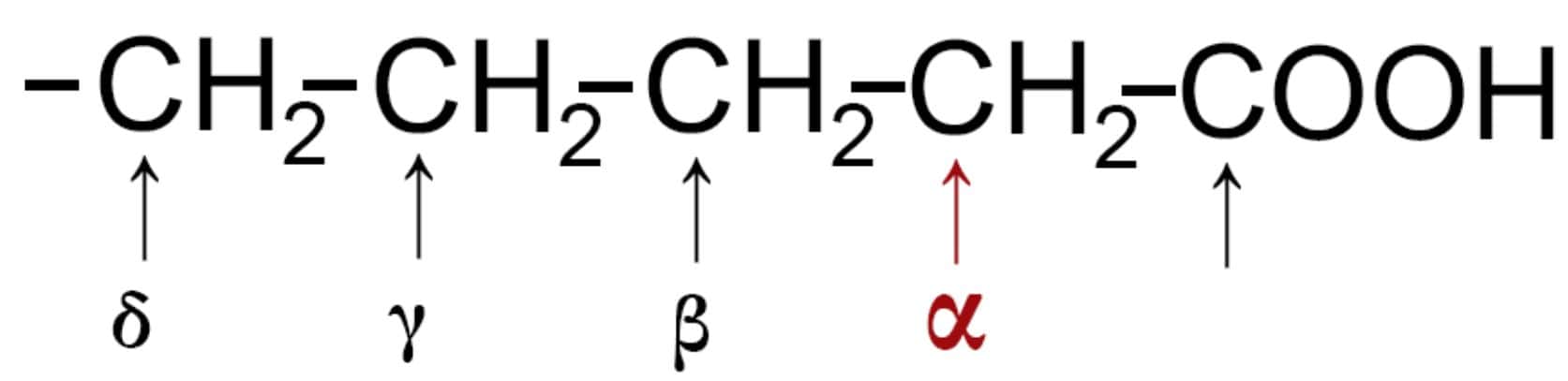
Secondo la numerazione degli atomi di carbonio che abbiamo per gli acidi carbossilici chiamiamo α (alfa) il primo carbonio che si incontra dopo il carbossile −COOH.
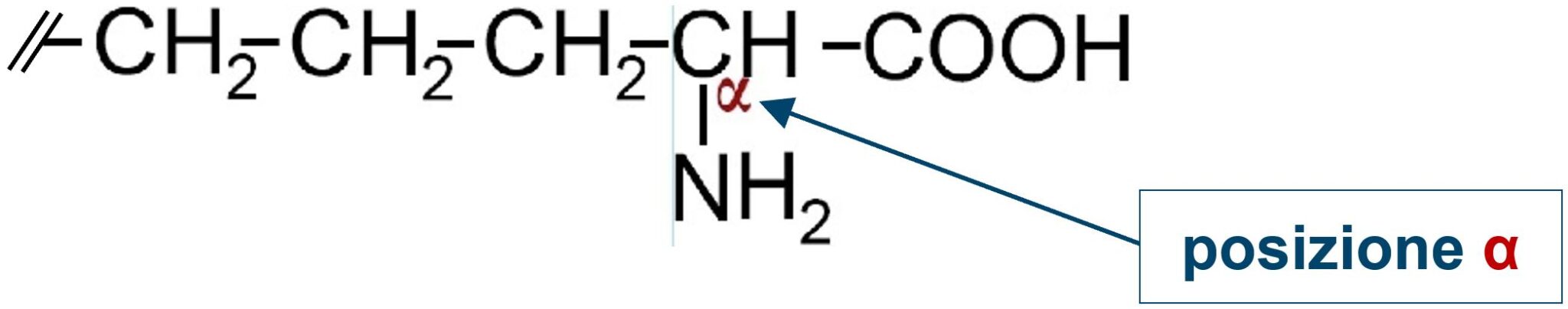
Su questo carbonio alfa leghiamo una ammina −NH2 ottenendo un α-AMMINOACIDO.
Il carbonio alfa risulta essere un chirale con due possibili enantiomeri (vedi).
Dei due enantiomeri nella biologia del nostro pianeta esistono solo quelli con proprietà levogira rispetto al piano di polarizzazione della luce che li attraversa. Possiamo così dire che ci interessano, a fini biologici gli L-α-amminoacidi.
Gli L-α-amminoacidi formano polimeri biologici: le proteine. Della grande famiglia degli amminoacidi quelli proteinogenici sono gli L-α-amminoacidi.
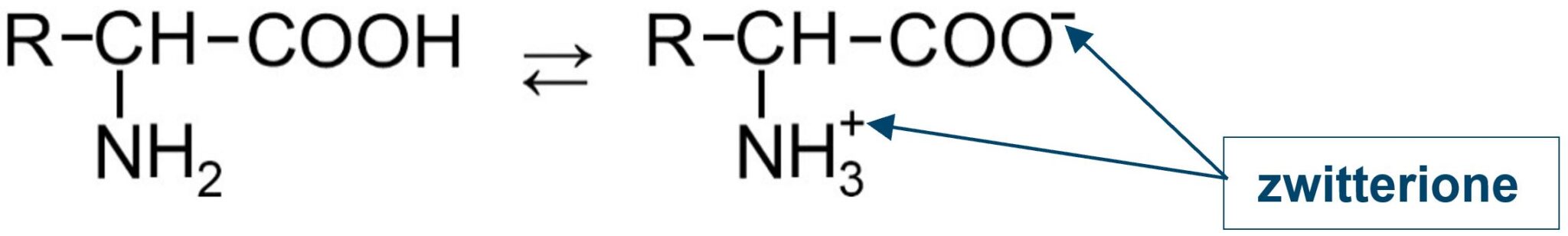
Un amminoacido possiede sia il gruppo carbossilico acido (capace di rilasciare un H+), sia quello amminico basico (capace di accettare un H+). Un amminoacido è così una sostanza anfotera (vedi).
A seconda del pH della soluzione acquosa nella quale si trova un amminoacido possiamo trovare una carica ionica dell’amminoacido negativa o positiva a seconda che prevalga rispettivamente il comportamento acido o basico. Esiste un valore ben preciso di pH che garantisce che la carica dell’amminoacido sia neutra; lo chiamiamo punto isoelettrico. Nel punto isoelettrico l’amminoacido si trova in forma di zwitterione.
Uno zwitterione è una molecola elettricamente neutra che presenta un numero uguale di cariche positive e negative.
LEGAME PEPTIDICO
Abbiamo appena detto che gli L-α-amminoacidi formano polimeri biologici, le proteine. Questo avviene perché il gruppo carbossilico di un primo amminoacido si lega con legame peptidico (condensazione con eliminazione di una molecola d’acqua) al gruppo amminico di un altro amminoacido formando un dipeptide. Il singolo amminoacido, quando è visto come elemento dei una proteina è a volte chiamato anche peptide. Nel dipeptide rimane ancora libero il gruppo amminico del primo peptide e il gruppo carbossilico del secondo. Questi due gruppi possono ancora formare legami peptidici con altri peptidi andando a formare polipeptidi (le proteine sono polipeptidi).
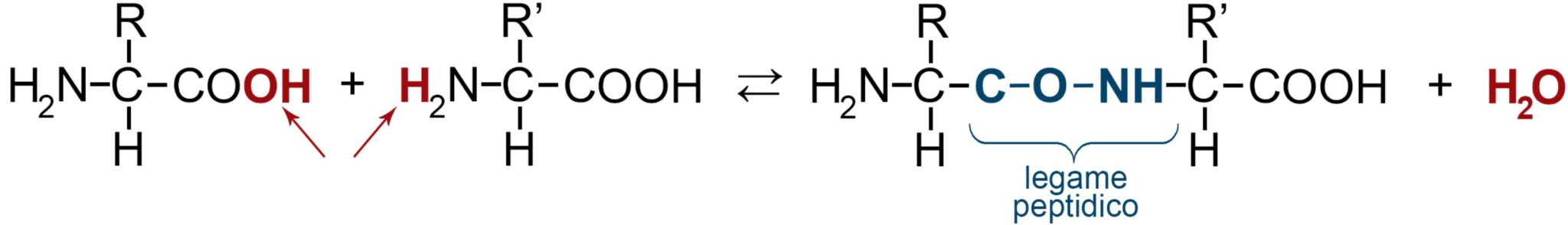
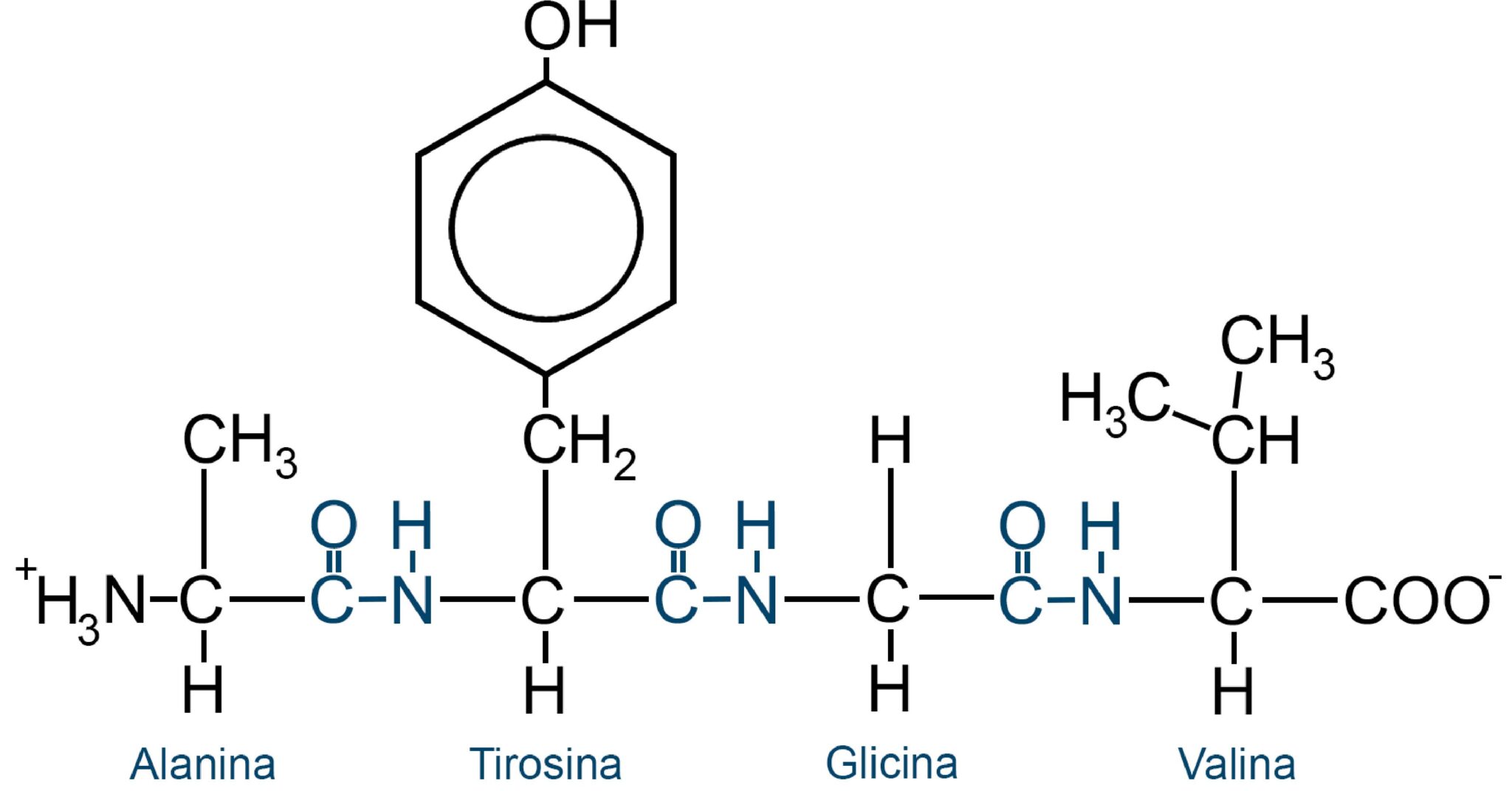 |
| Esempio di polipeptide con quattro peptidi legati da legame peptidico; in particolare vediamo la serie Alanina-Tirosina-Glicina-Valina. |
AMMINOACIDI PROTEINOGENICI
Gli amminoacidi presenti nella natura del nostro pianeta sono 20 (anche se alcune fonti bibliografiche ne contano 22 aggiungendo Selenocisteina e Pirrolisina) dei quali 8 sono detti essenziali che significa che non sono sintetizzati dall’uomo, ma devono essere assunti tramite l’alimentazione.
Nella sintesi delle proteine ogni amminoacido è un reagente limitante: quando uno di essi viene a mancare la sintesi di qualsiasi proteina viene interrotta anche se sono presenti quantità abbondanti di tutti gli altri aminoacidi.
Sulla base della natura della catena laterale sono raggruppati in 5 famiglie:
- Alifatici non polari
- Polari non carichi
- Aromatici
- Carichi positivamente (basici) – Presenza di un gruppo amminico, oltre a quello legato al carbonio α; questa ammina può accettare un H+ caricando positivamente l’amminoacido con un comportamento tipicamente basico.
- Carichi negativamente (acidi) – Presenza di un gruppo carbossilico, oltre a quello legato al carbonio α; questa ammina può cedere un H+ caricando negativamente l’amminoacido con un comportamento tipicamente acido.
| Amminoacidi NON POLARI | ||
| Glicina -Gly- |
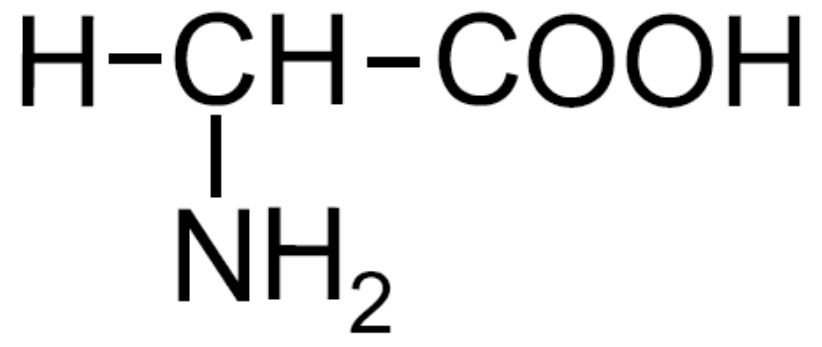 |
Non presenta chiralità in C2 |
| Alanina -Ala- |
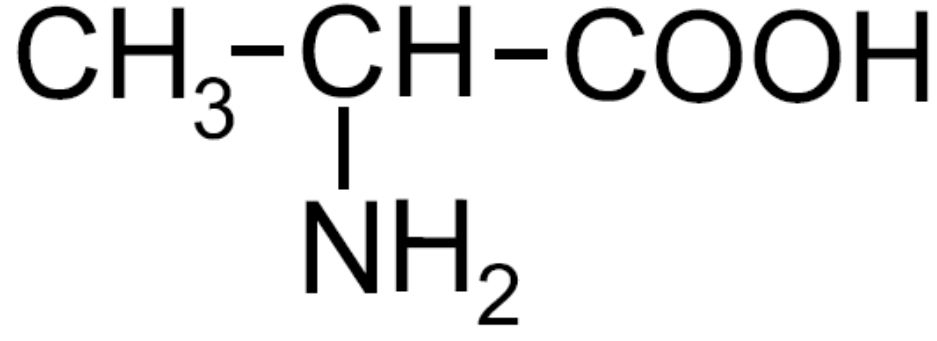 |
|
| Valina -Val- ESSENZIALE |
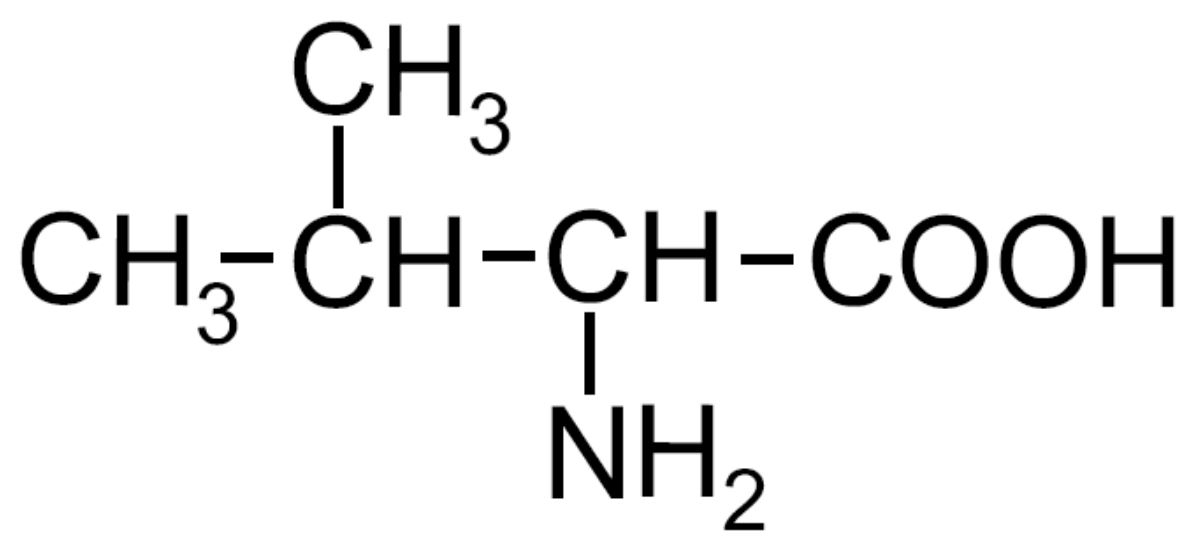 |
Amminoacido ramificato |
| Prolina -Pro- |
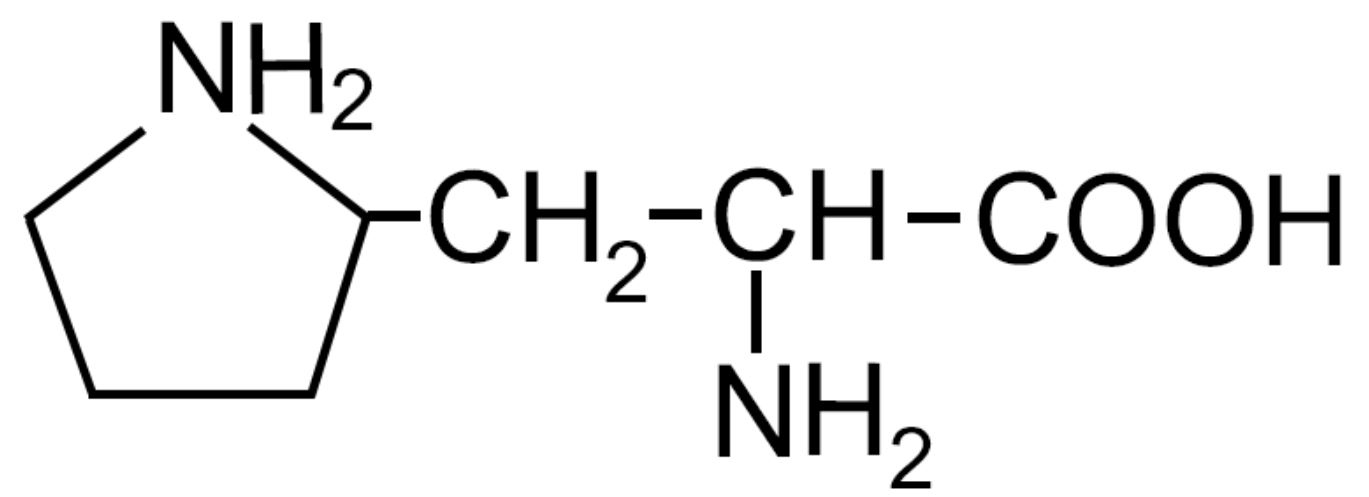 |
|
| Leucina -Leu- ESSENZIALE |
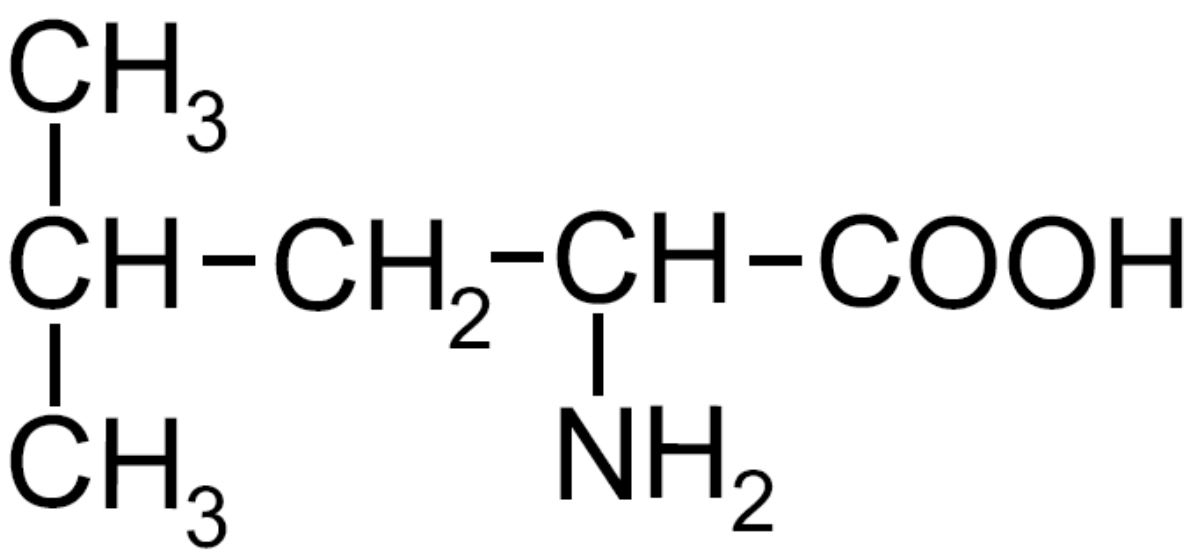 |
Amminoacido ramificato |
| Isoleucina -Ile- ESSENZIALE |
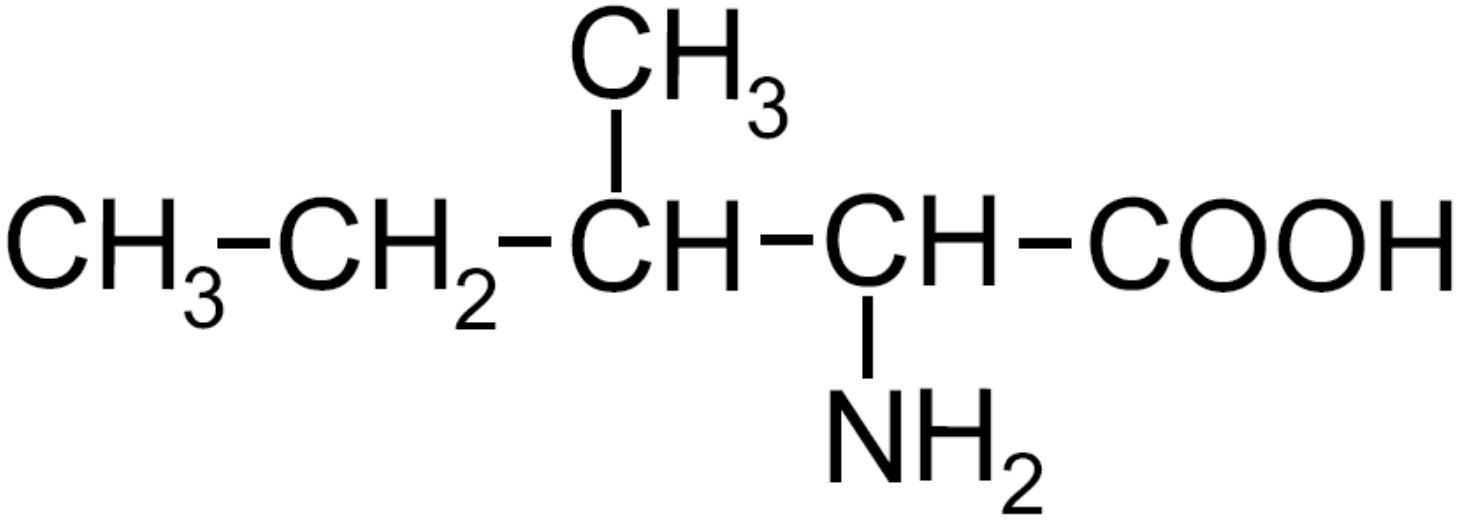 |
Amminoacido ramificato
Secondo carbonio chirale in C3 |
| Metionina -Met- ESSENZIALE |
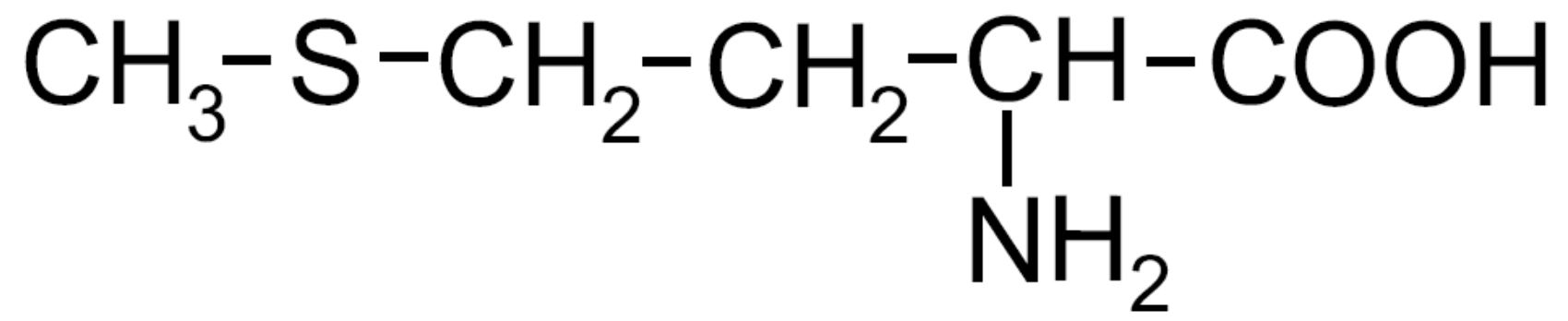 |
Amminoacido solforato |
| Amminoacidi POLARI NON CARICHI | ||
| Serina -Ser- |
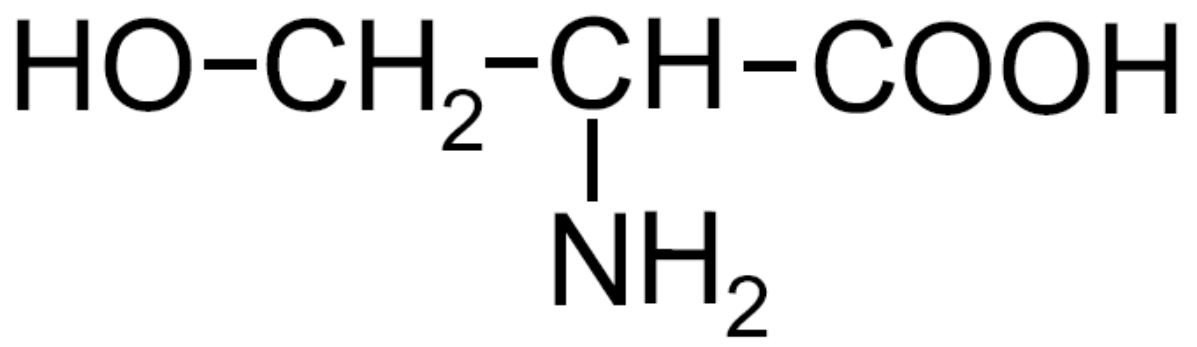 |
|
| Treonina -Thr- ESSENZIALE |
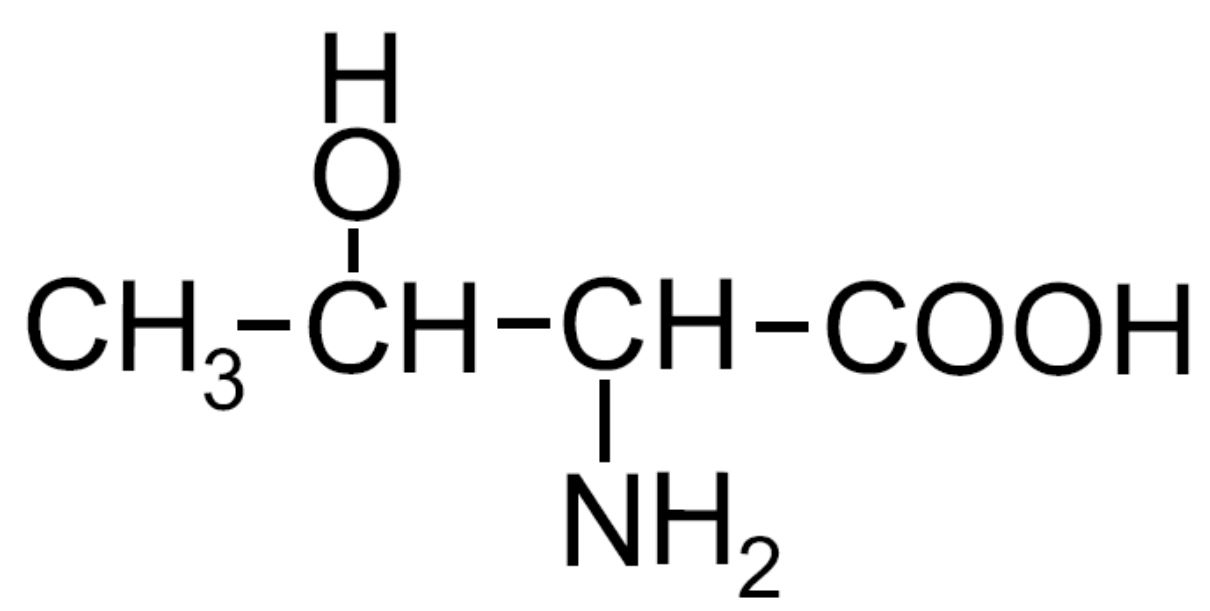 |
È presente un secondo carbonio chirale in C3 |
| Cisteina -Cys- |
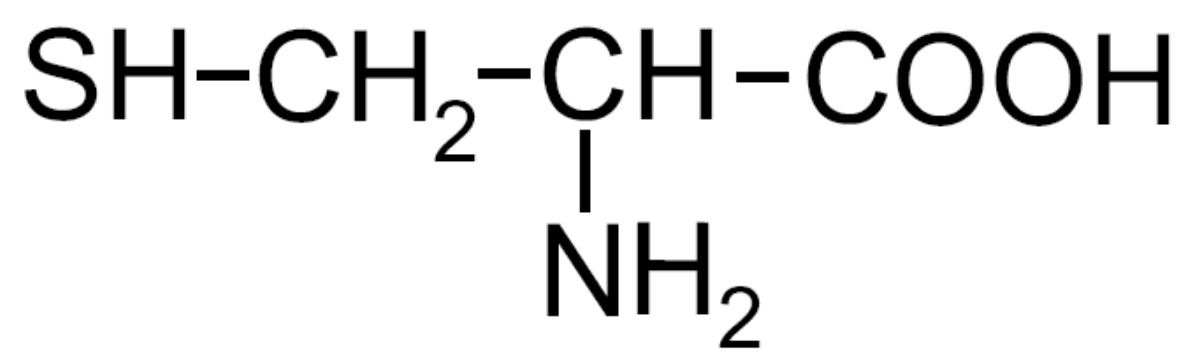 |
Amminoacido solforato |
| Asparagina -Asn- |
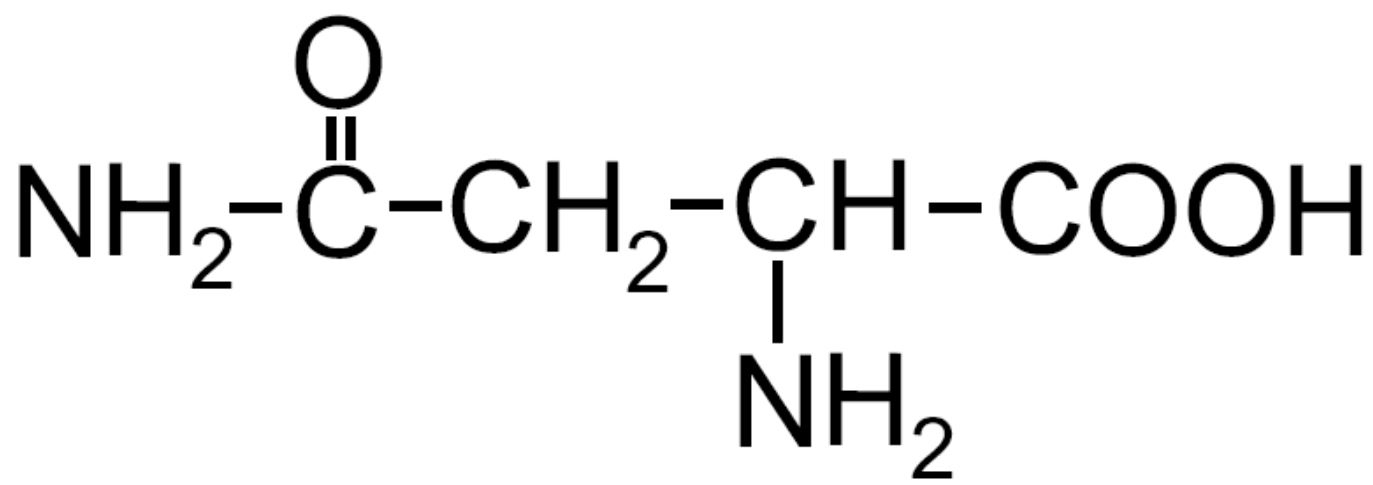 |
È presente una ammide nella catena |
| Glutammina -Gln- |
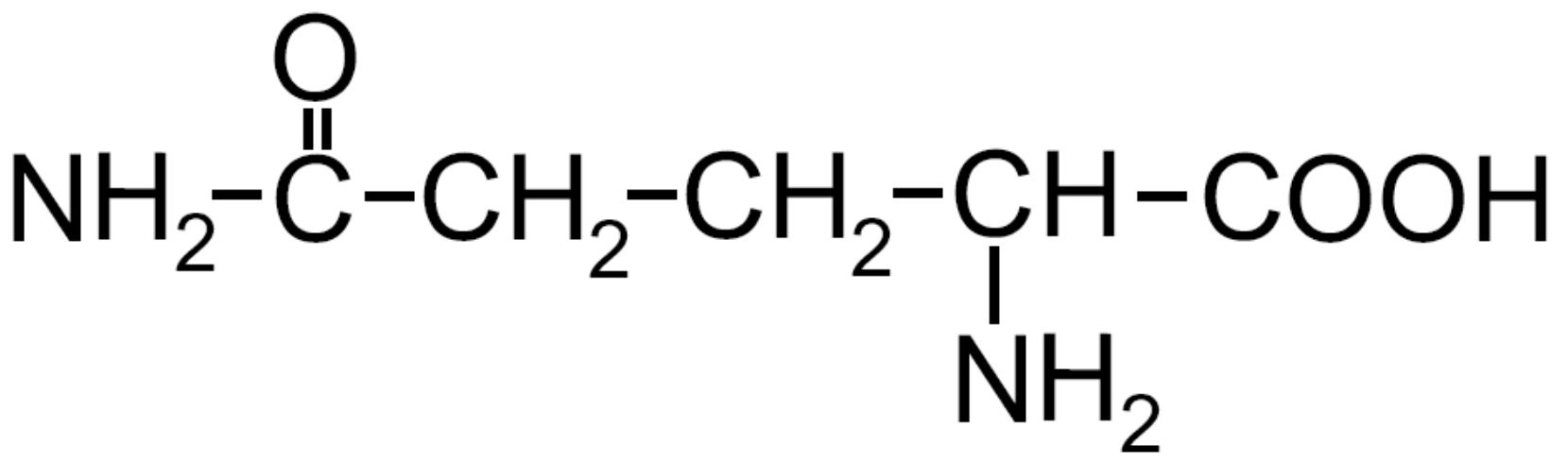 |
È presente una ammide nella catena |
| Fenilalanina -Phe- ESSENZIALE |
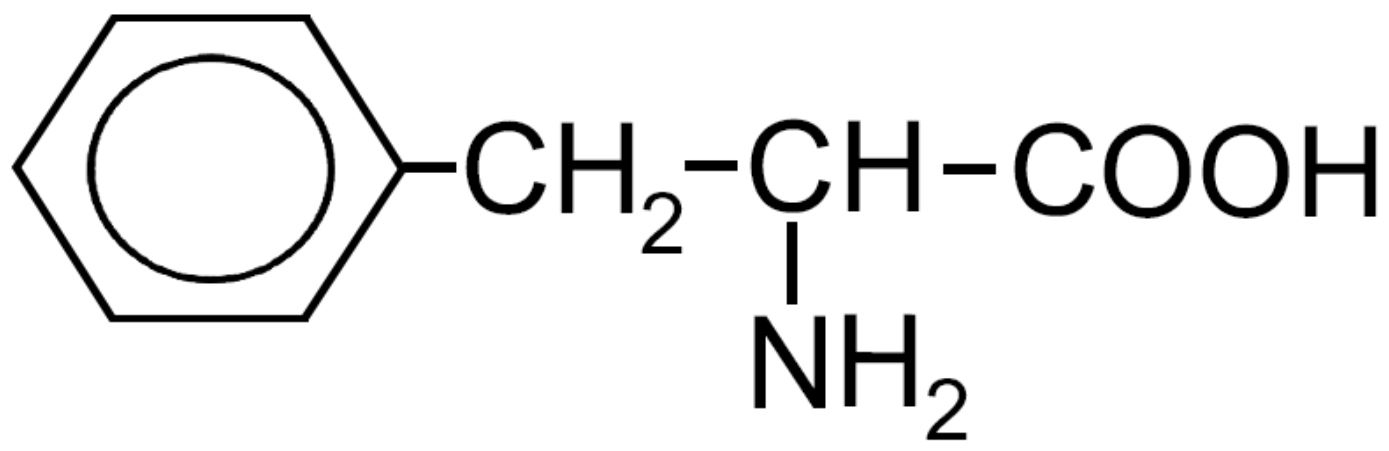 |
|
| Tirosina -Tyr- |
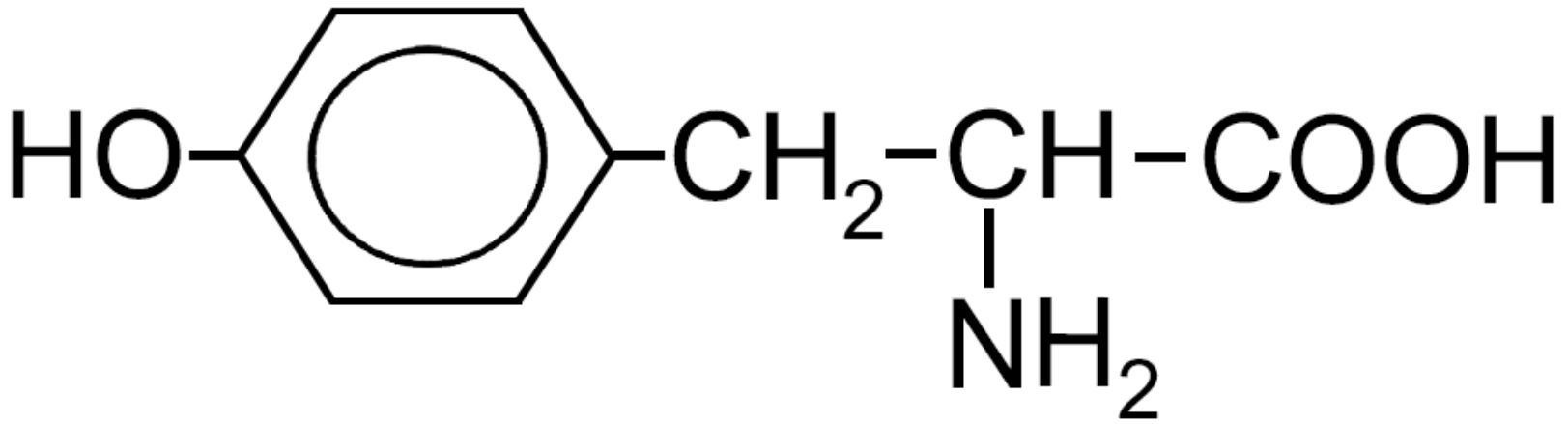 |
|
| Triptofano -Trp- ESSENZIALE |
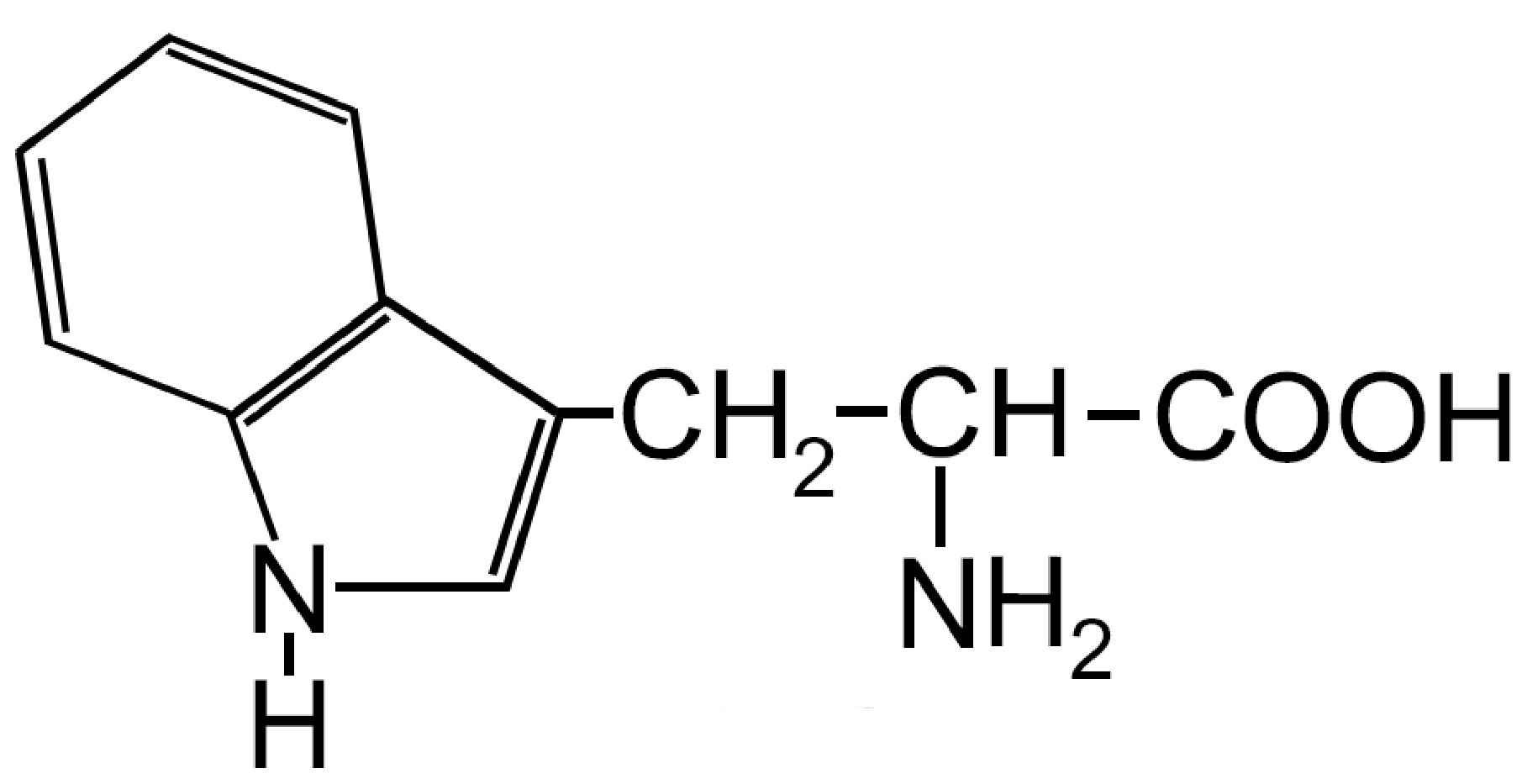 |
|
| Amminoacidi CARICHI POSITIVI | ||
| Lisina -Lys- ESSENZIALE |
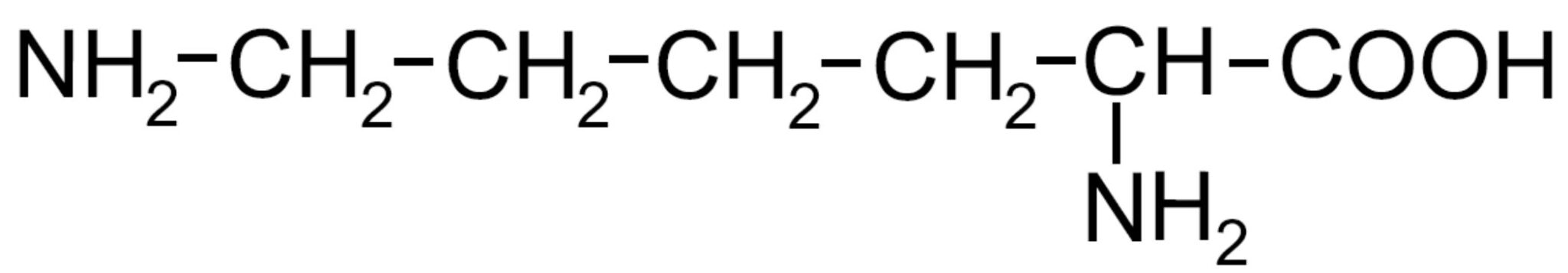 |
|
| Arginina -Arg- |
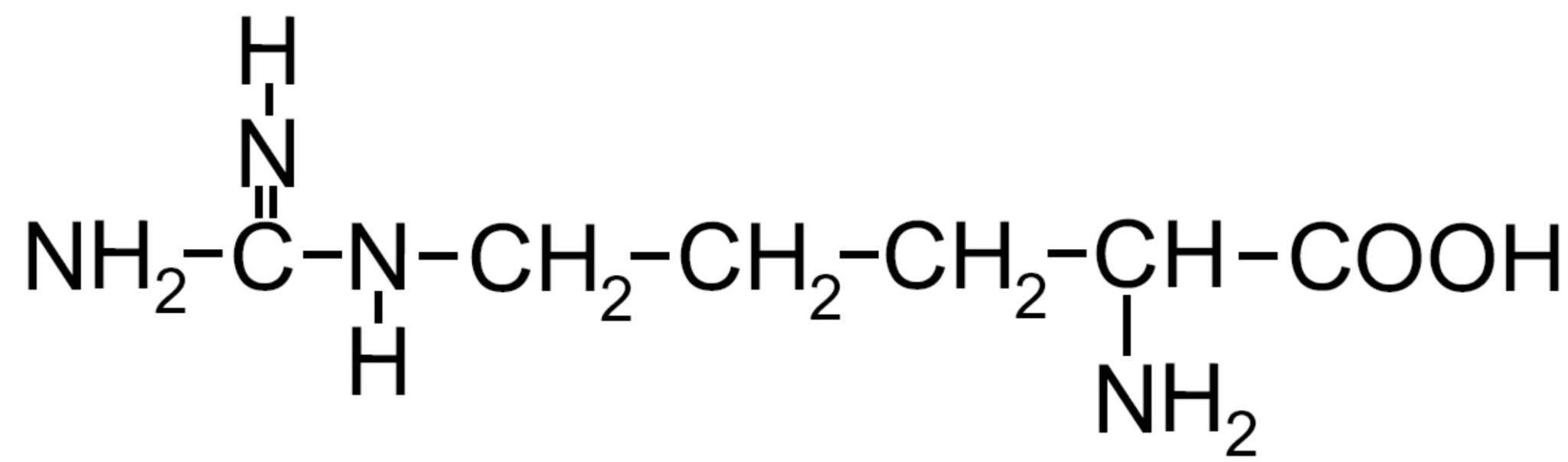 |
|
| Istidina< -His- ESSENZIALE durante l’accrescimento |
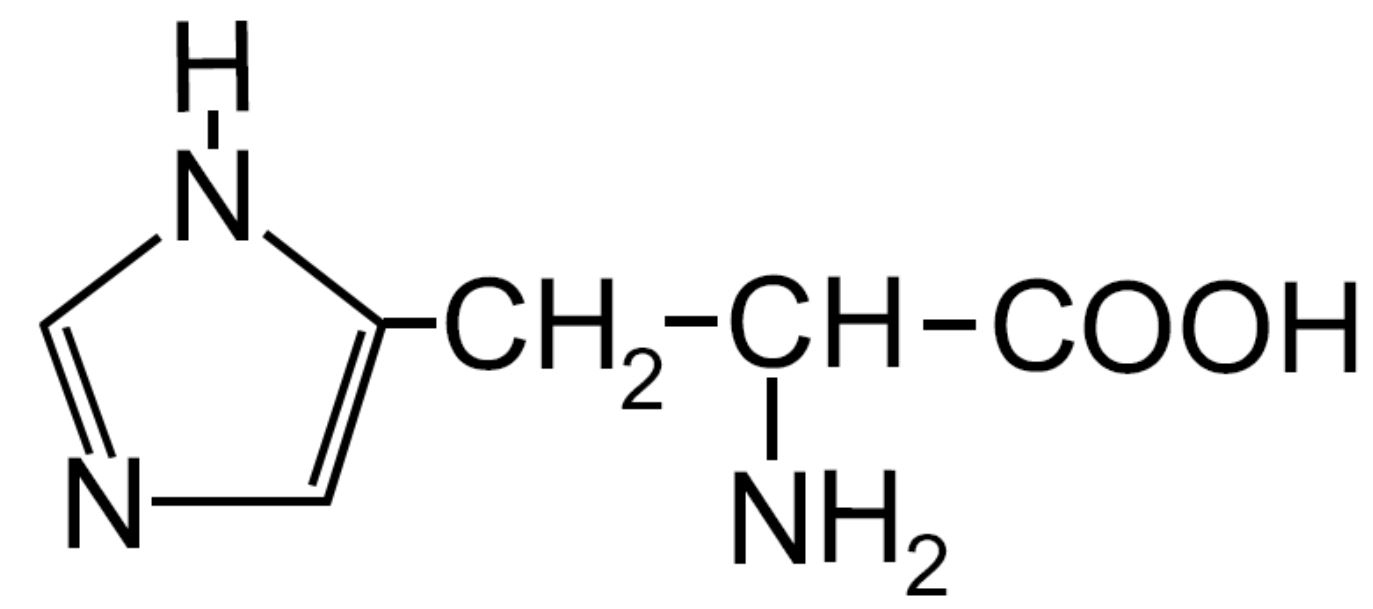 |
|
| Amminoacidi CARICHI NEGATIVI | ||
| Acido aspartico -Asp- |
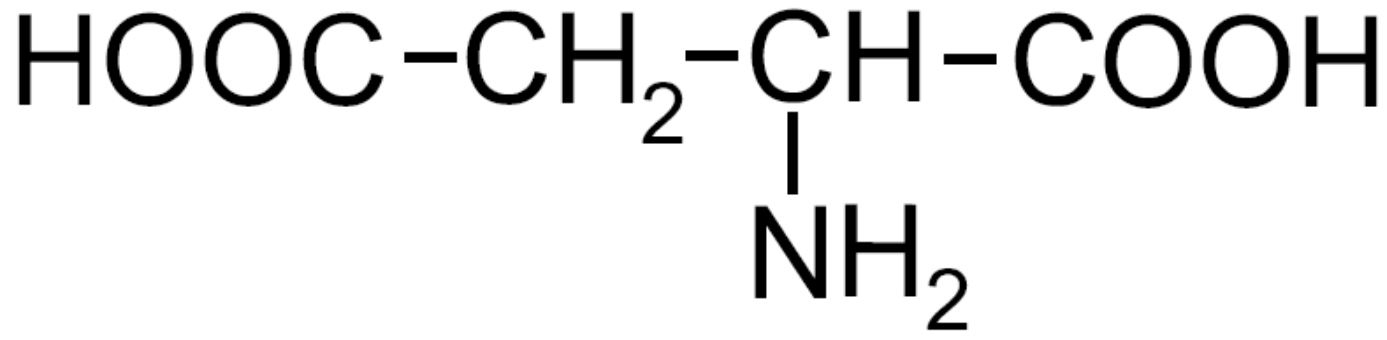 |
|
| Acido glutammico -Glu- |
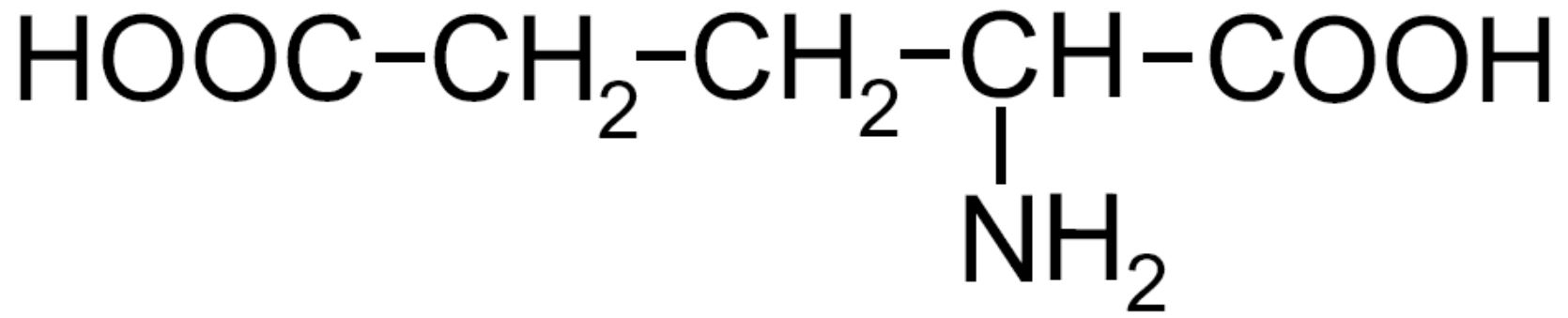 |
|
Oltre ad essere i monomeri che costituiscono le proteine, a livello biologico svolgono anche la funzione di neurotrasmettitori. Ad esempio l’acido glutammico è il principale neurotrasmettitore eccitatorio del sistema nervoso centrale mentre la glicina invece, è un neurotrasmettitore inibitorio del sistema nervoso.
AMMINOACIDI NON PROTEINOGENICI
Si tratta di tutti gli amminoacidi non coinvolti nella struttura delle proteine. Questi rappresentano un gruppo molto numeroso e se ne possono identificare migliaia.
PROTEINE
Come abbiamo detto, gli L-α-amminoacidi sono i costituenti fondamentali delle proteine. La struttura primaria di una proteina, ovvero la sua struttura lineare, è composta da una catena di amminoacidi uniti da legami covalenti.
Le proteine costituiscono:
- ormoni
- anticorpi
- enzimi
- tamponi
alcune
- hanno funzione strutturale,
- sono legate al movimento,
- svolgono funzioni di trasposto di ioni o molecole tra diversi organi,
- svolgono funzioni di controllo nella trasmissione dell’informazione genetica,
Il numero di amminoacidi che possono comporre una proteina è molto variabile:
La più piccola proteina è l’insulina composta da due catene di 21 e 30 amminoacidi. Il suo peso molecolare è di circa 5.900 g/mol.
Una delle proteine più grandi è costituita dall’ormone glutamina sintetasi, preposto alla sintesi dell’amminoacido glutamina. Esso è composto da 12 catene, identiche tra loro, ciascuna formata da 468 amminoacidi. Il suo peso molecolare è di circa 600.000 g/mol.
Alcune proteine sono dette coniugate e possiedono, oltre alle catene di amminoacidi, anche altri gruppi, che sono detti gruppi prostetici, come ad esempio l’emoglobina che contiene il gruppo eme. Alcuni gruppi prostetici sono composti da metalli.
STRUTTURA DELLE PROTEINE
La struttura di una proteina è classificata in quattro aspetti.
- STRUTTURA PRIMARIA: è data dalla sequenza degli amminoacidi e determina forma e funzionalità.
- STRUTTURA SECONDARIA: è data dalla configurazione tridimensionale della proteina. Può essere una forma elicoidale (alfa-elica) oppure una forma a foglietto ripiegato (beta-foglietto). Per tenere stabile questa forma sono presenti legami a “ponte idrogeno” tra atomi della stessa catena.
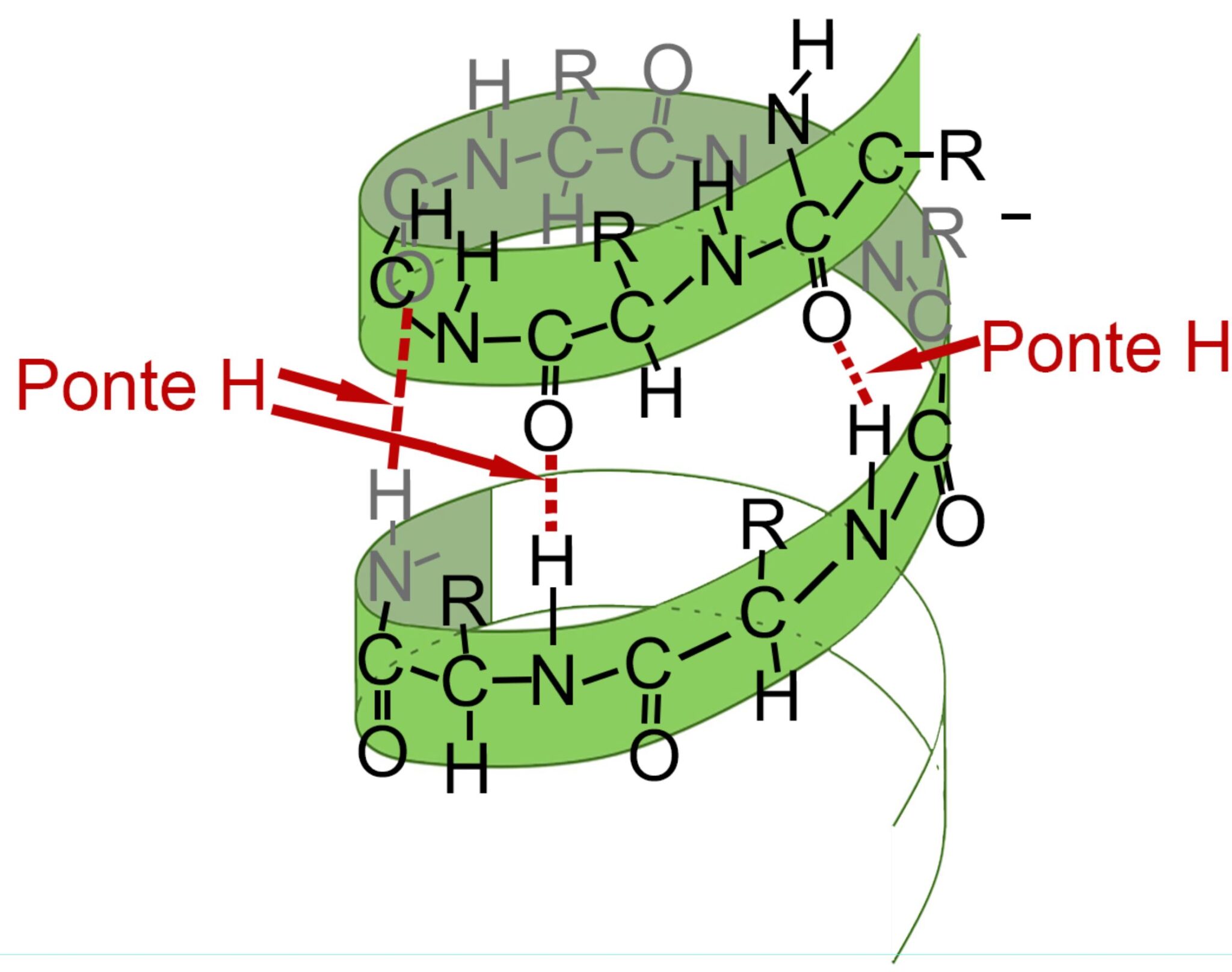
Struttura secondaria delle proteine
Alfa-elica
I ponti idrogeno tra l’ossigeno del gruppo C=O e l’idrogeno dell’ammina garantiscono il mantenimento della forma e la stabilizzazione della struttura
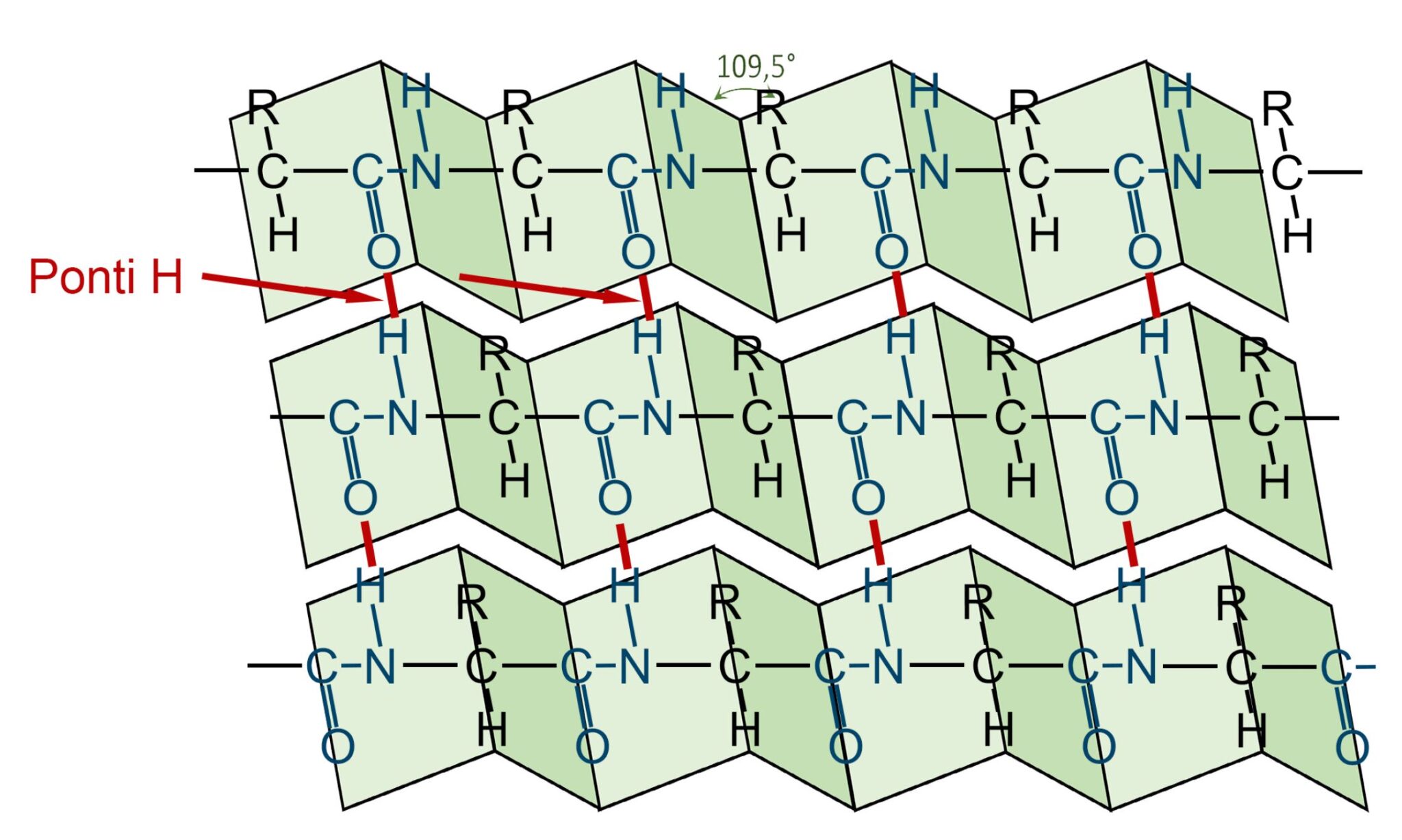
Struttura secondaria delle proteine
Beta-foglietto
I ponti idrogeno tra l’ossigeno del gruppo C=O e l’idrogeno dell’ammina garantiscono il mantenimento della forma e la stabilizzazione della struttura
- STRUTTURA TERZIARIA: la struttura secondaria si ripiega su se stessa con attrazioni elettrostatiche (ponti idrogeno, ponti disolfuro (Il ponti disolfuro sono legami che si formano tra due atomi di zolfo quando sono presenti in due amminoacidi della catene), interazioni idrofobiche tra amminoacidi non polari, legami ionici). La proteina va così ad assumere una forma propria.
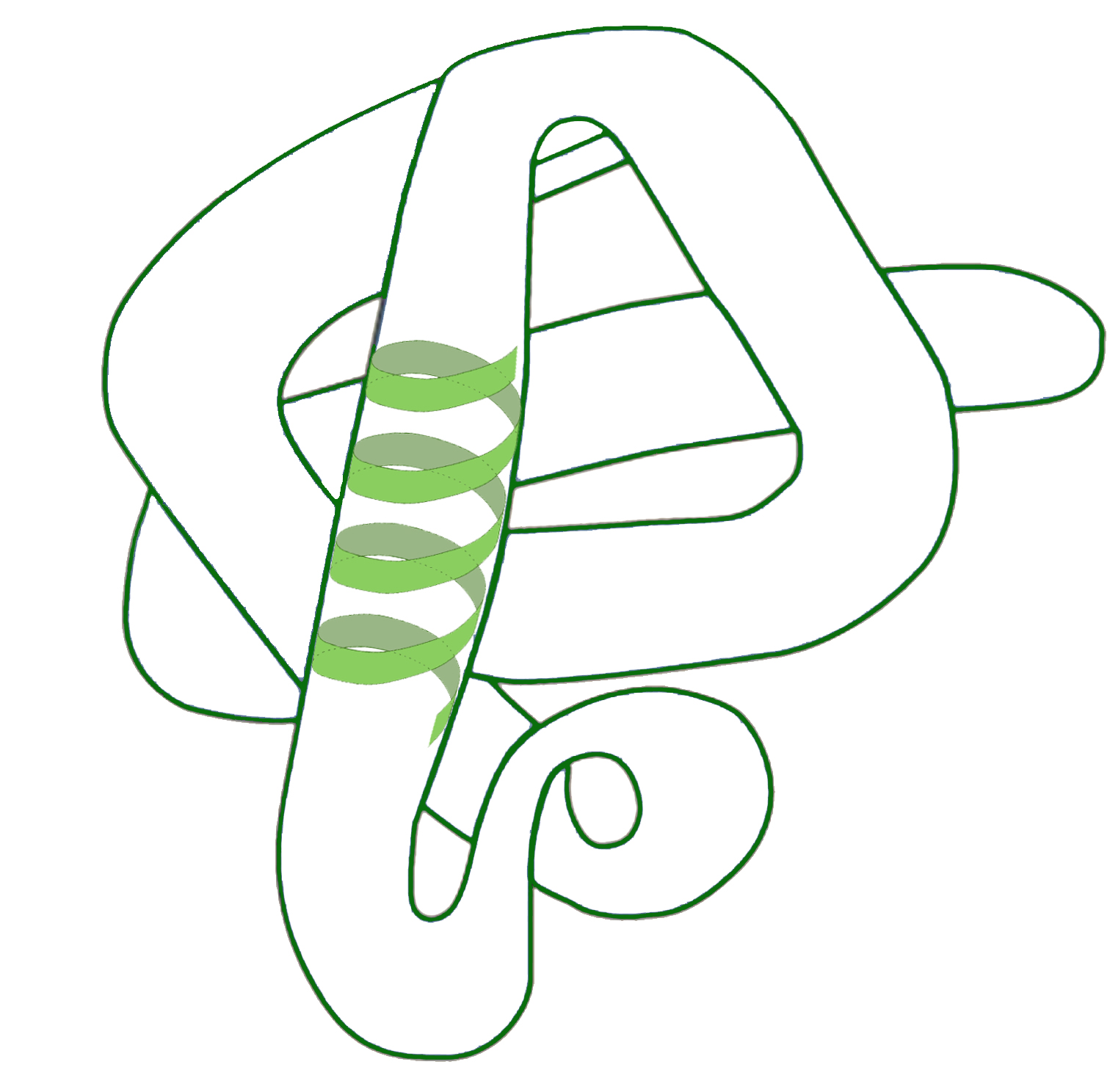 |
Struttura terziaria delle proteine Una proteina avente struttura secondaria ad alfa-elica si ripiega su se stessa |
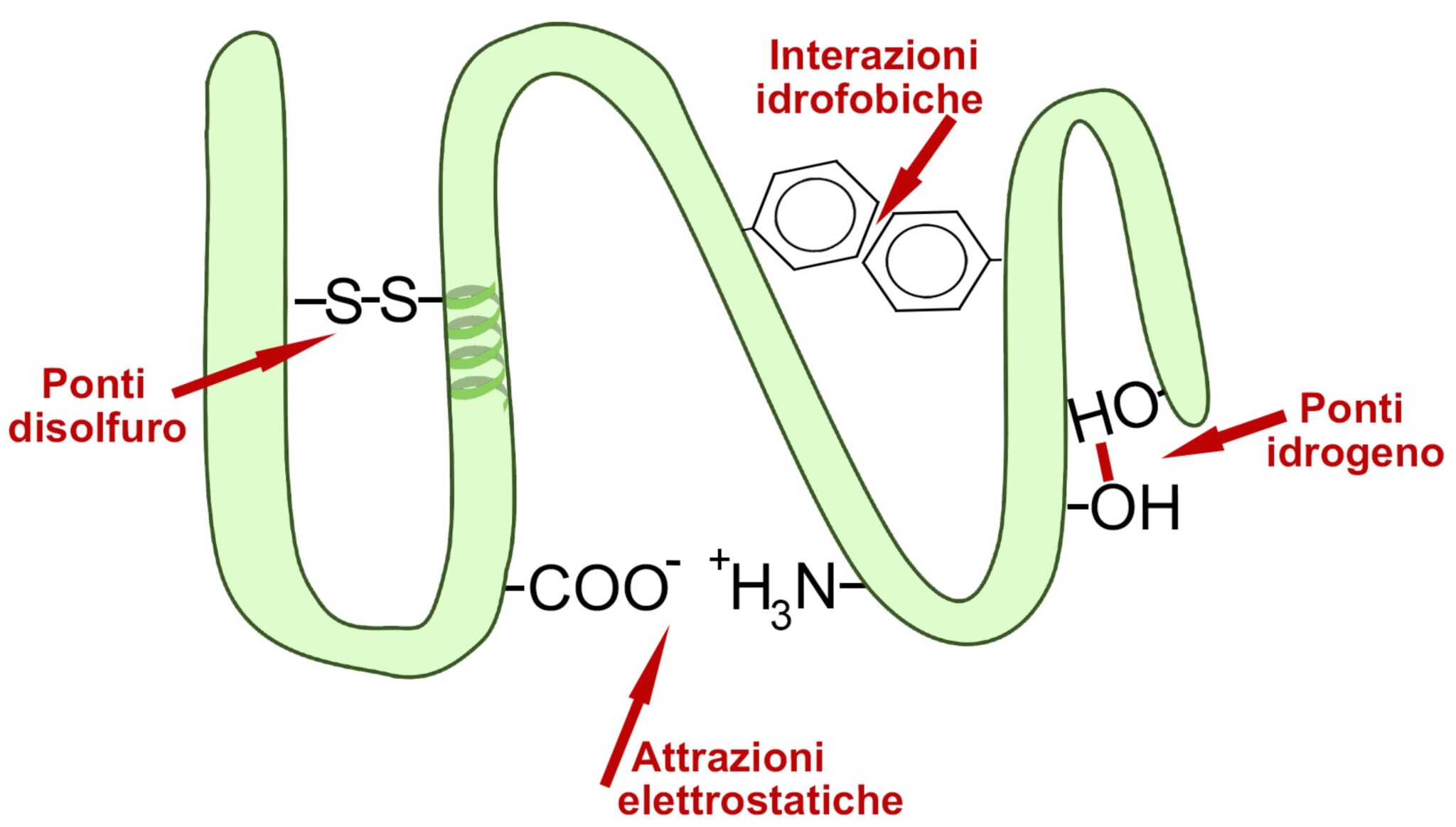
Struttura terziaria delle proteine
ponti idrogeno, ponti disolfuro, interazioni idrofobiche tra amminoacidi non polari, legami elettrostatici ionici
- STRUTTURA QUATERNARIA: è una struttura presente solamente nelle proteine complesse, quando sono presenti varie catene proteiche legate tra di loro da legami deboli (legami disolfuro, ponte idrogeno, elettrostatici).
Un classico esempio è l’emoglobina che è formata da quattro catene di polipeptidi collegate al gruppo “eme” che contiene un atomo di ferro Fe2+ (ferroso) preposto al trasporto dell’ossigeno.
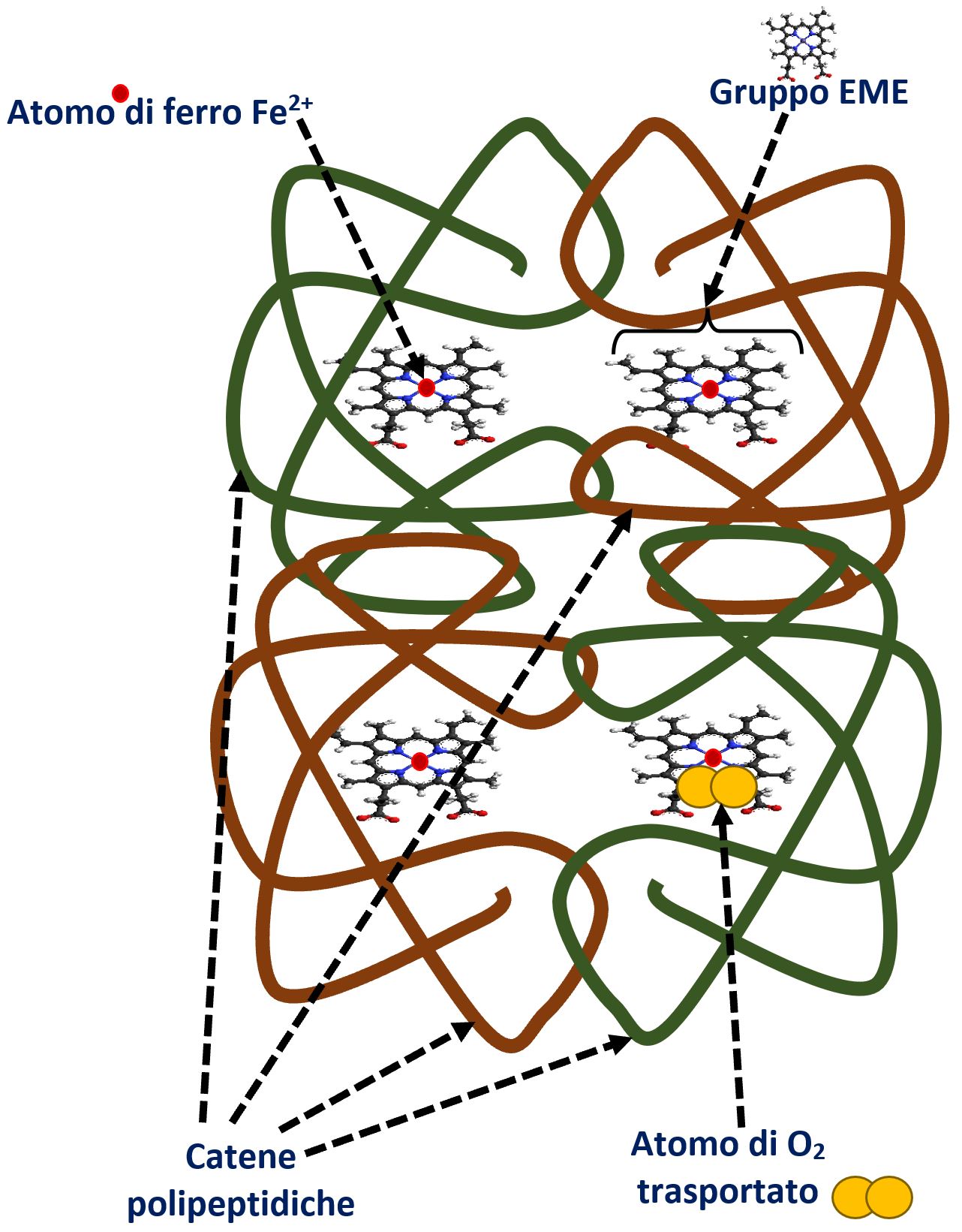
© il testo è di esclusiva proprietà dell’autore ed è sottoposto a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito
CONTINUA LO STUDIO DELLA CHIMICA ORGANICA
10.1 Idrocarburi
10.2 Idrocarburi alifatici
10.2.1 Idrocarburi alifatici saturi: gli ALCANI
10.2.2 Radicali alchilici
10.2.3 Idrocarburi ramificati
10.2.4 Proprietà fisiche e chimiche degli alcani
10.2.5 Idrocarburi insaturi: ALCHENI
10.2.6 Proprietà fisiche e chimiche degli alcheni
10.2.7 Idrocarburi insaturi: ALCHINI
10.2.8 Proprietà fisiche e chimiche degli alchini
10.2.9 POLIENI
10.2.10 CICLOALCANI, CICLOALCHENI E COCLOALCHINI
10.2.11 Composti ETEROCICLICI SATURI
10.3 Gli isomeri
10.3.1 Isomeri COSTITUZIONALI DI CATENA
10.3.2 Isomeri COSTITUZIONALI DI POSIZIONE
10.3.3 Isomeri COSTITUZIONALI DI FUNZIONE
10.3.4 Stereoisomeri CONFORMAZIONALI
10.3.5 Stereoisomeri CONFIGURAZIONALI GEOMETRICI
10.3.6 Stereoisomeri CONFIGURAZIONALI OTTICI
10.4 IDROCARBURI AROMATICI
10.4.1 BENZENE
10.4.2 I PRINCIPALI COMPOSTI AROMATICI DERIVANTI DAL BENZENE ‒ ARENI
10.4.3 IDROCARBURI POLICICLICI AROMATICI
10.4.4 COMPOSTI ETEROCICLICI INSATURI
10.5 ADDIZIONE E SOSTITUZIONE ELETTROFILA
10.5.1 ADDIZIONE ELETTROFILA
10.5.2 SOSTITUZIONE ELETTROFILA
10.6 GRUPPI FUNZIONALI
10.6.1 ALOGENURI ALCHILICI E ARILICI
10.6.3 ALCOLI
10.6.4 Proprietà fisiche e chimiche e preparazione degli ALCOL
10.6.5 POLIALCOLI (POLIOLI)
10.6.6 ETERI
10.6.7 CARBONILE – ALDEIDI E CHETONI
10.6.8 CARBOSSILE – ACIDI ORGANICI
10.6.9 ANIDRIDI
10.6.10 ESTERI
10.6.11 LIVELLI DI OSSIDAZIONE DELLE MOLECOLE ORGANICHE
10.6.12 SAPONIFICAZIONE
10.6.13 FOSFOLIPIDI
10.6.14 LIPIDI O GRASSI
10.6.15 AMMINE
10.6.16 AMMIDI
10.6.17 AMMINOACIDI – PROTEINE
10.7 POLIMERI
10.8 CARBOIDRATI


