10.6.8 CARBOSSILE – ACIDI ORGANICI
| Lungo la catena di atomi di carbonio di un composto organico è possibile incontrare in cima alla catena un carbossile, cioè un atomo di carbonio legato ad un atomo di ossigeno con doppio legame e ad un gruppo −OH. Il carbossile possiede proprietà acide perché in soluzione acquosa presenta il fenomeno dell’idrolisi acida lasciando in soluzione un H+ che si distacca dal gruppo −COO−. Si tratta sempre di acidi deboli. |
|
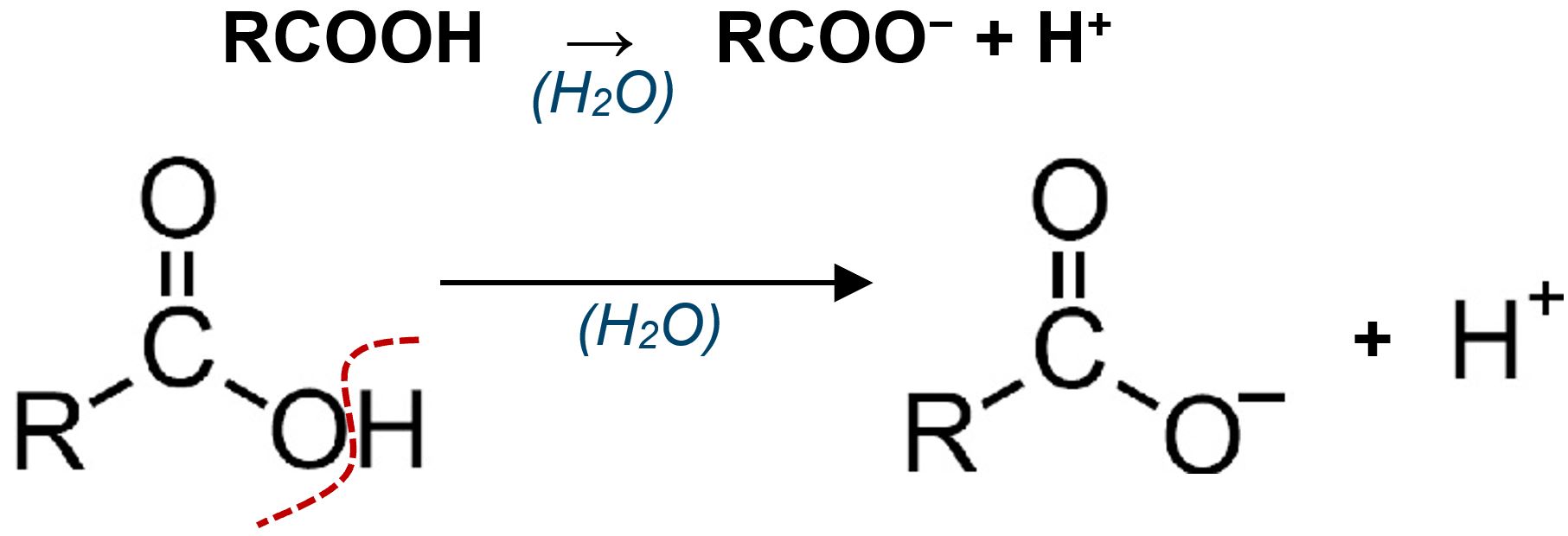 |
Comportamento acido del carbossile |
I composti che contengono un carbossile (o più di uno) hanno una natura acida e sono chiamati acidi carbossilici. Quando la catena alifatica (di atomi di carbonio) è sufficientemente lunga rientrano nella grande famiglia dei “grassi” e sono noti come acidi grassi (acidi monocarbossilici alifatici). La catena può avere insaturazioni, cioè doppi legami. Sono classificati, in base alle insaturazioni, come:
- saturi, se privi di doppi legami (prevalentemente presenti negli animali)
- monoinsaturi, se presentano un solo doppio legame (prevalentemente presenti nei vegetali)
- polinsaturi, se presentano due o più doppi legami (prevalentemente presenti nei vegetali)
Così come abbiamo già visto per le aldeidi abbiamo due diverse nomenclature.
La nomenclatura tradizionale usa il termine “acido” seguita da un termine legato al numero di atomi di carbonio secondo la sequenza formico, acetico, propionico, butirrico, valerianico, capronico.
La nomenclatura IUPAC usa il termine “acido” seguito da un termine con suffisso “–oico” preceduto dal termine che indica il numero totale di atomi di carbonio secondo la sequenza metan-, etan-, propan-, butan-, pentan-, esan-.
| Formula | Nome IUPAC | Nome tradizionale |
| H−COOH | acido metanoico | acido formico |
| CH3−COOH | acido etanoico | acido acetico |
| CH3−CH2−COOH | acido propanoico | acido propionico |
| CH3−CH2−CH2−COOH | acido butanoico | acido butirrico |
| CH3−CH2−CH2−CH2−COOH | acido pentanoico | acido valerianico |
| CH3−CH2−CH2−CH2−CH2−COOH | acido esanoico | acido valerianico |
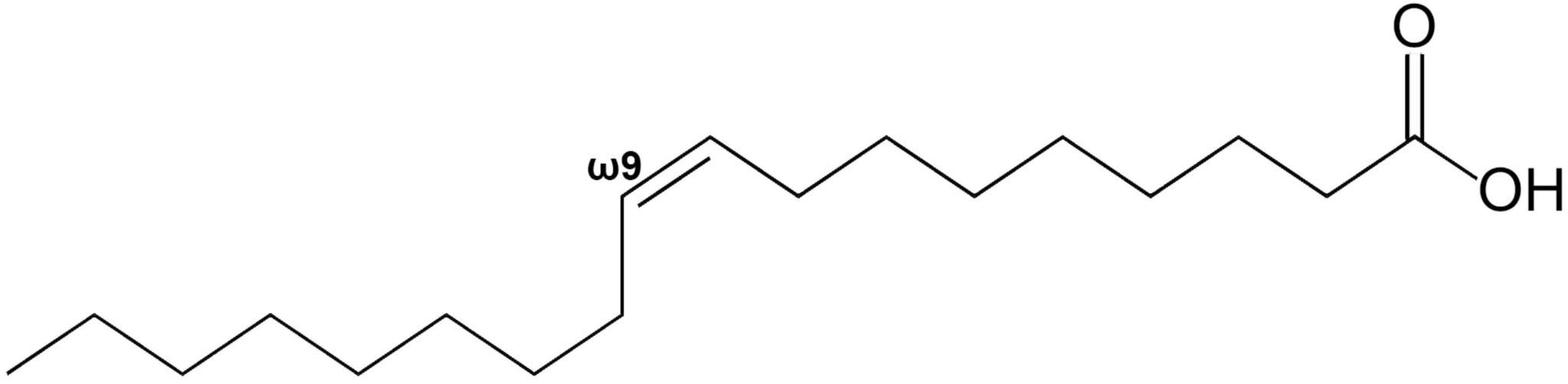 |
acido cis-9-ottadecanoico | acido oleico |
Quando la catena alifatica connessa al carbossile è lunga, la nomenclatura può divenire complessa ed esistono diversi sistemi di notazione.
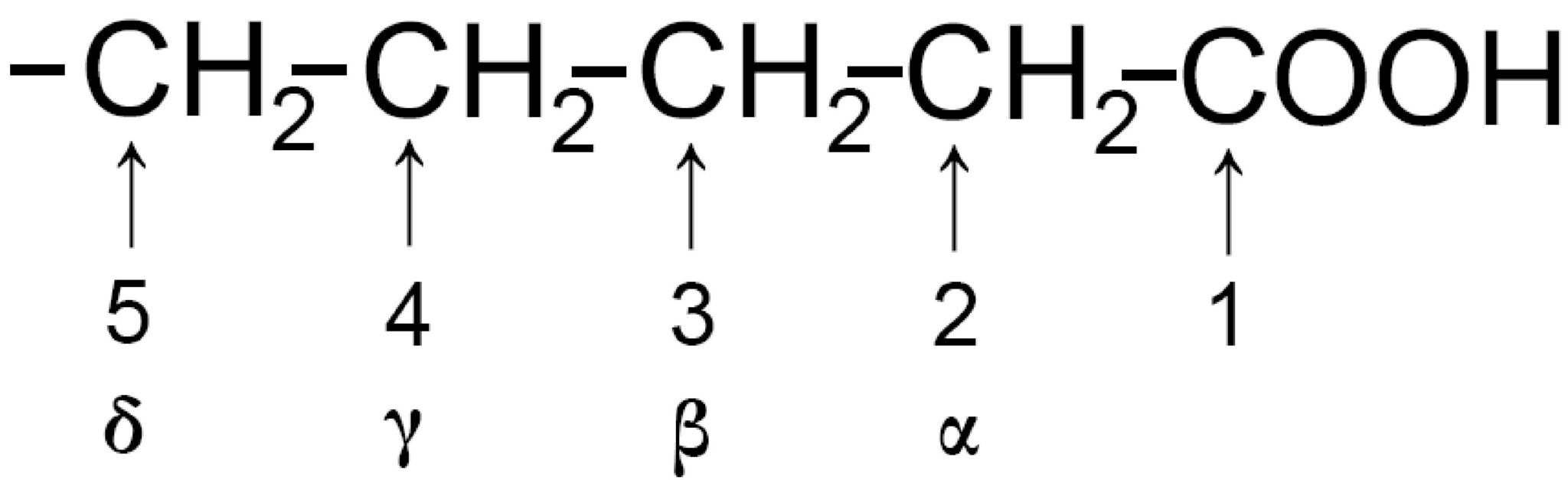
Gli atomi di carbonio possono essere numerati a partire dal carbonio 1 che corrisponde al carbossile. Possono anche essere numerati con l’alfabeto greco chiamando alfa “α” il carbonio 2 e continuando con le lettere greche.
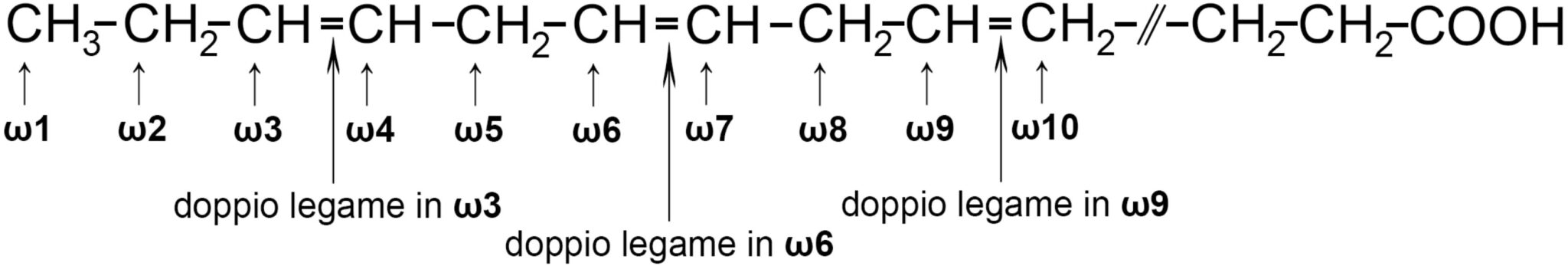
Un sistema di notazione è detta omega “ω”; inizia a contare gli atomi della catena a partire dall’ultimo, dalla parte opposta del carbossile. Si indica con un numero la presenza dei doppi legami a partire dall’ultimo atomo di carbonio. Avremo così ad esempio che ω3 corrisponde ad un doppio legame tra il terzultimo e il quartultimo atomo della catena. Sono noti in biologia, per gli elevati benefici nutrizionali, gli acidi grassi ω3, ω6 e ω9 detti genericamente ω3.
Uno degli effetti positivi sulla salute degli ω3 è la composizione della membrana cellulare composta da fosfolipidi che a loro volta sono esteri di acidi grassi. La giusta presenza di ω3 nella composizione della membrana migliora i fenomeni di trasporto attraverso la membrana stessa.
Effetto dei doppi legami sulla mobilità della catena carboniosa:
Abbiamo visto che i legami semplici tra due atomi di carbonio ibridati sp3 presenti nelle catene degli alcani hanno una elevata mobilità che permette una buona capacità di movimento alla catena. Invece i doppi legami tra due atomi di carbonio ibridati sp2 bloccano la capacità di rotazione attorno al legame e irrigidiscono la struttura molecolare. Gli acidi grassi saturi (senza doppi legami) avranno perciò molecole capaci di “arrotolarsi” e “intrecciarsi” tra loro; gli acidi grassi insaturi invece, con le strutture irrigidite si intrecceranno meno tra molecola e molecola e possiedono la capacità di scivolare meglio. L’effetto finale è che gli acidi grassi saturi (a causa degli intrecci) assumono uno stato solido (grasso animale) e quelli insaturi possiedono uno stato liquido (oli vegetali).
Acidi bicarbossilici
Alcuni acidi organici possono contenere anche più di un gruppo carbossilico. Avranno di conseguenza una acidità maggiore degli omologhi acidi monocarbossilici. Al fine della preparazione per il test di ammissione all’università, non è necessario approfondire questo argomento. Due acidi bicarbossilici ( o acidi dioici) che sono stati richiesti in passato nei quiz: l’acido ossalico e l’acido succinico.
| Formula | Nome IUPAC | Nome tradizionale |
| HOOC−COOH | acido etandidioico | acido ossalico |
| HOOC−CH2−COOH | acido propandioico | acido malonico |
| HOOC−CH2−CH2−COOH | acido butandioico | acido succinico |
L’acido ossalico, a volte richiesto nei quiz dei test di ammissione all’università, è formato da due gruppi carbossilici legati tra di loro; la sua formula bruta è H2C2O4, la formula di struttura è HOOC−COOH e a volte è scritto anche (COOH)2. È il più forte acido carbossilico presente in natura. È noto il suo sale ossalato di calcio CaC2O4.
PROPRIETÀ FISICHE DEGLI ACIDI CARBOSSILICI
Gli acidi carbossilici sono composti polari e formano legami idrogeno con se stessi e con altre molecole. Come conseguenza di queste robuste interazioni molecolari hanno punti di ebollizione più alti degli equivalenti idrocarburi e anche degli equivalenti alcol.
ACIDI GRASSI
I primi elementi della serie sono liquidi incolori e hanno un odore pungente (si pensi all’acido acetico che conferisce il tipico odore all’aceto di vino). Gli acidi carbossilici con pesi molecolari più elevati si presentano allo stato liquido e solido e sono chiamati ACIDI GRASSI.
A seconda della lunghezza della catena e dal numero di doppi legami presenti dipende lo stato di aggregazione liquido o solido.
In modo generale possiamo classificarli come:
- grassi (propriamente detti), quando si presentano allo stato solido e sono generalmente saturi (di origine prevalentemente animale);
- oli, quando sono liquidi e spesso insaturi, per la presenza di uno o più doppi legami C=C (di origine prevalentemente animale).
Produzione degli acidi carbossilici
Gli acidi carbossilici possono essere prodotti a partire dalle aldeidi per ossidazione.
Ad esempio l’aldeide acetica può portare all’acido acetico:
CH3−CH2O + ½ O2 → CH3−COOH
Anche partendo da un alcol primario possiamo giungere direttamente, per ossidazione, all’acido carbossilico. Ad esempio dall’alcol etilico si giunge per ossidazione all’acido acetico:
CH3−CH2OH + O2 → CH3−COOH + H2O
Questa è la reazione che avviene nel vino quando si trasforma in aceto.
REAZIONI DEGLI ACIDI CARBOSSILICI
Gli acidi carbossilici, per riduzione possono portare alle aldeidi e agli alcol primari; si tratta delle reazioni inverse di quelle di produzione viste qui sopra.
Gli acidi carbossilici possono portare, reagendo tra di loro, anche alla produzione di anidridi (organiche) che vedremo nei prossimi paragrafi.
Reagendo con gli alcol possono produrre esteri, composti che vedremo nei prossimi paragrafi.
10.6.9 ANIDRIDI
| Al fine di affrontare i quiz dei test di ammissione all’università è sufficiente saper riconoscere questa categoria di composti organici.
Esse derivano dalla condensazione tra due acidi carbossilici (con eliminazione di una molecola d’acqua) |
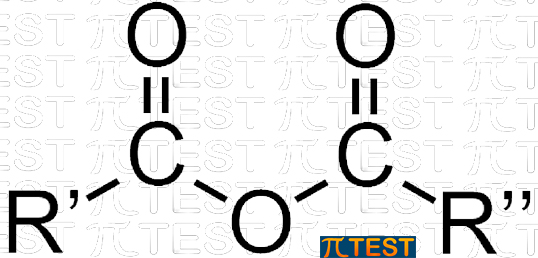 ANIDRIDI ANIDRIDI |
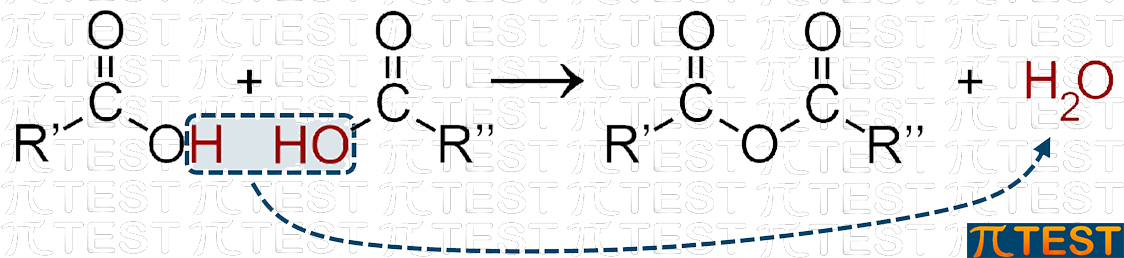 |
|
© il testo è di esclusiva proprietà dell’autore ed è sottoposto a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito
CONTINUA LO STUDIO DELLA CHIMICA ORGANICA
10.1 Idrocarburi
10.2 Idrocarburi alifatici
10.2.1 Idrocarburi alifatici saturi: gli ALCANI
10.2.2 Radicali alchilici
10.2.3 Idrocarburi ramificati
10.2.4 Proprietà fisiche e chimiche degli alcani
10.2.5 Idrocarburi insaturi: ALCHENI
10.2.6 Proprietà fisiche e chimiche degli alcheni
10.2.7 Idrocarburi insaturi: ALCHINI
10.2.8 Proprietà fisiche e chimiche degli alchini
10.2.9 POLIENI
10.2.10 CICLOALCANI, CICLOALCHENI E COCLOALCHINI
10.2.11 Composti ETEROCICLICI SATURI
10.3 Gli isomeri
10.3.1 Isomeri COSTITUZIONALI DI CATENA
10.3.2 Isomeri COSTITUZIONALI DI POSIZIONE
10.3.3 Isomeri COSTITUZIONALI DI FUNZIONE
10.3.4 Stereoisomeri CONFORMAZIONALI
10.3.5 Stereoisomeri CONFIGURAZIONALI GEOMETRICI
10.3.6 Stereoisomeri CONFIGURAZIONALI OTTICI
10.4 IDROCARBURI AROMATICI
10.4.1 BENZENE
10.4.2 I PRINCIPALI COMPOSTI AROMATICI DERIVANTI DAL BENZENE ‒ ARENI
10.4.3 IDROCARBURI POLICICLICI AROMATICI
10.4.4 COMPOSTI ETEROCICLICI INSATURI
10.5 ADDIZIONE E SOSTITUZIONE ELETTROFILA
10.5.1 ADDIZIONE ELETTROFILA
10.5.2 SOSTITUZIONE ELETTROFILA
10.6 GRUPPI FUNZIONALI
10.6.1 ALOGENURI ALCHILICI E ARILICI
10.6.3 ALCOLI
10.6.4 Proprietà fisiche e chimiche e preparazione degli ALCOL
10.6.5 POLIALCOLI (POLIOLI)
10.6.6 ETERI
10.6.7 CARBONILE – ALDEIDI E CHETONI
10.6.8 CARBOSSILE – ACIDI ORGANICI
10.6.9 ANIDRIDI
10.6.10 ESTERI
10.6.11 LIVELLI DI OSSIDAZIONE DELLE MOLECOLE ORGANICHE
10.6.12 SAPONIFICAZIONE
10.6.13 FOSFOLIPIDI
10.6.14 LIPIDI O GRASSI
10.6.15 AMMINE
10.6.16 AMMIDI
10.6.17 AMMINOACIDI – PROTEINE
10.7 POLIMERI
10.8 CARBOIDRATI


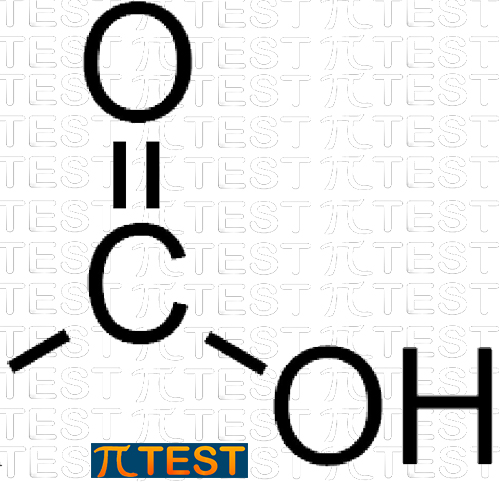 CARBOSSILE
CARBOSSILE