9.2 Soluzioni acide e basiche – pH
Quando nell’acqua abbiamo un soluto dobbiamo sempre considerare se questo interviene nelle concentrazioni di H3O+ e OH‒. Quando le concentrazioni di H3O+ [H3O+] superano il valore di neutralità 10‒7, la soluzione acquosa è acida, quando sono inferiori è invece basica.
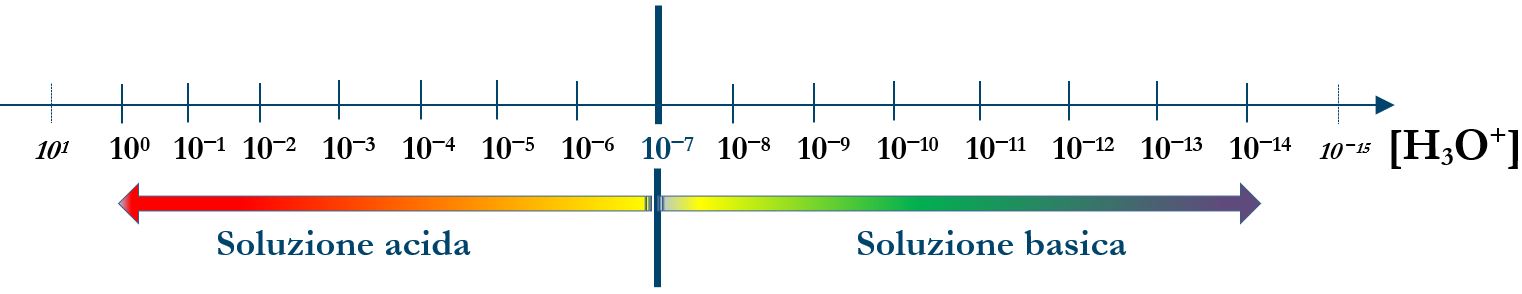
Un sistema di misura della acidità è il «pH» che utilizza il cologaritmo della concentrazione degli ioni idronio (il cologaritmo è il logaritmo cambiato di segno). La lettera minuscola p che forma il termine pH equivale a fare il cologaritmo di una qualsiasi grandezza fisica. (1)
pH = – log10[H3O+]
Le soluzioni acide avranno un pH inferiore a 7 e quelle basiche superiore a 7.
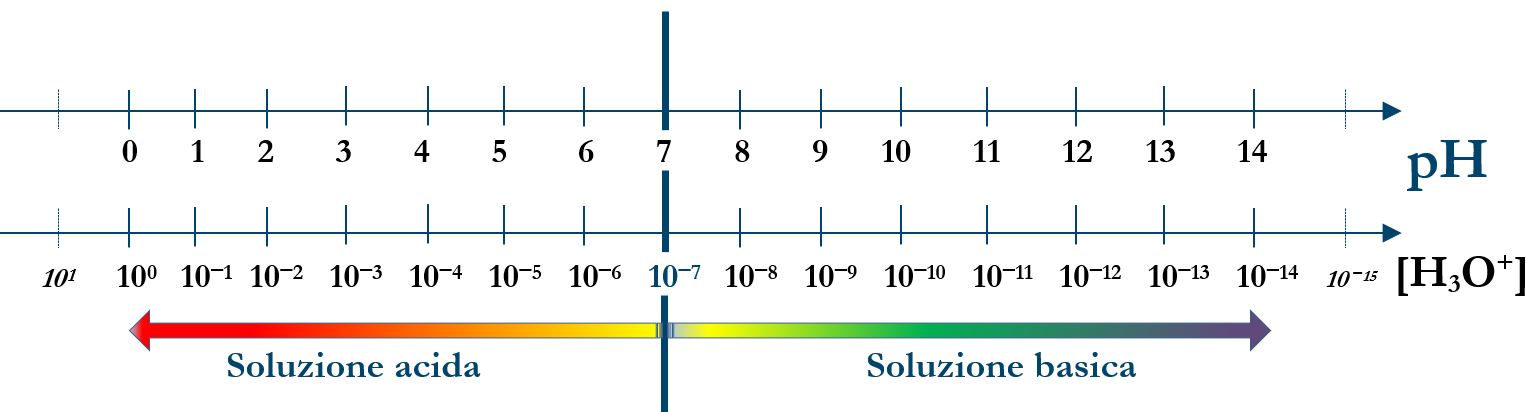
Lo stesso procedimento viene fatto sulla concentrazione degli ioni ossidrile [OH‒]:
pOH = – log10[OH–]
Se ci mettiamo in Condizioni Normali (25°C, 1 atm) il Kw vale 10‒14 e di conseguenza (si potrebbe dimostrare) sarà:
pH + pOH = 14
A volte nei quiz si richiede allo studente di effettuare un semplice calcolo basato su questa relazione (pH+pOH=14), senza però specificare che ci troviamo in Condizioni Normali. Dovrà lo studente capire da solo che questa condizione era implicita e data per scontata. Altre volte, più rare, invece il quiz ci mette in condizioni termodinamiche diverse dalla Condizione Normale e la soluzione del quiz dipende da opportuni ragionamenti su tale condizione.
È bene capire che quando aumenta la concentrazione degli ioni idronio H3O+, nella soluzione diminuisce la concentrazione degli ioni ossidrile OH‒ perché deve essere rispettato il valore del prodotto ionico Kw. È opportuno capire il seguente schema nel quale si può vedere il confronto delle concentrazioni dei due ioni:
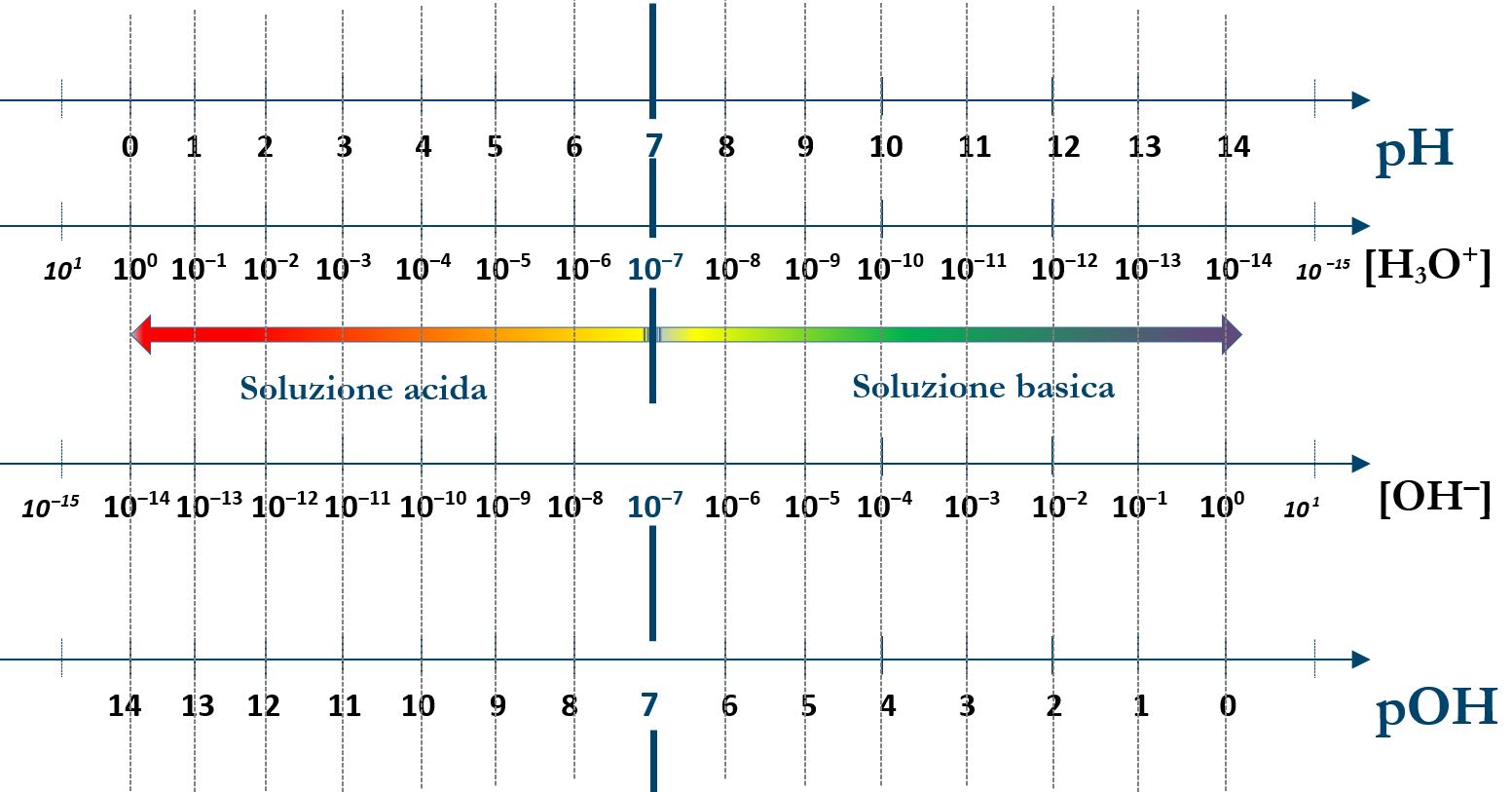
Nota: (1) Per esempio se ci riferiamo alla costante di equilibrio K di una reazione chimica possiamo considerare il suo pK che equivale a ‒log10(K). Utilizzeremo questa grandezza nello studio del pH delle soluzioni tampone.
© il testo e le immagini sono di esclusiva proprietà dell’autore e sono sottoposti a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito
© il testo e le immagini sono di esclusiva proprietà dell’autore e sono sottoposti a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito
9.1 Autoprotolisi
9.2 Soluzioni acide e basiche – pH
9.3 Definizione di acido e base
9.4 Acidi mono e poli-protici
9.5 Costante di equilibrio di acidi e basici
9.6 Acidi e basi forti e deboli
9.7 Rapporto tra Ka e Kb
9.8 Acidi e basi FORTI in soluzione
9.9 Diluizioni di acidi e basi forti in soluzione
9.10 Acidi e basi DEBOLI in soluzione
9.11 Neutralizzazione
9.12 Sali neutri, acidi e basici
9.13 Tamponi


