9.1 Autoprotolisi (autoionizzazione, autodissociazione)
L’acqua, anche quando è pura, senza altre sostanze disciolte, dà luogo ad una particolare reazione, detta autoprotolisi o autoionizzazione o autodissociazione, per la quale una molecola di acqua di dissocia in due ioni: H+ e OH‒.
(autoprotolisi – 1) H2O ⇆ H+ + OH−
Lo ione H+ è un atomo di idrogeno che ha perso il suo unico elettrone; si tratta così del solo nucleo dell’atomo costituito da un solo protone. Per questo motivo spesso chiamiamo con il termine “protone” lo ione H+.
Il termine protone viene utilizzato anche quando un acido si dissocia rilasciando H+; chiamiamo questa reazione “deprotonazione”.
Lo ione H+ libero però non esiste in natura perché si tratta solo di un protone isolato che si lega ad altri complessi molecolari. In acqua il protone H+ si lega con legame dativo ad una molecola d’acqua formando lo ione idronio H3O+:
H+ + H2O ⭢ H3O+
Considerando che non esiste mai il protone H+, ma esiste lo ione idronio H3O+, possiamo scrivere la reazione di autoprotolisi nella forma:
(autoprotolisi – 2) 2 H2O ⇆ H3O+ + OH−
Dopo questa spiegazione possiamo capire il significato del termine autoprotolisi:
auto = significa che la reazione avviene da sola senza l’intervento di agenti esterni
proto = protone H+, generato dalla lisi della molecola d’acqua
lisi = taglio (la molecola d’acqua si spezza in H+ e OH‒)
Nei diversi testi di chimica e nei diversi quiz a volte troviamo il riferimento allo ione idronio H3O+, altre volte troviamo il riferimento allo ione H+ e altre ancora al termine protone.
Come ogni altra reazione chimica l’autoprotolisi possiede una sua costante di equilibrio (vedi teoria costante di equilibrio). Scriviamo la costante di equilibrio:
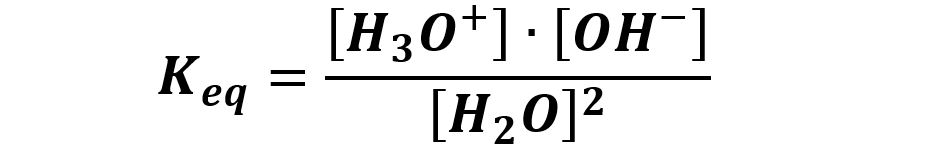
Cercando di eliminare la concentrazione del reagente, l’acqua pura, perchè è un valore costante pari alla concentrazione molare dell’acqua nell’acqua stessa che vale 55,5 mol/L, utilizziamo una costante diversa, Kw, detta prodotto ionico dell’acqua:
Kw = Keq · [H2O]2 = [H3O+] · [OH–]
(il pedice W sta per water, acqua)
Così come per tutte le costanti di equilibrio, anche Kw dipende dalla temperatura. Negli esercizi più semplici e quasi sempre nei quiz si fa riferimento al valore di Kw a 25°C (298K) e 1 atm, condizione termodinamica che chiamiamo “CN”, Condizioni Normali (1). Il prodotto ionico Kw in Condizioni Normali vale:
Kw = 10‒14
Acqua neutra
Se consideriamo acqua distillata senza alcuna sostanza disciolta possiamo calcolare la concentrazione degli ioni idronio e degli ioni ossidrile che si generano spontaneamente per autoprotolisi in condizioni normali.
Il numero di ioni idronio e di ioni ossidrile è uguale perché ogni molecola d’acqua di suddivide esattamente in uno ione per tipo.
Se chiamiamo con la variabile x la concentrazione molare di questi ioni avremo:
x = [H3O+] = [OH–]
Se ci mettiamo in condizioni normali co x n Kw = 10‒14 avremo:
[H3O+] · [OH–] = x · x = 10–14
Da cui ricaviamo x:
x2 = 10–14
x = √10–14 = 10–7
Concludiamo che in condizioni normali nell’acqua neutra le concentrazioni [H3O+] e [OH−] valgono 10‒7.
Nota: (1) Attenzione a non confondere le Condizioni Normali (25°C, 1atm) con le condizioni standard (0°C, 1atm). Le Condizioni Normali si utilizzano nei quiz sull’acidità delle soluzioni mentre le condizioni standard si usano per definire condizioni termodinamiche alle quali una mole di gas occupa 22,4 Litri.
© il testo e le immagini sono di esclusiva proprietà dell’autore e sono sottoposti a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito
9.1 Autoprotolisi
9.2 Soluzioni acide e basiche – pH
9.3 Definizione di acido e base
9.4 Acidi mono e poli-protici
9.5 Costante di equilibrio di acidi e basici
9.6 Acidi e basi forti e deboli
9.7 Rapporto tra Ka e Kb
9.8 Acidi e basi FORTI in soluzione
9.9 Diluizioni di acidi e basi forti in soluzione
9.10 Acidi e basi DEBOLI in soluzione
9.11 Neutralizzazione
9.12 Sali neutri, acidi e basici
9.13 Tamponi


