4.5 Ibridazione degli orbitali
In molte molecole gli orbitali coinvolti nei legami covalenti assumono forme diverse rispetto alla forma che assumono negli atomi non legati. Questo accade per permettere una distribuzione spaziale più “comoda” degli atomi della molecola. Le nuove forme degli orbitali vengono chiamate ibride perché derivano sempre dalla fusione di due o più orbitali atomici diversi che assumono una forma geometrica che deriva dalle forme degli orbitali di partenza (ibrido in generale significa che deriva da due o più entità diverse che si fondono per creare una nuova entità che conserva in parte le proprietà di tutte le entità che lo hanno generato).
L’orbitale sferico s insieme agli orbitali bilobati p riassettano la loro struttura spaziale formando nuovi orbitali la cui forma è una via di mezzo tra la forma sferica e quella bilobata. A volte entrano in gioco uno o due orbitali di tipo d.
Le ibridazioni degli orbitali che possono formarsi prendono il nome dagli orbitali atomici che entrano in gioco.
4.5.1 Ibridazione del carbonio
Negli esempi che seguiranno consideriamo l’atomo di carbonio C che si presta a diverse possibili configurazioni ibride.
La configurazione elettronica del carbonio è 1s22s22p2 che può essere rappresentata graficamente come in figura.
Dalla configurazione base un elettrone presente nell’orbitale 2s si sposta nell’orbitale 2p vuoto. Questo passaggio viene chiamato “promozione”.
Dopo la promozione dell’elettrone 2s in 2p, abbiamo quatto orbitali incompleti che possono andare a formare legami covalenti con orbitali di altri atomi.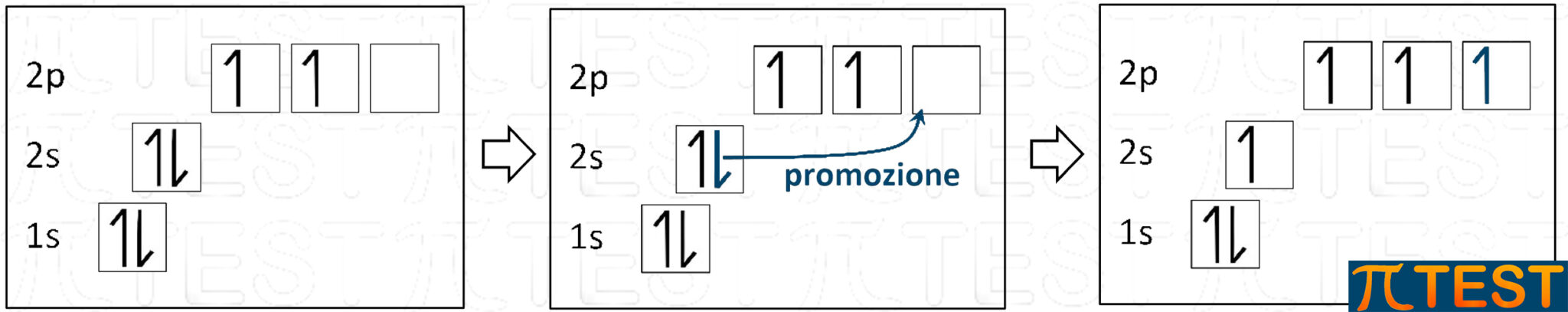
Per favorire una disposizione geometrica più comoda che permetta agli atomi della molecola di trovarsi in posizioni di minor ingombro reciproco i quattro orbitali incompleti rimescolano la loro forma e la loro disposizione spaziale andando a generare nuovi orbitali che chiamiamo orbitali ibridi.
Il carbonio può formare tre diversi tipi di ibridazione che vediamo tra poco.
4.5.2 VSEPR
La teoria che spiega le ragioni delle collocazioni spaziali dei diversi orbitali si chiama VSEPR.
|
VSEPR = Valence Shell Electron Pair Repulsion (Repulsione tra doppietti elettronici del guscio di valenza) |
Per “doppietto elettronico” si intende un orbitale che può essere sia di legame (orbitale molecolare) sia libero. Un doppietto elettronico, o orbitale, è costituito da due elettroni e possiede perciò una carica elettrica negativa. Poiché due doppietti elettronici, ovvero due orbitali, hanno carica elettrica dello stesso segno tendono da disporsi tra di loro il più lontani possibile. Questo spiega la geometria tetraedrica che assumono i quattro orbitali sp3. Ogni altra possibile disposizione spaziale vedrebbe almeno due orbitali più vicini.
4.5.3 Ibridazione sp3
sp3 nel carbonio
Facciamo riferimento al carbonio. L’orbitale 2s e i tre orbitali 2p si trasformano in quattro nuovi orbitali che prendono il nome sp3.
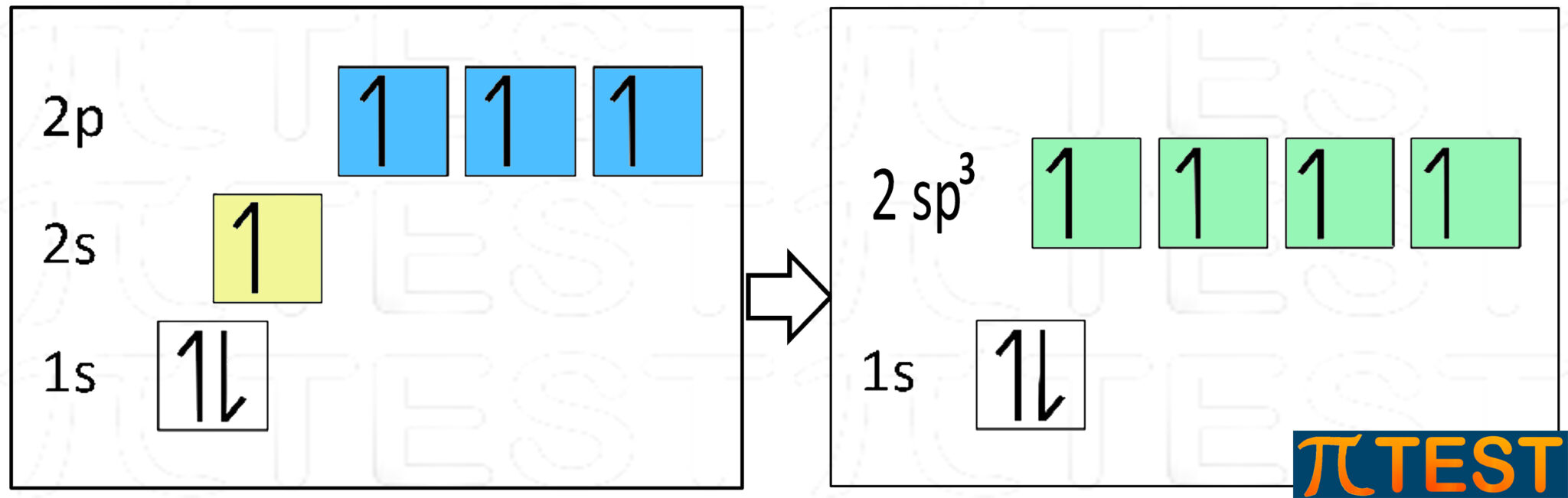
sp3 è una scrittura simbolica. Il numero 3 scritto come apice serve a ricordare che in origine c’erano tre orbitali di tipo p e non ha nulla a che vedere con le scritture che si adottano per scrivere le configurazioni elettroniche (nelle quali il numero all’apice indica invece il numero di elettroni presenti negli orbitali).
I quattro orbitali sp3 hanno una forma allungata come in figura, forma ibrida che conserva le caratteristiche geometriche dell’orbitale s e dell’orbitale p. Gli orbitali sp3 si direzionano verso i vertici di un tetraedro regolare in base alla teoria VSEPR.
|
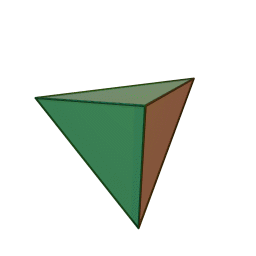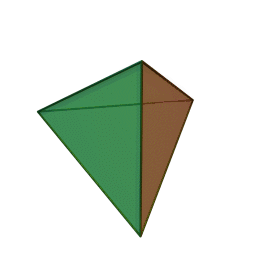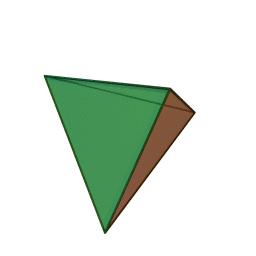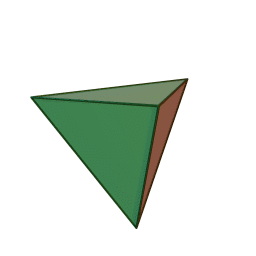
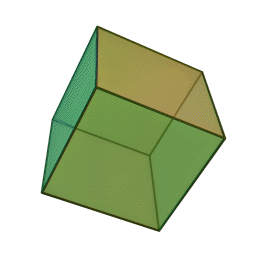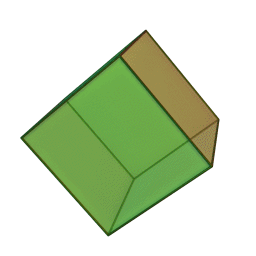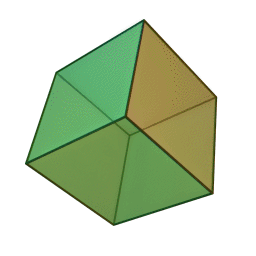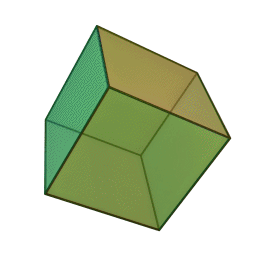
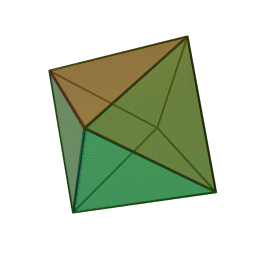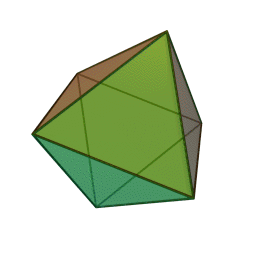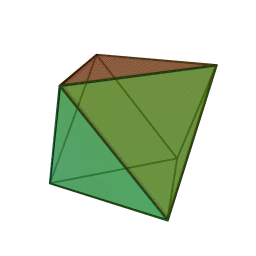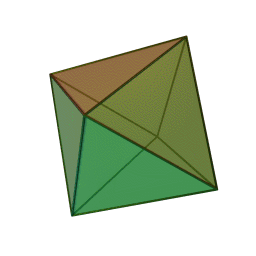
Approfondimento di geometria Il tetraedro regolare è una piramide a base triangolare nella quale tutte e quattro le facce sono triangoli equilateri. È un solido particolare che, per le sue caratteristiche di regolarità, è classificato tra i solidi platonici, che sono solo cinque possibili poliedri che hanno per facce tutti poligoni regolari identici. I cinque poliedri convessi regolari ( solidi platonici ) immagini da: https://en.wikipedia.org/wiki/Platonic_solid |
||||
| tetraedro | esaedro o cubo | ottaedro | decaedro | icosaedero |
| quattro triangoli equilateri | sei quadrati | otto triangoli equilateri | dieci pentagoni | venti triangoli equilateri |
 |
 |
 |
 |
 |
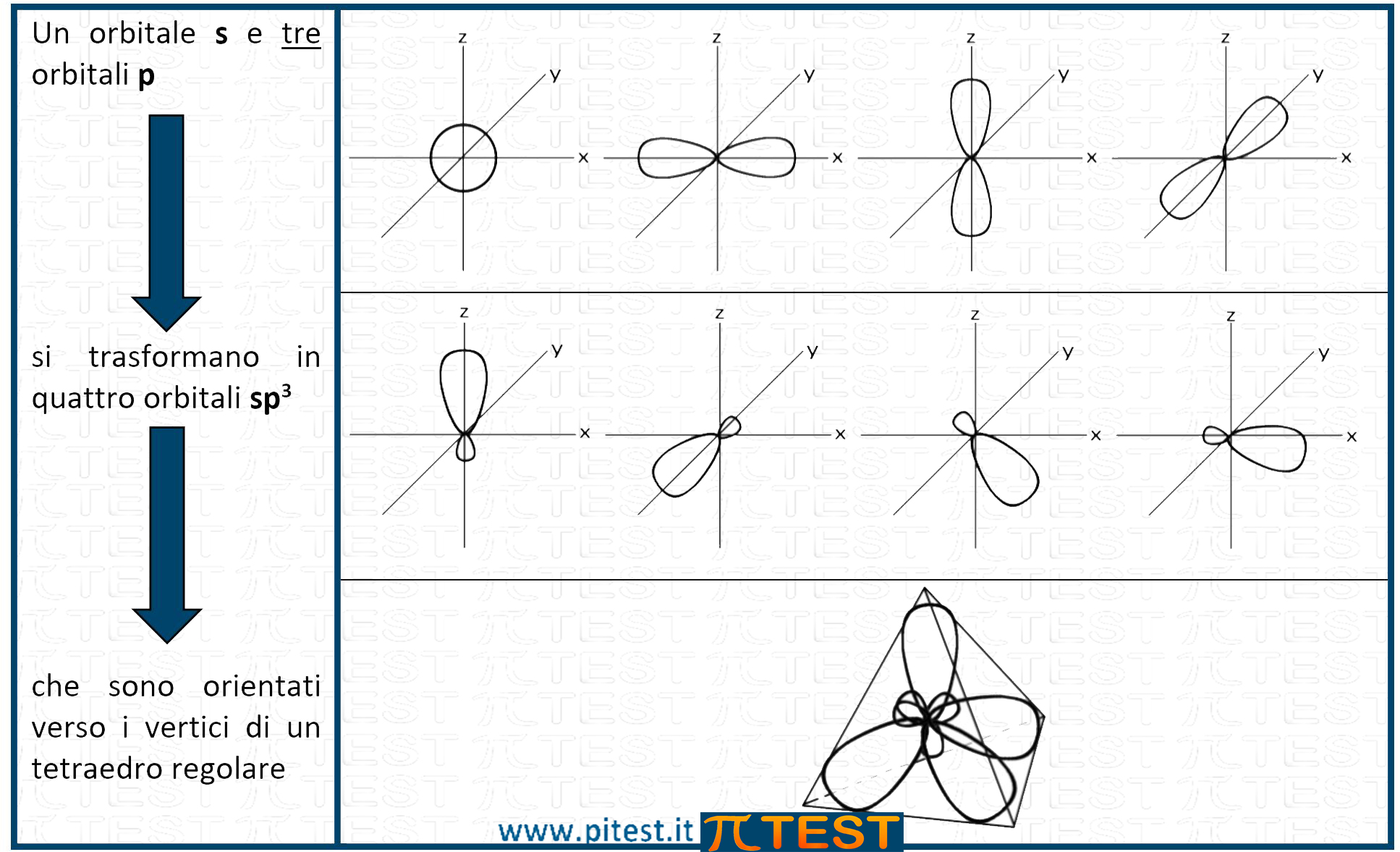 L’angolo che si forma tra gli orbitali sp3 è di 109,5°C.
L’angolo che si forma tra gli orbitali sp3 è di 109,5°C.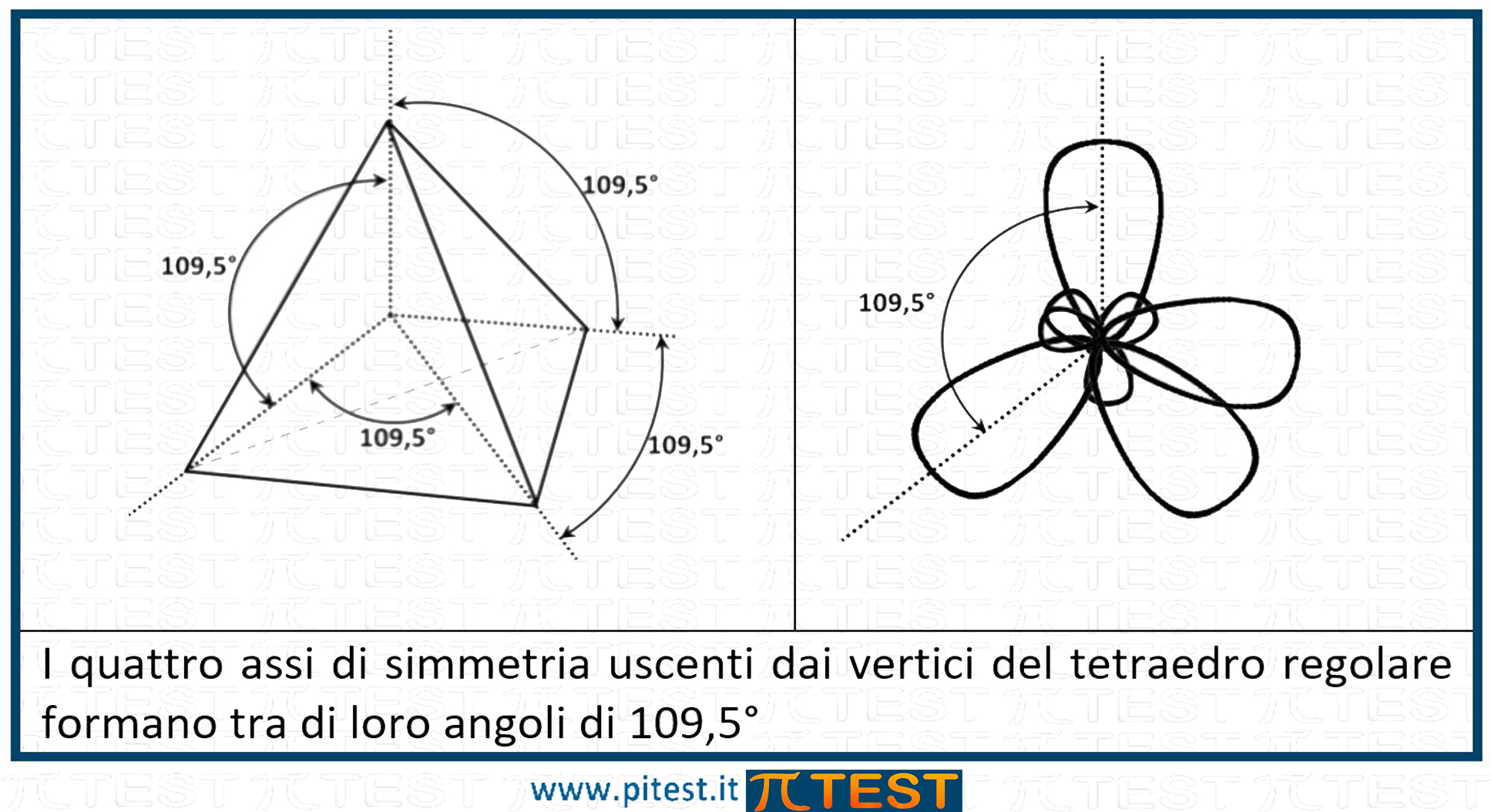 La molecola che tipicamente si utilizza per rappresentare l’ibridazione sp3 del carbonio è quella del metano CH4.
La molecola che tipicamente si utilizza per rappresentare l’ibridazione sp3 del carbonio è quella del metano CH4.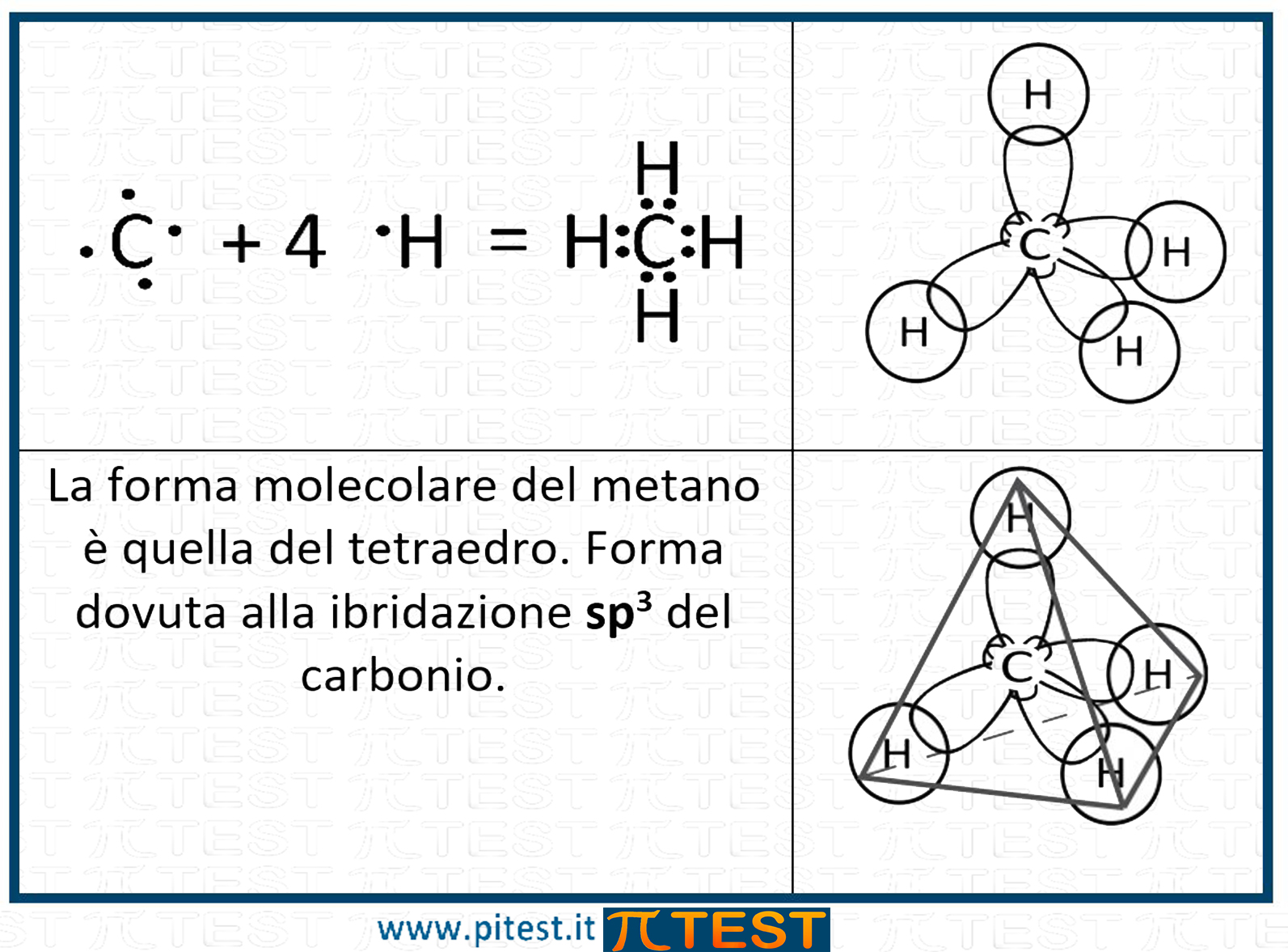
A volte si rappresentano i quattro orbitali dell’ibridazione sp3 con linee più marcate e rastremate per indicare il legame uscente dal piano verso lo spettatore e da linee rastremate tratteggiate per indicare i legami nascosti dietro al foglio.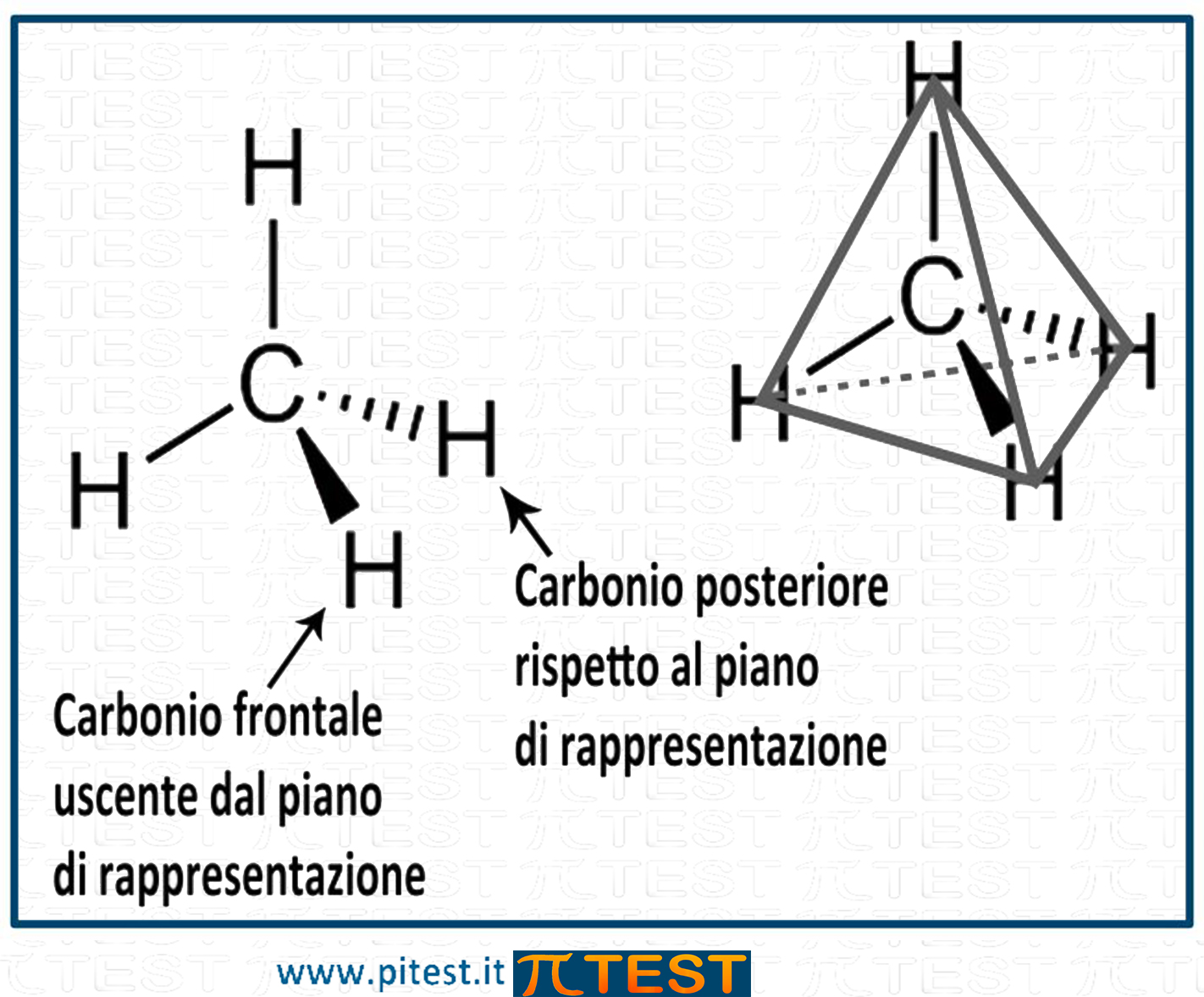
sp3 nell’azoto
Anche l’azoto N può avere una ibridazione sp3.
Con la configurazione elettronica 1s22s22p3 possiede un elettrone in più del carbonio (il numero atomico dell’azoto è 7, mentre per il carbonio è 6).
Di conseguenza uno dei quattro orbitali sp3 possiede due elettroni e non formerà legami covalenti come gli altri tre.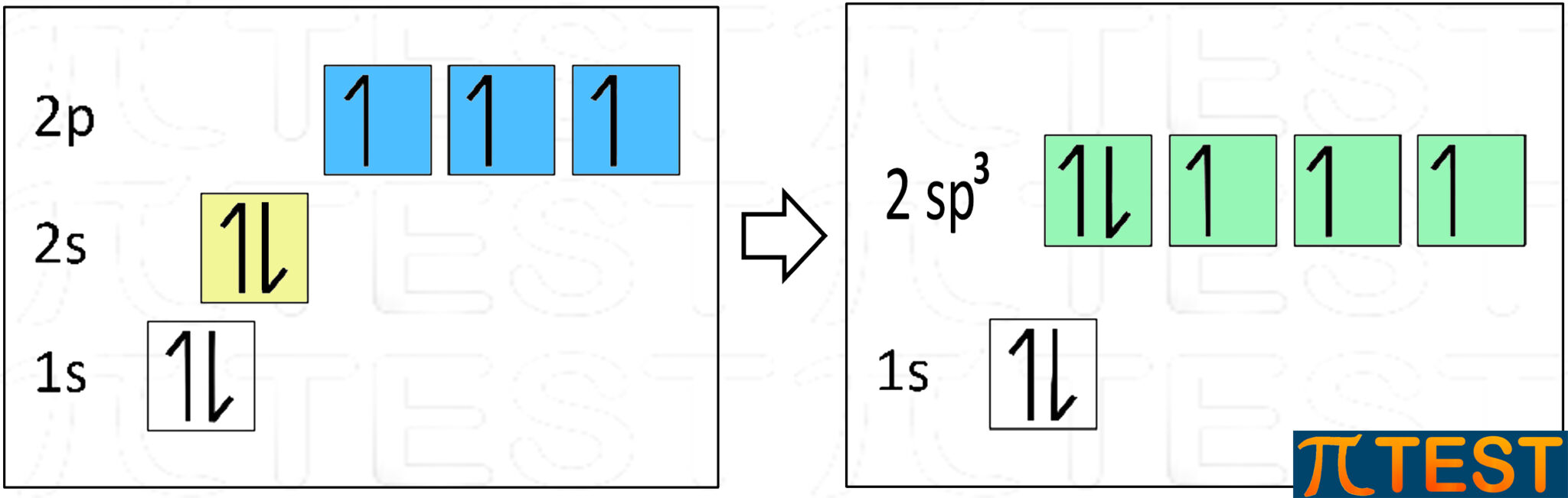 La molecola che tipicamente si utilizza per esemplificare l’ibridazione sp3 dell’azoto è quella dell’ammoniaca NH3.
La molecola che tipicamente si utilizza per esemplificare l’ibridazione sp3 dell’azoto è quella dell’ammoniaca NH3.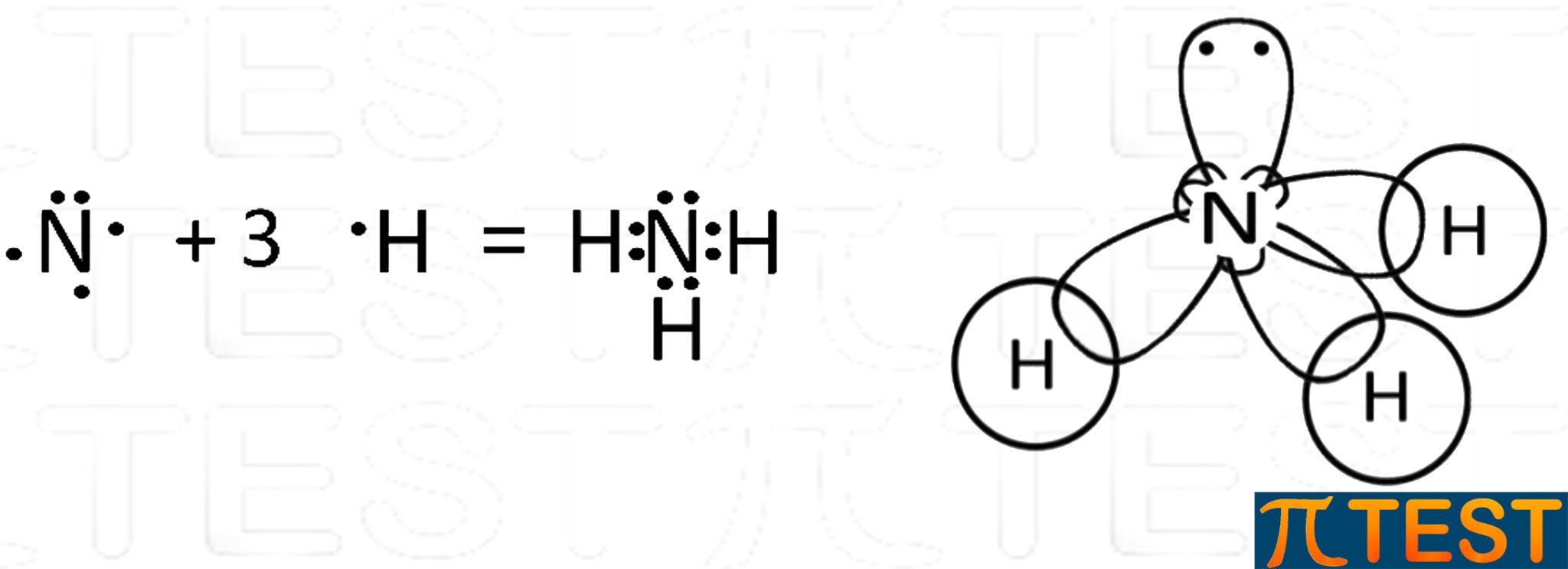 L’ammoniaca NH3 possiede tre doppietti elettronici di legame ed un doppietto libero.
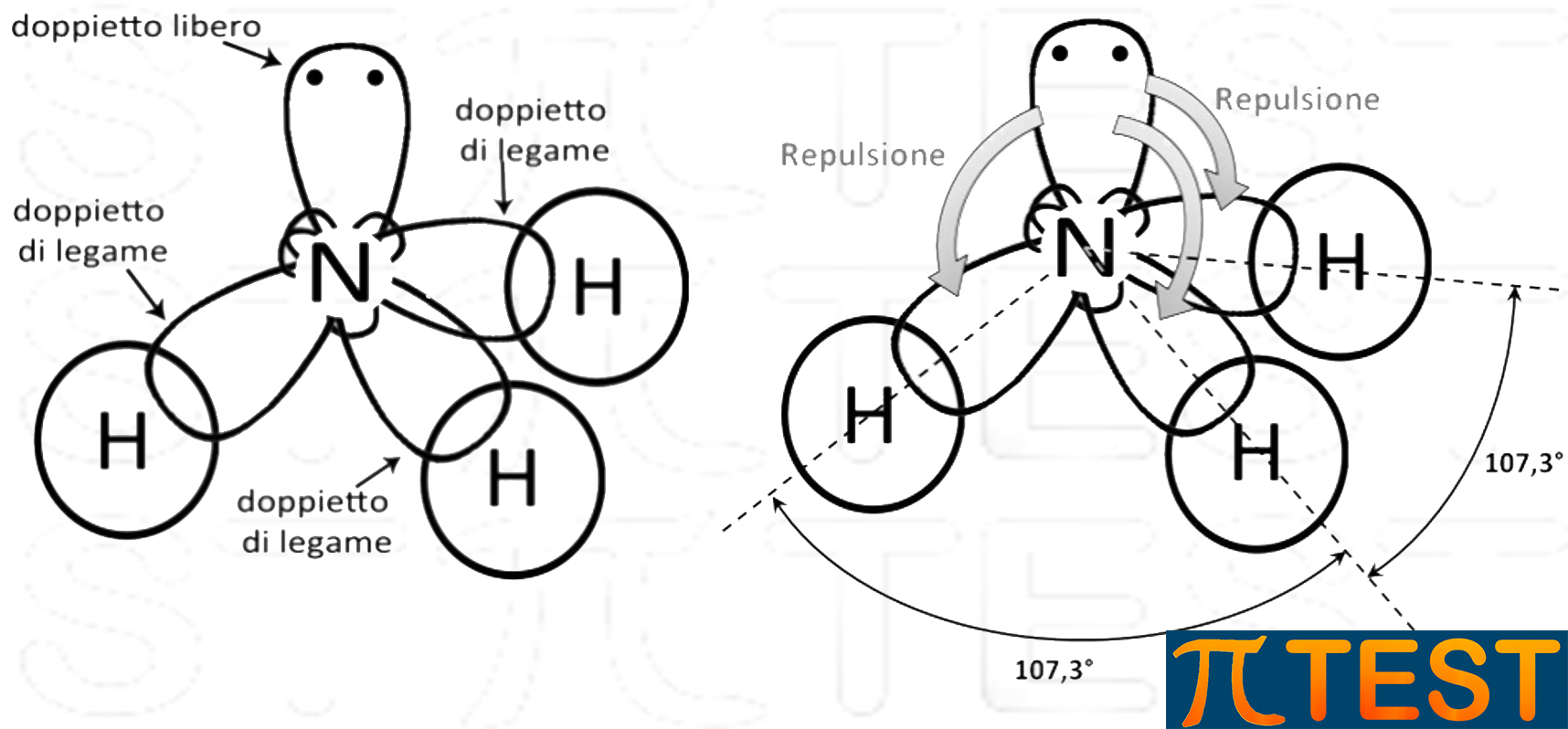
L’ammoniaca NH3 possiede tre doppietti elettronici di legame ed un doppietto libero.
Il doppietto elettronico libero in un orbitale solitario causa una repulsione più forte verso gli altri orbitali di legame che si avvicinano riducendo l’angolo tra i legami da 109,5 a 107,3° .
| forma piramidale | |
| Nel considerare la forma complessiva della molecola di ammoniaca non si considera l’ingombro del doppietto libero, ma solo gli ingombri dovuti ai singoli atomi. Possiamo dire così che la forma è quella di una piramide a base triangolare (non regolare però). | 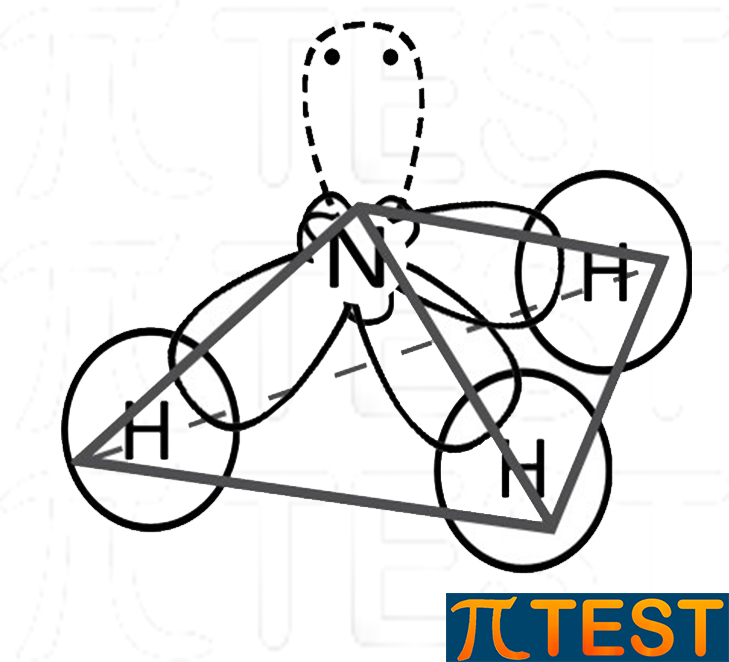 |
|
Ammonio NH4+ |
|
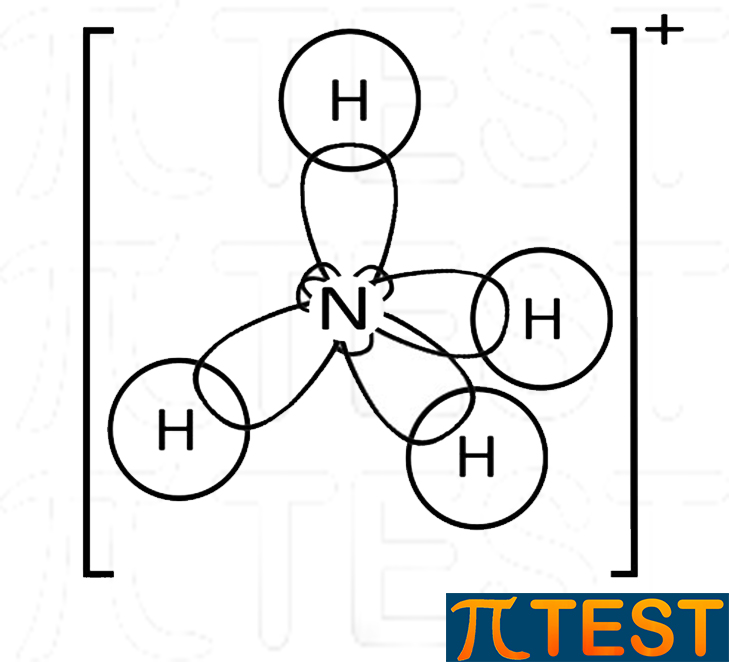
| L’ammoniaca può formare un quarto legame dativo con H+ andando a formare il catione ammonio:
NH3 + H+ = NH4+ L’ammonio NH4+ possiede una forma tetraedrica perfetta come il metano, l’unica differenza consiste nella carica elettrica complessiva +1. |
 |
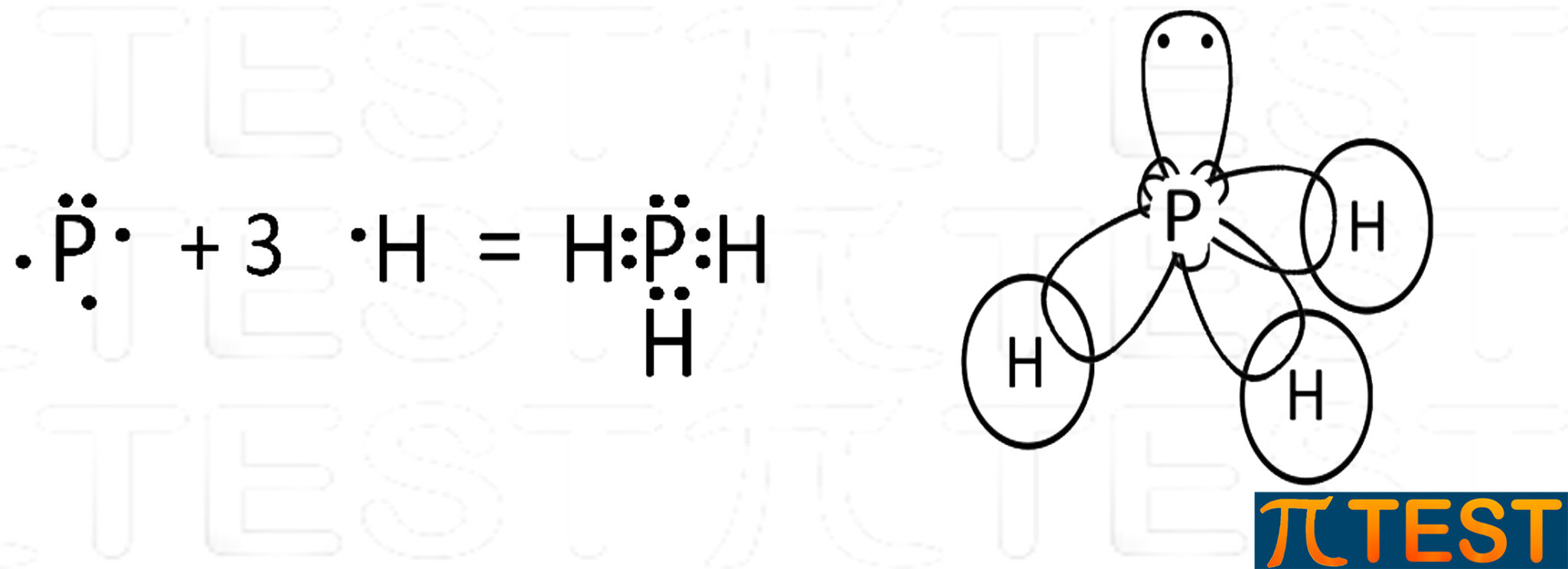
sp3 nel fosforo
Nella tavola periodica il fosforo appartiene allo stesso gruppo dell’azoto (gruppo 15) e per questo motivo ha un comportamento simile. Forma così un composto del tutto analogo all’ammoniaca, la fosfina che possiede caratteristiche simili.
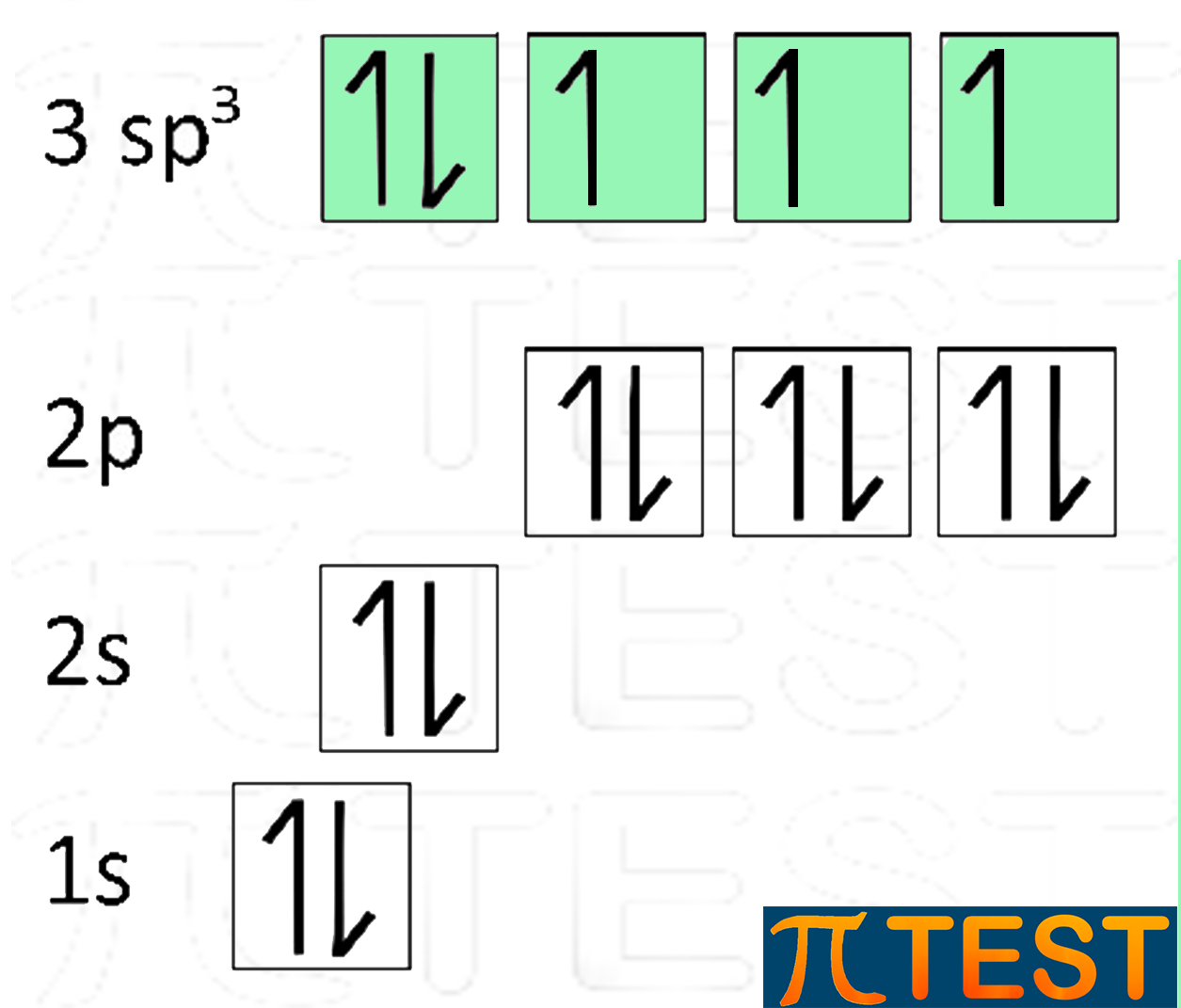
| Il fosforo P, come l’azoto N, può avere una ibridazione sp3.
Con la configurazione elettronica 1s22s22p63s23p3 può formare una ibridazione degli orbitali 3s e 3p formando sp3. Come accade per l’azoto, uno dei quattro orbitali sp3 possiede due elettroni e non formerà legami covalenti come gli altri tre. |
 |
| La molecola che tipicamente si utilizza per esemplificare l’ibridazione sp3 del fosforo è quella della fosfina PH3.
|
|
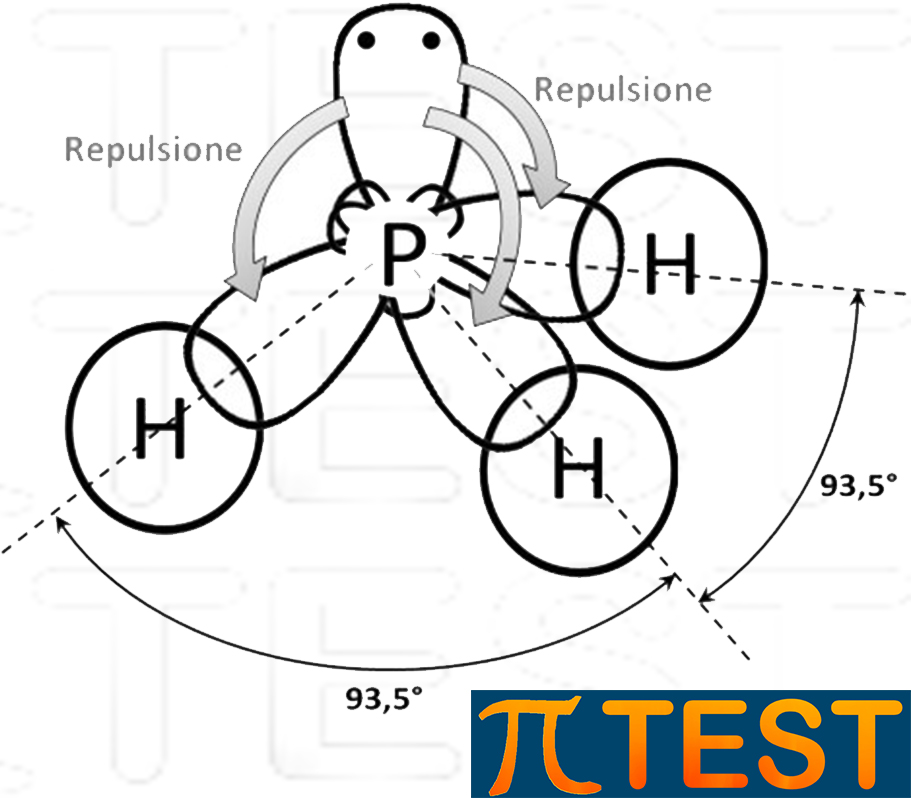
| Similmente all’ammoniaca, la fosfina PH3 possiede tre doppietti elettronici di legame ed un doppietto libero.
Il doppietto elettronico libero in un orbitale solitario causa una repulsione più forte verso gli altri orbitali di legame che si avvicinano riducendo l’angolo tra legami a 93,5°. |
 |
| Nel considerare la forma complessiva della molecola di fosfina non si considera l’ingombro del doppietto libero, ma solo gli ingombri dovuti ai singoli atomi. Coì come per l’ammoniaca, possiamo dire così che la forma è quella di una piramide a base triangolare (non regolare però). | 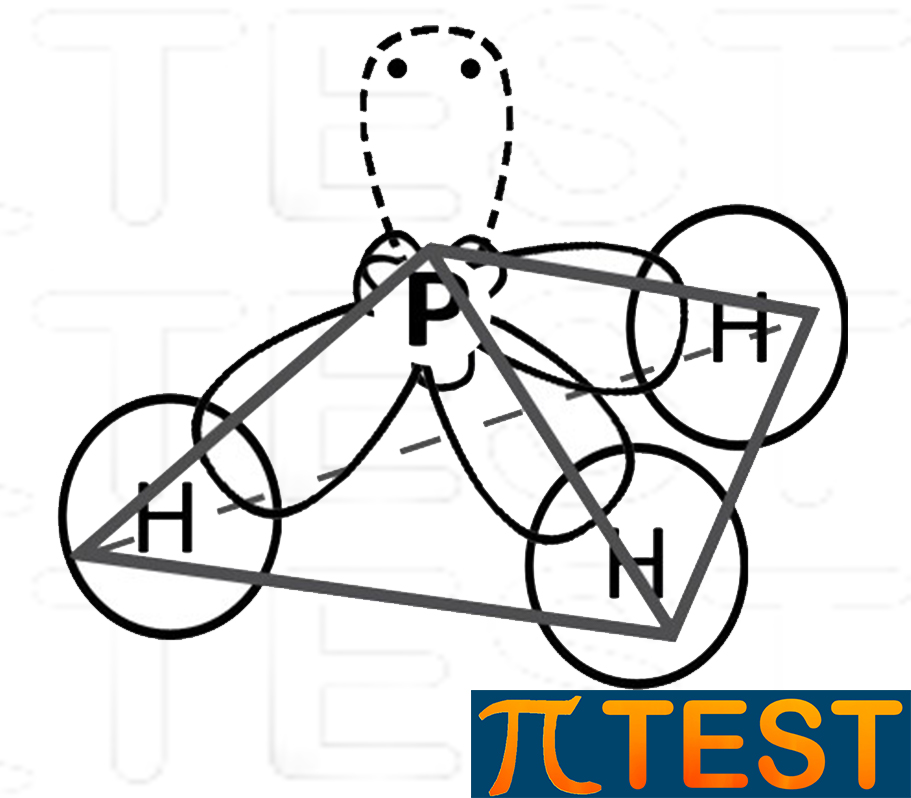 |
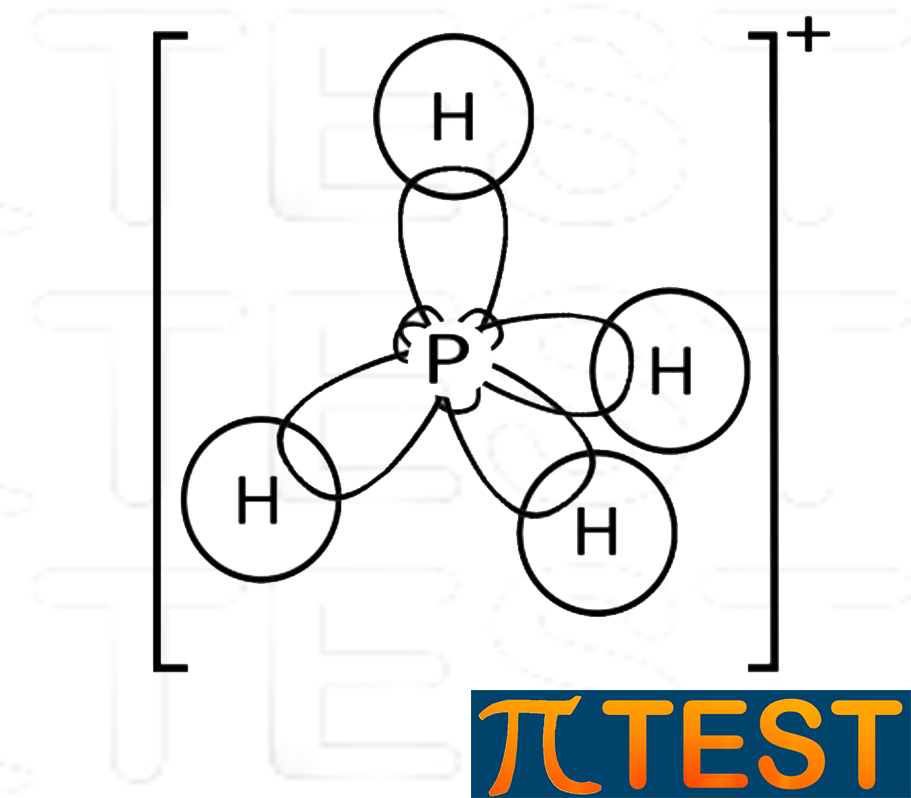
| Fosfonio PH4+
La fosfina può formare un quarto legame dativo con H+ andando a formare il catione ammonio: PH3 + H+ = PH4+. Il fosfonio PH4+ possiede una forma tetraedrica perfetta come il metano, l’unica differenza consiste nella carica elettrica complessiva +1. |
 |
sp3 nell’ossigeno
Anche l’ossigeno O può avere una ibridazione sp3. L’ossigeno con la configurazione elettronica 1s22s22p4 possiede due elettroni in più del carbonio (il numero atomico dell’ossigeno è 8, mentre per il carbonio è 6).
Di conseguenza due dei quattro orbitali sp3 possiedono due elettroni e non formeranno legami covalenti.
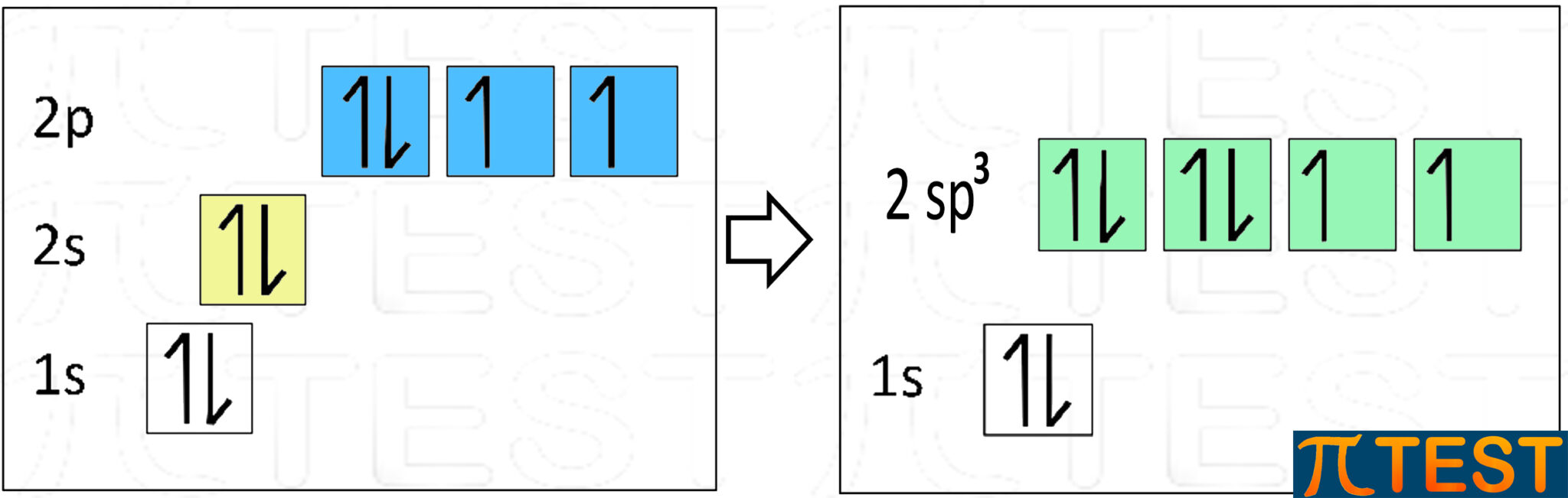 La molecola che tipicamente si utilizza per esemplificare l’ibridazione sp3 dell’ossigeno è quella dell’acqua H2O.
La molecola che tipicamente si utilizza per esemplificare l’ibridazione sp3 dell’ossigeno è quella dell’acqua H2O.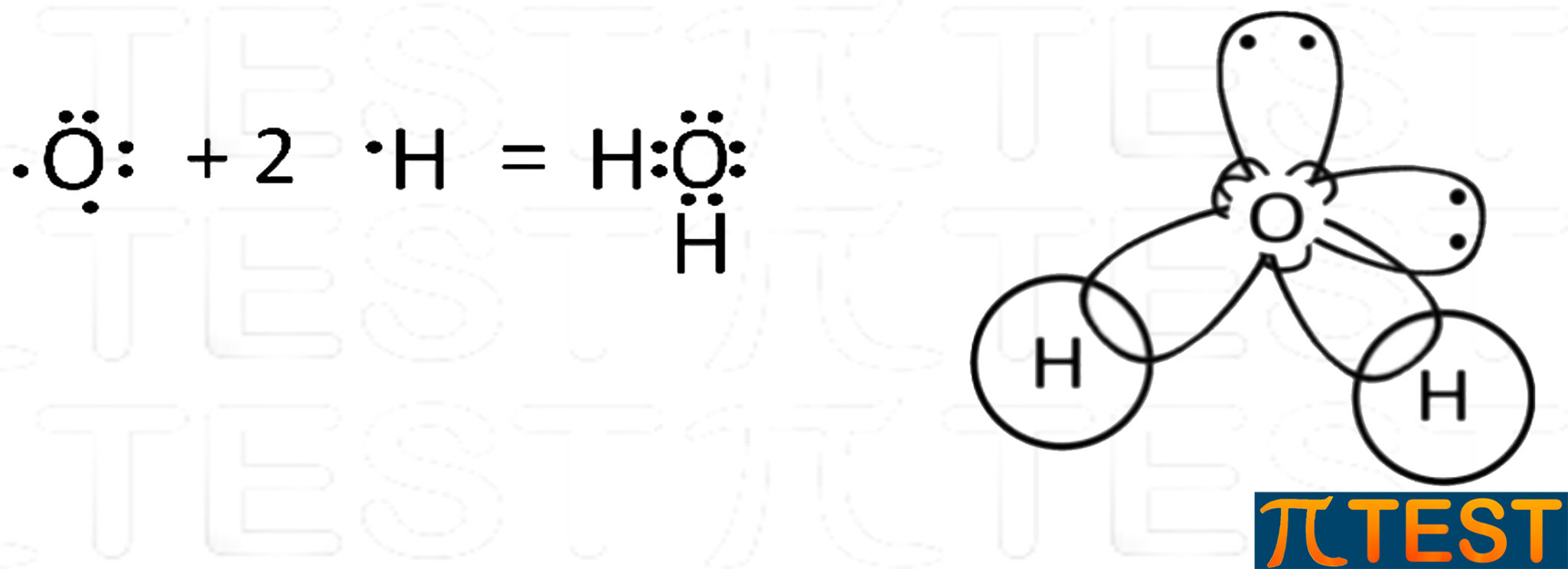
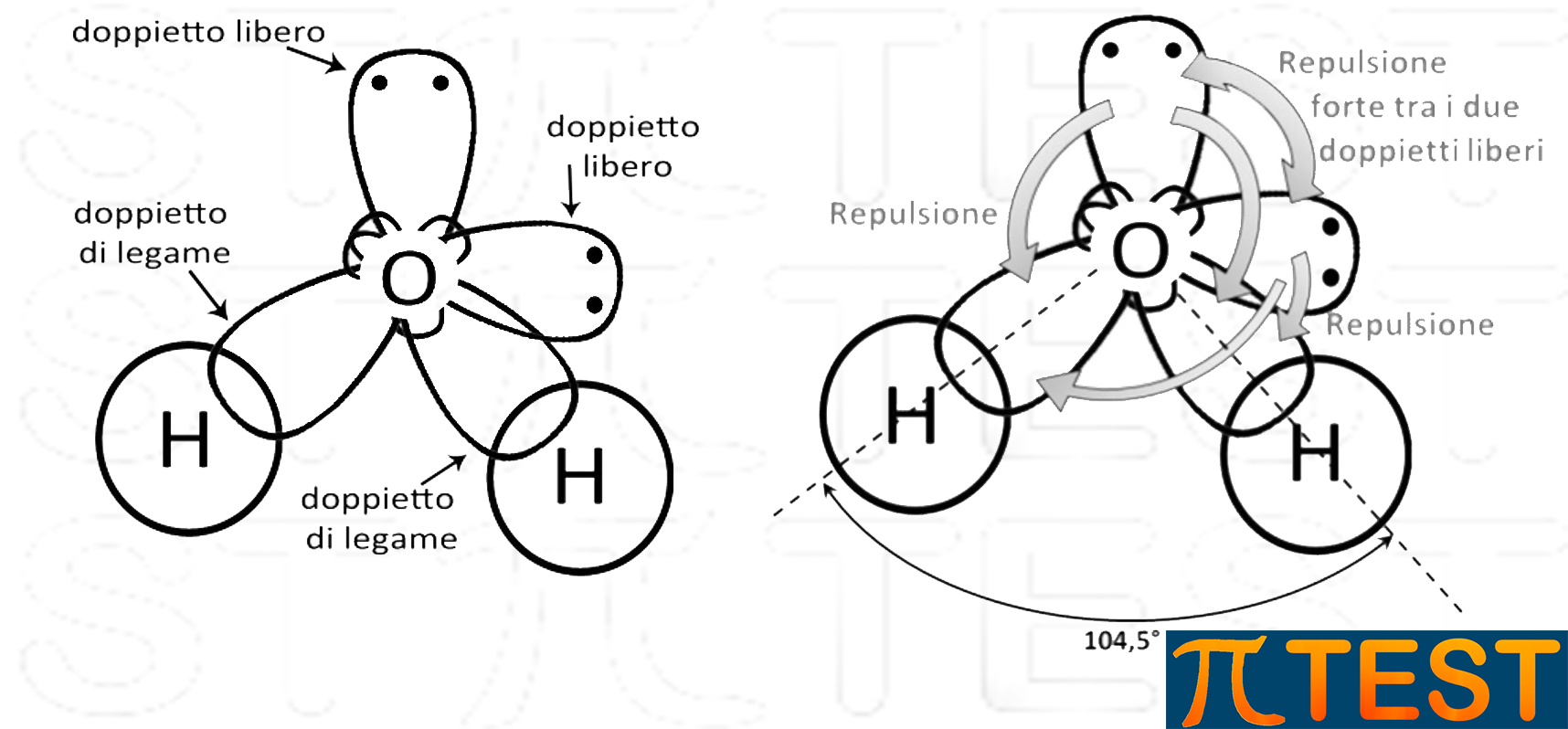
L’acqua possiede due doppietti elettronici di legame e due doppietti liberi.
I due doppietti elettronici liberi in due orbitali solitari causano una repulsione più forte verso gli altri orbitali di legame che si avvicinano riducendo l’angolo tra legami da 109,5 a 104,5°.
| Nel considerare la forma complessiva della molecola d’acqua non si considera l’ingombro dei doppietti liberi, ma solo gli ingombri dovuti ai singoli atomi. Possiamo dire così che la forma è angolare o piegata. | 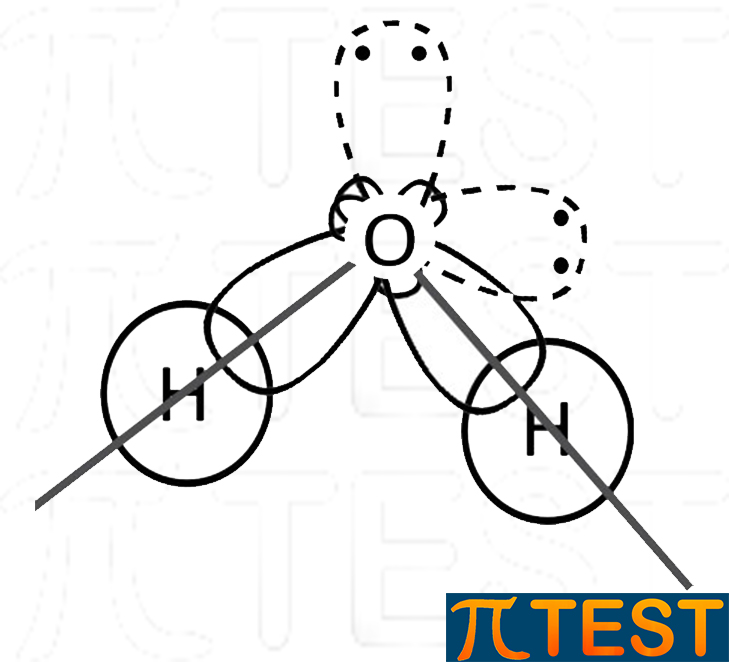 |
| Idronio H3O+ l’acqua può formare un terzo legame dativo con H+ andando a formare il catione idronio: H2O + H+ = H3O+ L’idronio H3O+ ha la forma a piramide a base triangolare identica a quella dell’ammoniaca, l’unica differenza consiste nella carica elettrica complessiva +1. |
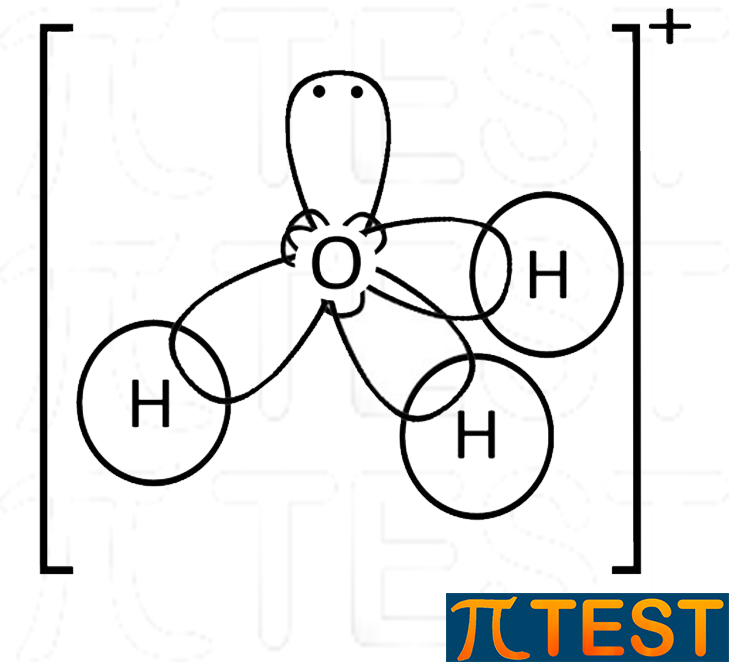 |
Riassumiamo nella seguente tabella i casi esaminati con le loro geometrie.
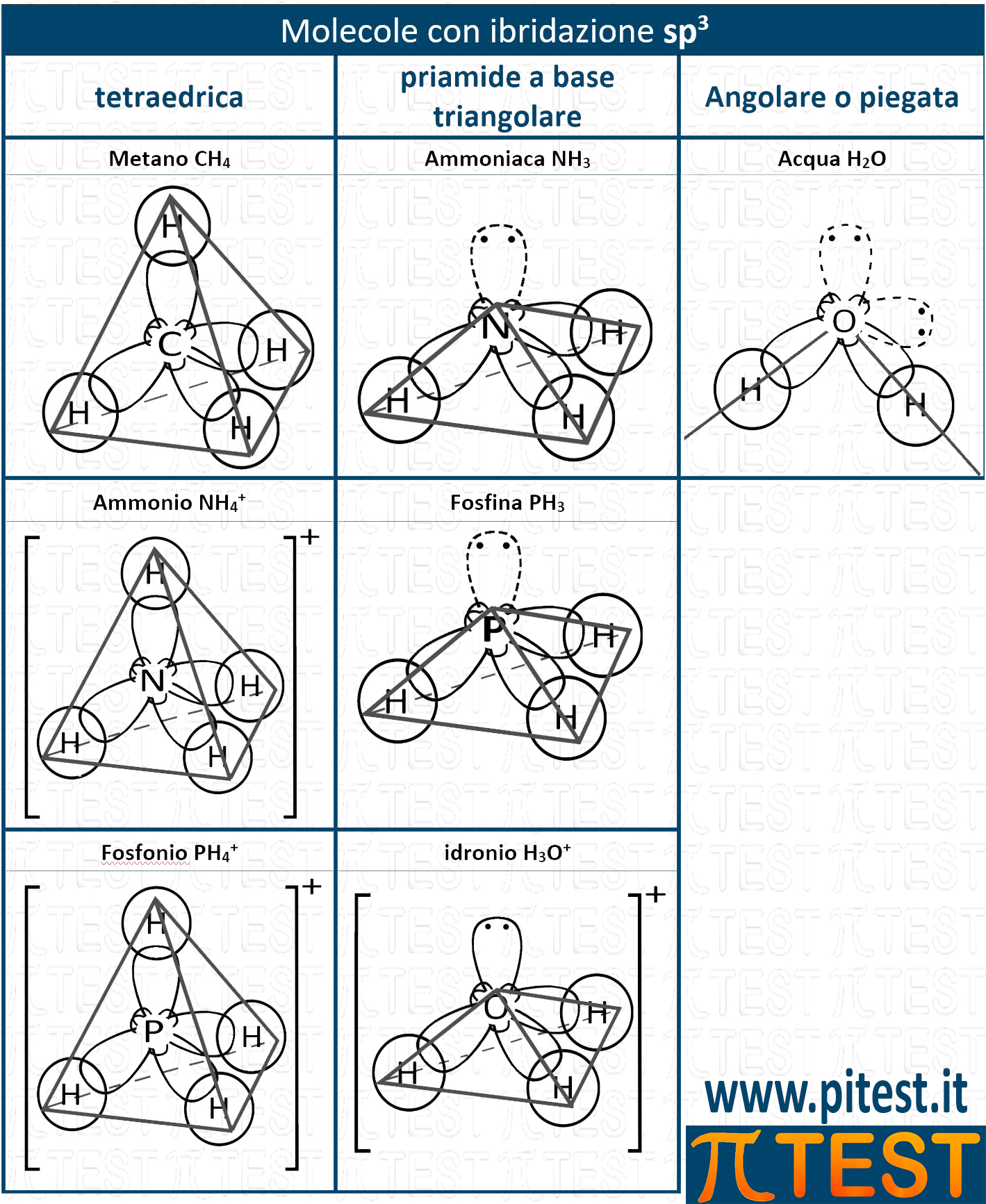
4.5.4 Ibridazione sp2
sp2 nel carbonio
Facciamo riferimento al carbonio che per la sua particolare configurazione elettronica è l’elemento chimico più studiato nelle ibridazioni.
Non esiste solo l’ibridazione sp3 tra l’orbitale s e tutti e tre gli orbitali p. È anche possibile che avvenga l’ibridazione tra l’orbitale s e due soli degli orbitali p che si trasformano in tre nuovi orbitali che prendono il nome sp2.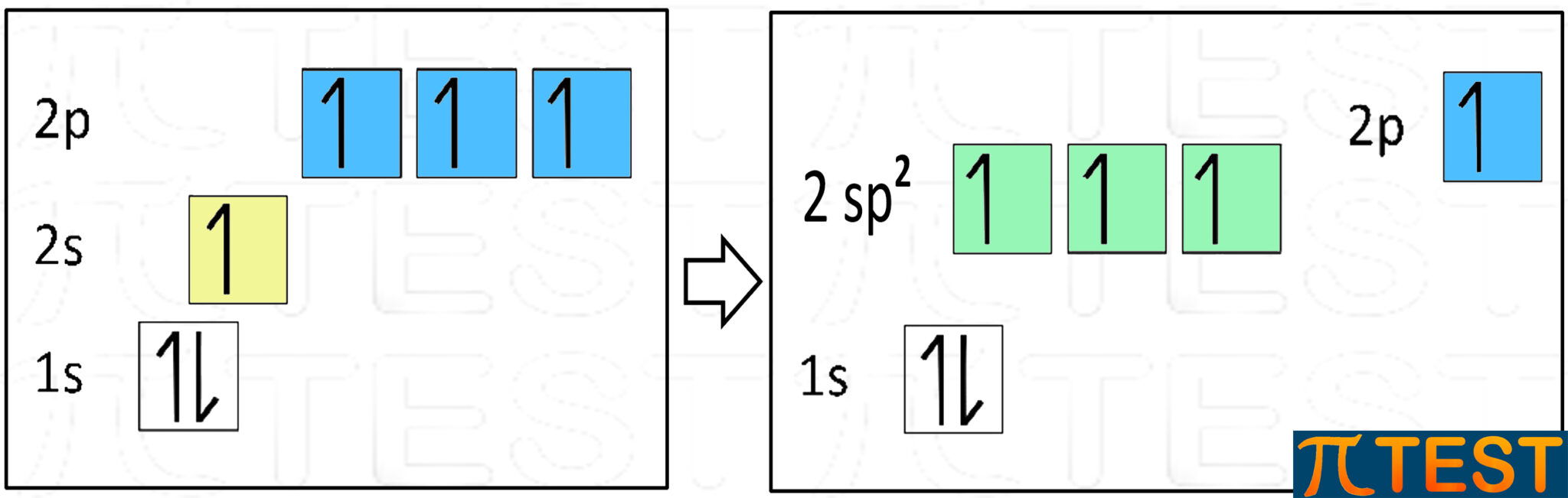 Come abbiamo già detto nel precedente paragrafo, sp2 è una scrittura simbolica. Il numero 2 scritto come apice serve a ricordare che in origine c’erano due orbitali di tipo p e non ha nulla a che vedere con le scritture che si adottano per scrivere le configurazioni elettroniche (nelle quali il numero all’apice indica invece il numero di elettroni presenti negli orbitali).
Come abbiamo già detto nel precedente paragrafo, sp2 è una scrittura simbolica. Il numero 2 scritto come apice serve a ricordare che in origine c’erano due orbitali di tipo p e non ha nulla a che vedere con le scritture che si adottano per scrivere le configurazioni elettroniche (nelle quali il numero all’apice indica invece il numero di elettroni presenti negli orbitali).
L’orbitale p residuo, che non ha preso parte all’ibridazione, rimane nella forma originaria.
I tre orbitali sp2 hanno una forma allungata ibrida che conserva le caratteristiche geometriche dell’orbitale s e dell’orbitale p. In base alla teoria VSEPR gli orbitali sp2 trovano una distribuzione spaziale che soddisfi il principio di repulsione e si direzionano su un piano verso i vertici di un triangolo equilatero formando un angolo di 120°. La forma è anche detta trigonale piana.
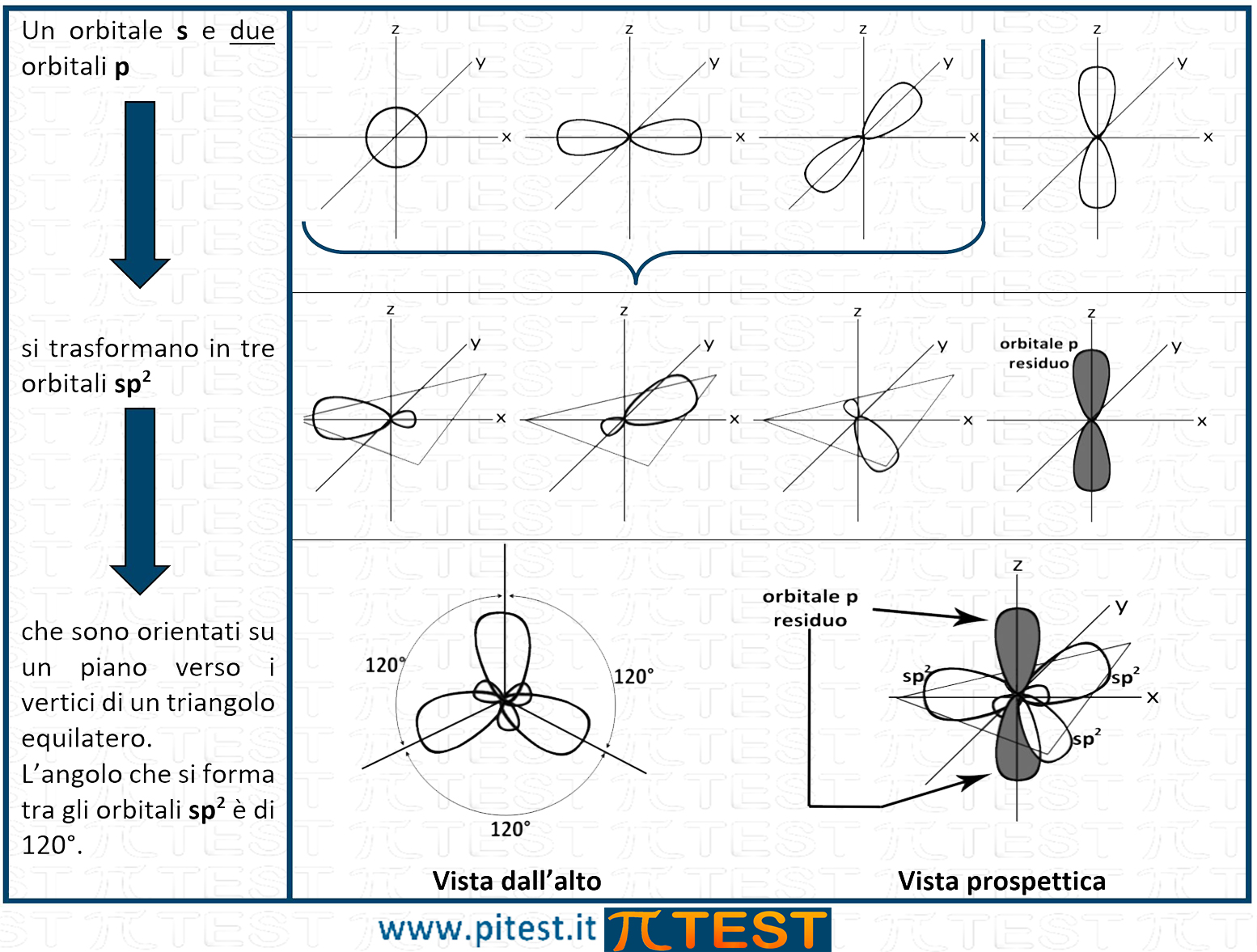 La molecola che tipicamente si utilizza per rappresentare l’ibridazione sp2 del carbonio è quella dell’etene (o etilene) CH2=CH2.
La molecola che tipicamente si utilizza per rappresentare l’ibridazione sp2 del carbonio è quella dell’etene (o etilene) CH2=CH2.
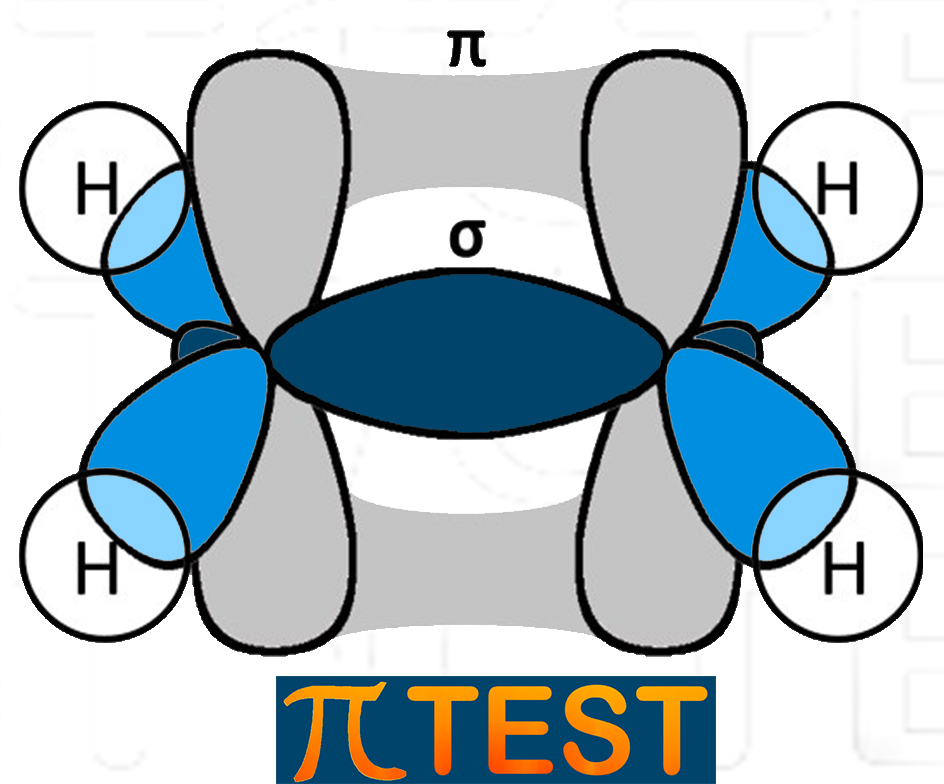
Nell’etene i due atomi di carbonio sono entrambi ibridati sp2. Tra i due atomi di carbonio c’è un doppio legame: il primo legame σ di forma tra due orbitali sp2 dei due atomi di carbonio coinvolti; il secondo legame π si forma tra i due orbitali p residui.
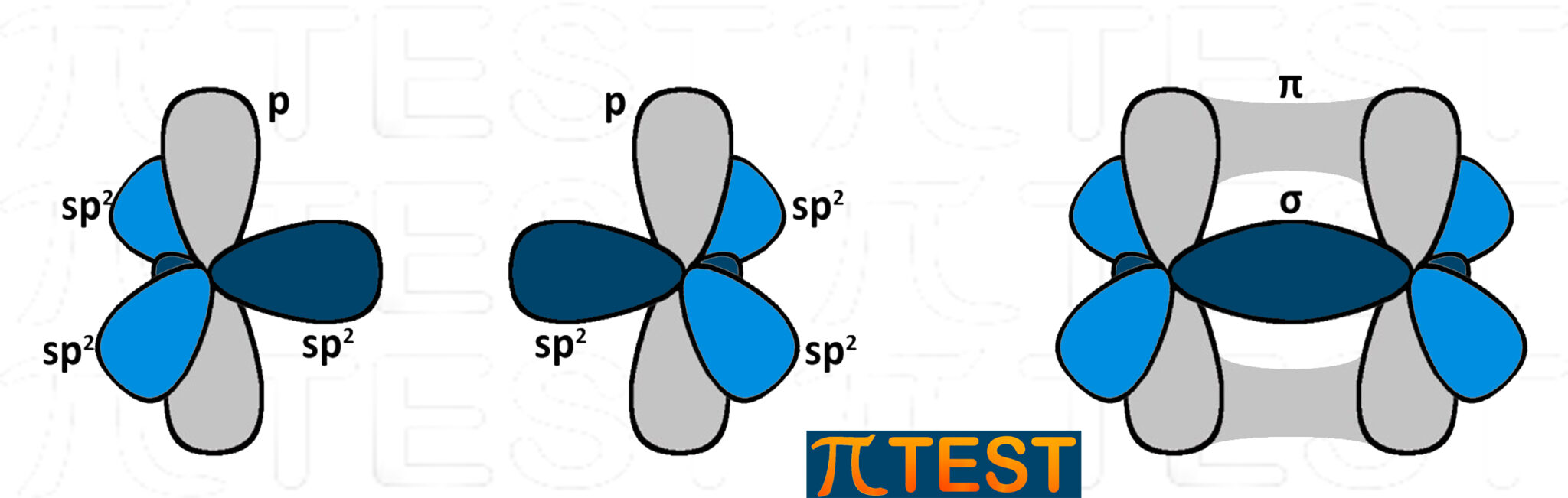 |
||
| I due atomi di carbonio con ibridazione sp2 presenti nell’etene | ||
 |
||
|
Struttura dell’etene C2H4 |
||
sp2 nel boro
Un’altra molecola che viene utilizzata come esempio di ibridazione sp2 è l’idruro di boro BH3.
Il boro B appartiene al terzo gruppo della tavola periodica e possiede solo tre elettroni nel guscio di valenza che possono dar luogo ad ibridazione sp2. La differenza rispetto al carbonio consiste nel fatto che il boro ha un elettrone di meno e di conseguenza l’orbitale p residuo non possiede alcun elettrone.
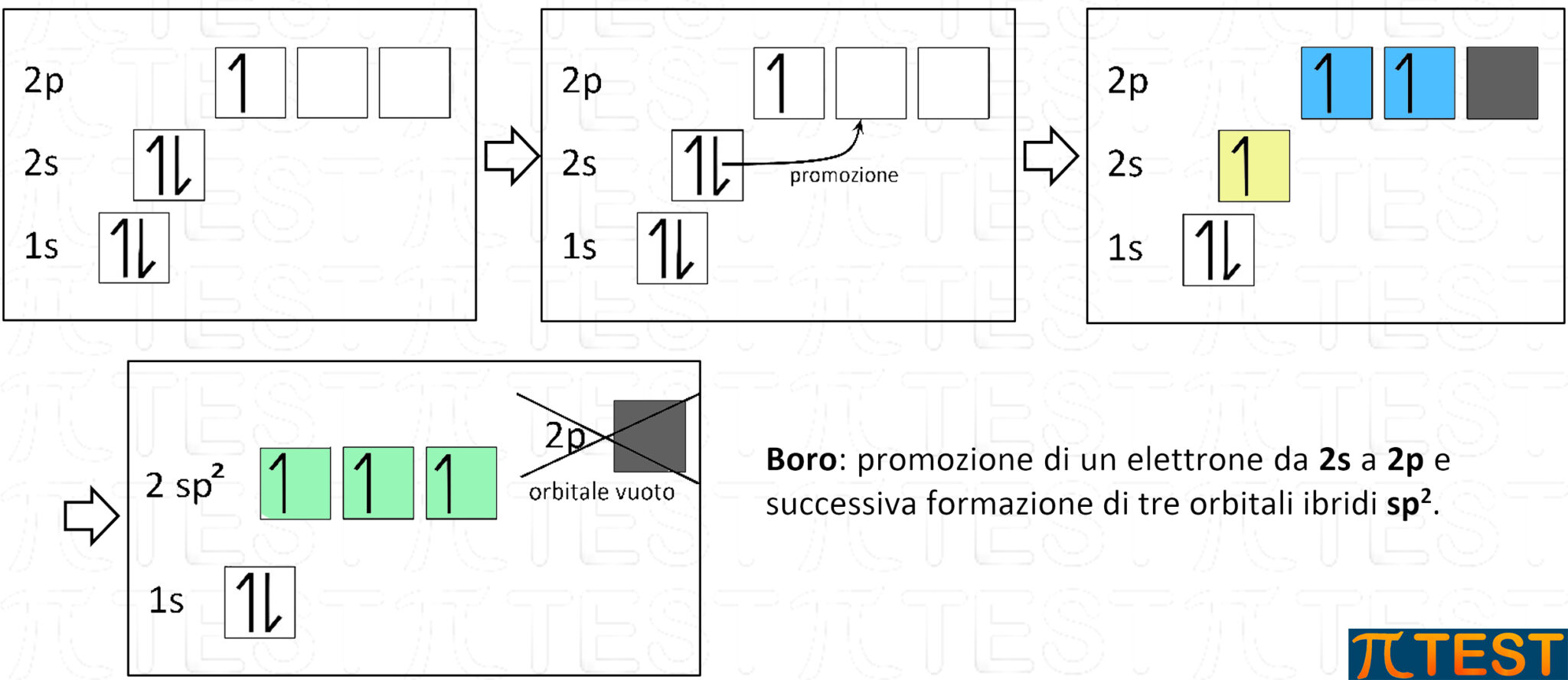
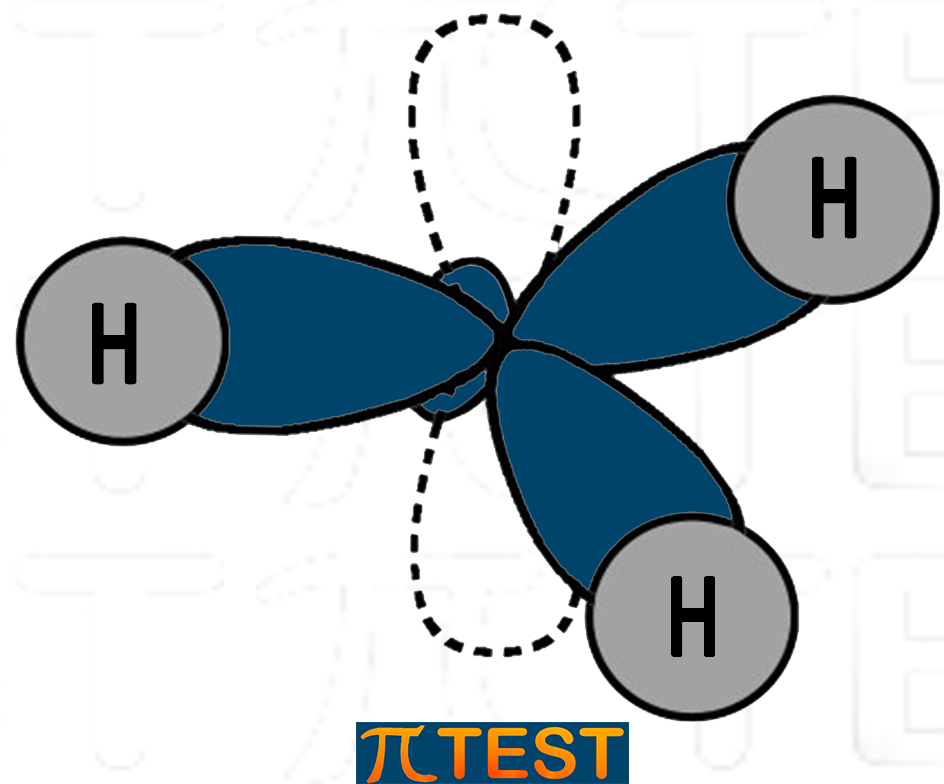
Il boro con l’ibridazione sp2 formerà l’idruro di boro che è una tipica molecola con geometria trigonale piana.
 |
||
|
Idruro di boro BH3 (l’orbitale p è disegnato tratteggiato, ma è privo di elettroni e non occupa spazio) |
||
4.5.5 Ibridazione sp
sp nel carbonio
Facciamo ancora riferimento al carbonio. È anche possibile che avvenga l’ibridazione tra l’orbitale s e uno solo degli orbitali p che si trasformano in due nuovi orbitali che prendono il nome sp.
I due orbitali p residui, che non hanno preso parte all’ibridazione, rimangono nella forma originaria.
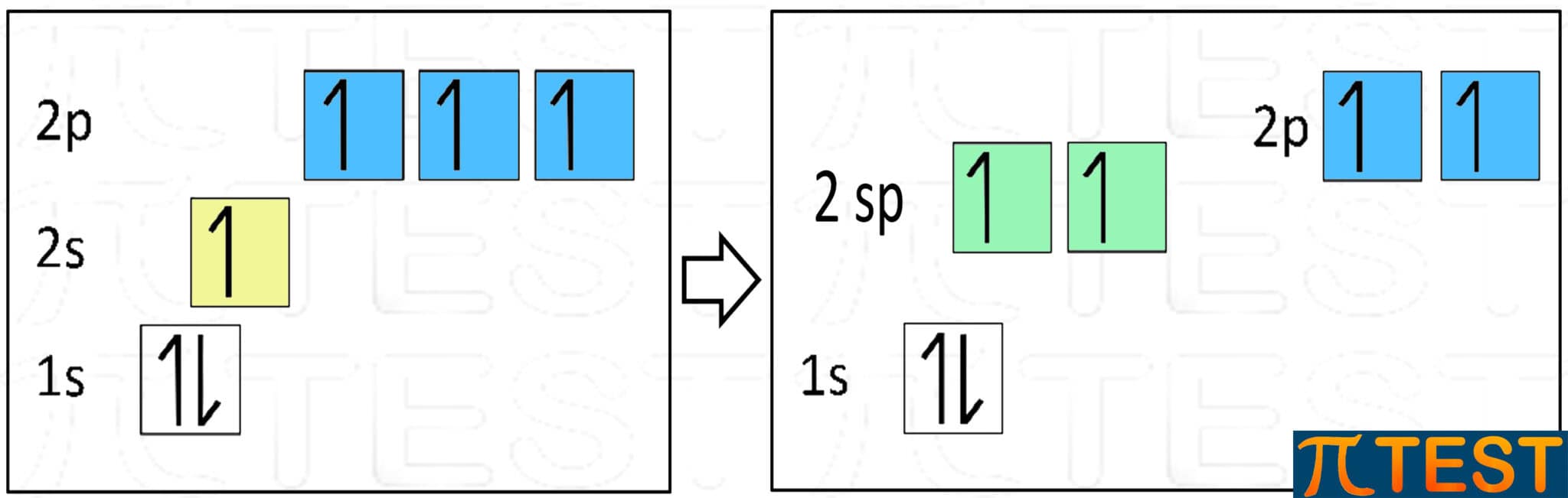
I due orbitali sp hanno una forma allungata ibrida che conserva le caratteristiche geometriche dell’orbitale s e dell’orbitale p. In base alla teoria VSEPR gli orbitali sp trovano una distribuzione spaziale che soddisfi il principio di repulsione e si direzionano in modo contrapposto formando un angolo di 180°. La forma è anche detta lineare.
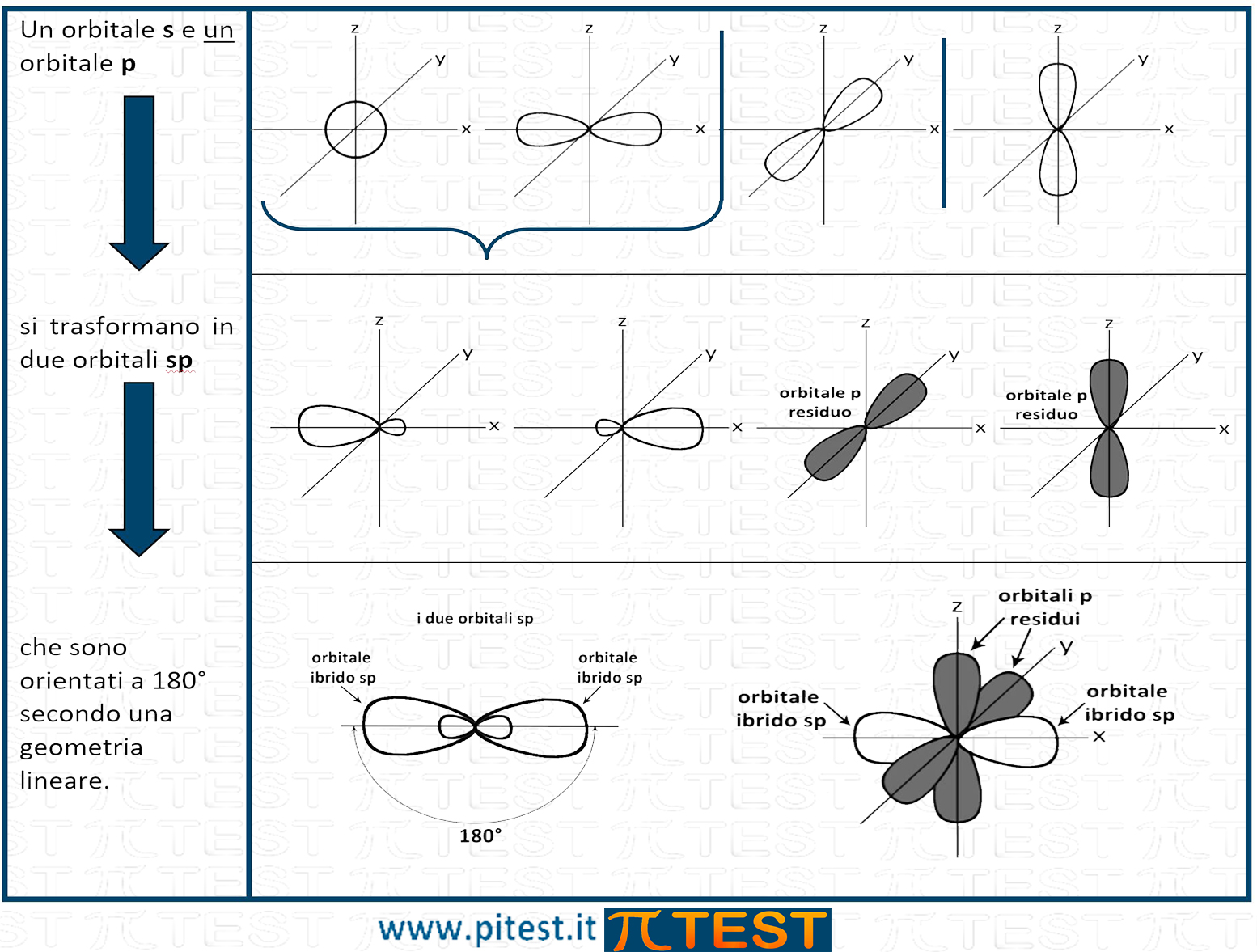 La molecola che tipicamente si utilizza per rappresentare l’ibridazione sp del carbonio è quella dell’etino (o acetiletilene) CH≡CH.
La molecola che tipicamente si utilizza per rappresentare l’ibridazione sp del carbonio è quella dell’etino (o acetiletilene) CH≡CH.
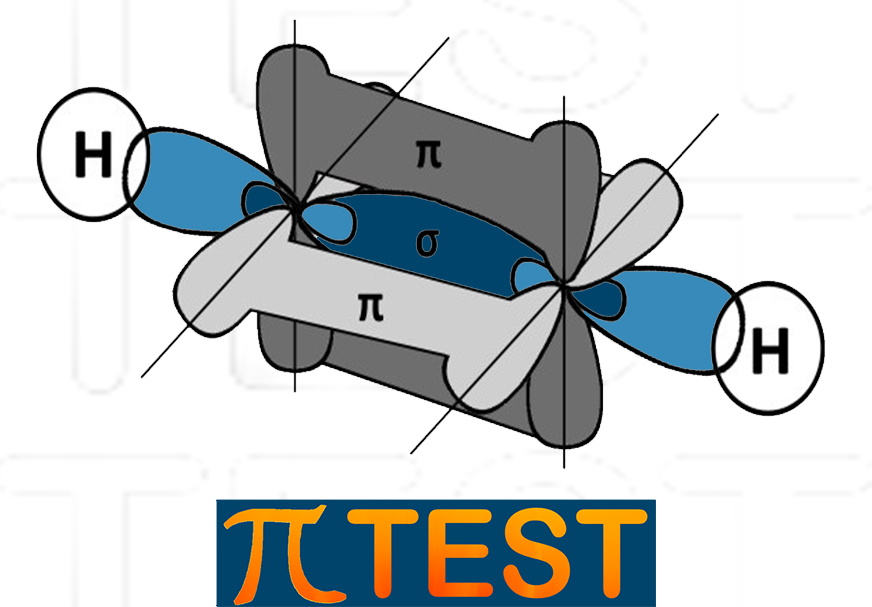
Nell’etino i due atomi di carbonio sono entrambi ibridati sp. Tra i due atomi di carbonio c’è un triplo legame: il primo legame σ di forma tra sue orbitali sp dei due atomi di carbonio coinvolti; il secondo ed il terzo legame π si formano tra le due coppie di orbitali p residui.
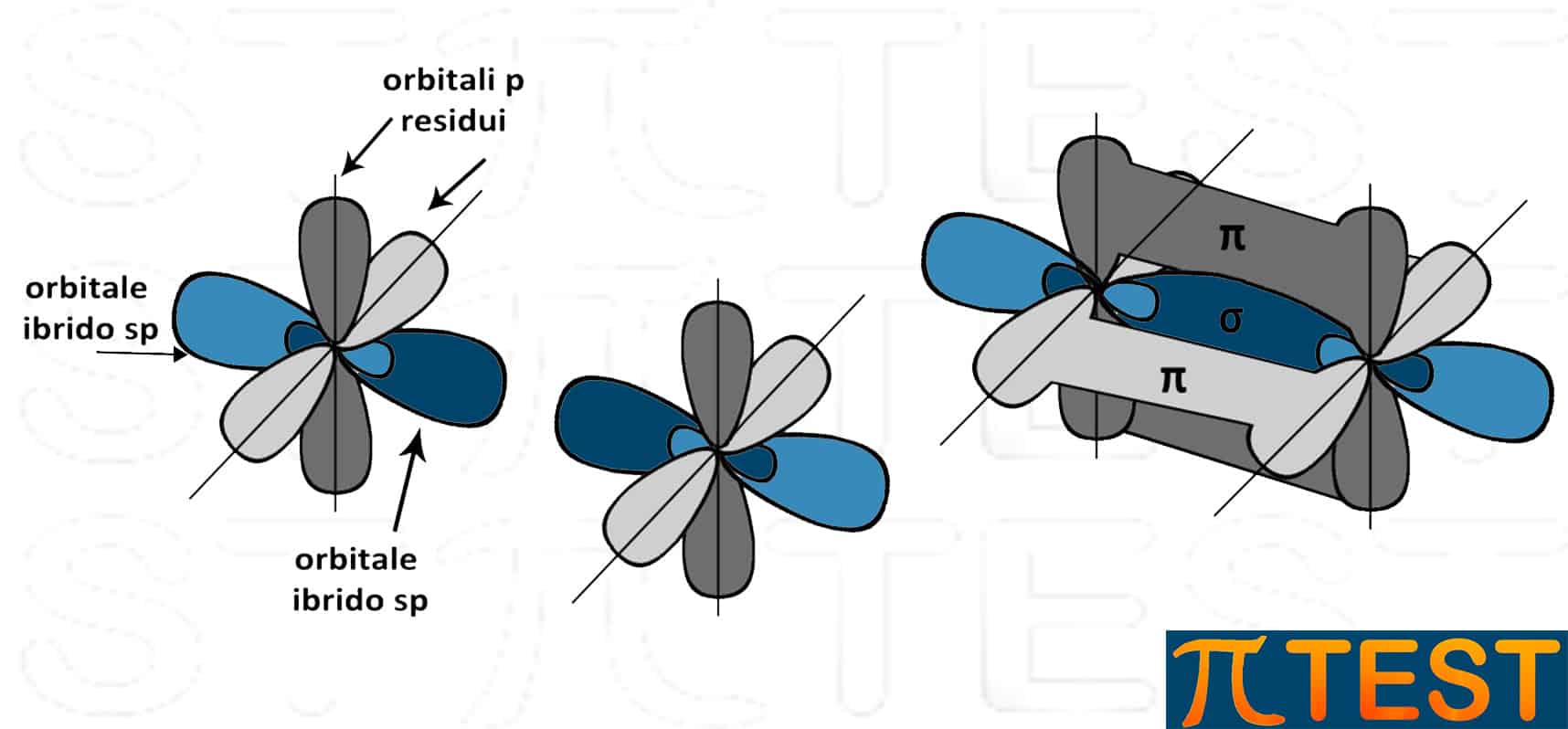 |
||
| I due atomi di carbonio con ibridazione sp presenti nell’etino | ||
 |
||
|
Struttura dell’etino C2H2 |
||
sp nel berillio Be
Viene utilizzato come esempio di ibridazione sp l’idruro di berillio BeH2.
Il berillio Be appartiene al secondo gruppo della tavola periodica e possiede solo due elettroni nel guscio di valenza che possono dar luogo ad ibridazione sp. Negli orbitali p residui non è presente alcun elettrone.
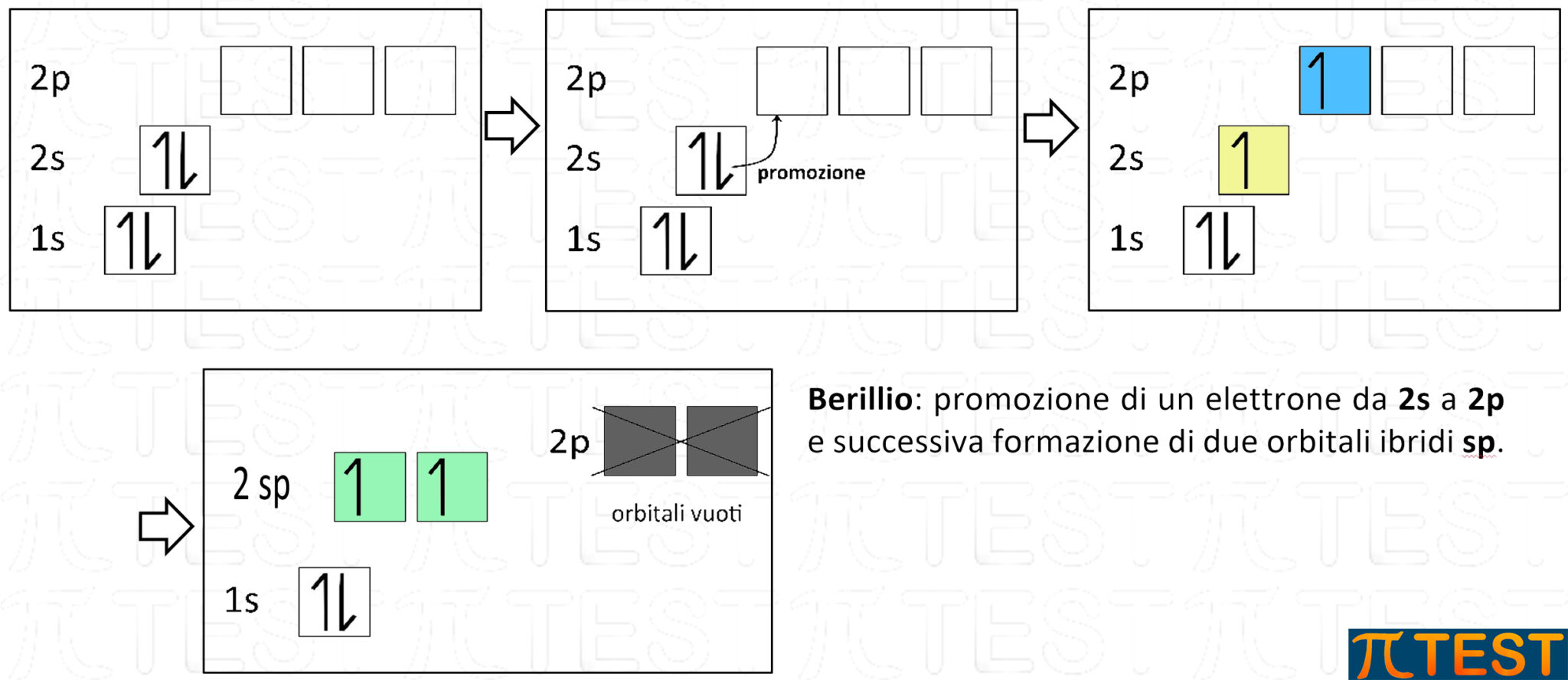 Il berillio con l’ibridazione sp formerà l’idruro di berillio che è una tipica molecola con geometria lineare.
Il berillio con l’ibridazione sp formerà l’idruro di berillio che è una tipica molecola con geometria lineare.
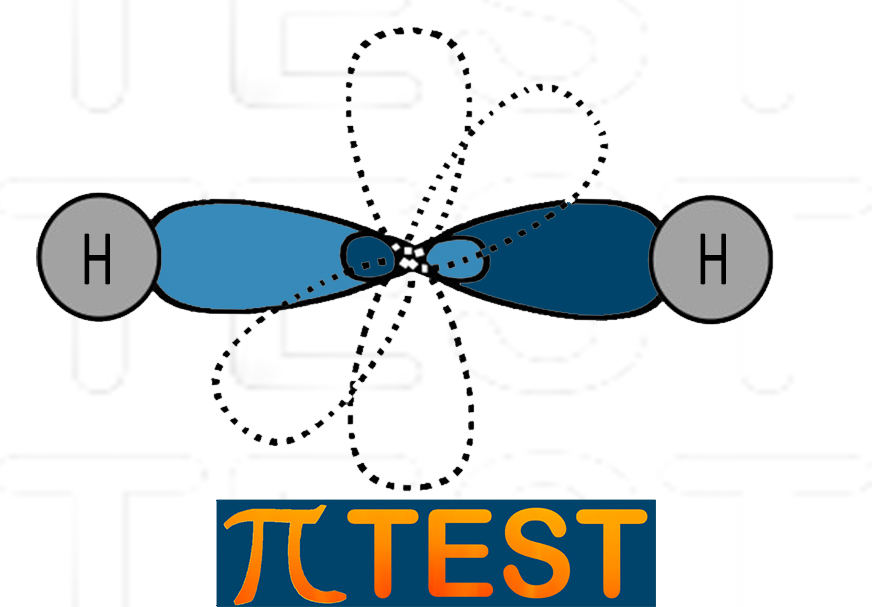 |
||
|
Idruro di berillio BeH2 (Gli orbitali p vengono disegnati tratteggiati, ma non possiedono elettroni e non occupano alcuno spazio) |
||
4.5.6 Altre ibridazioni
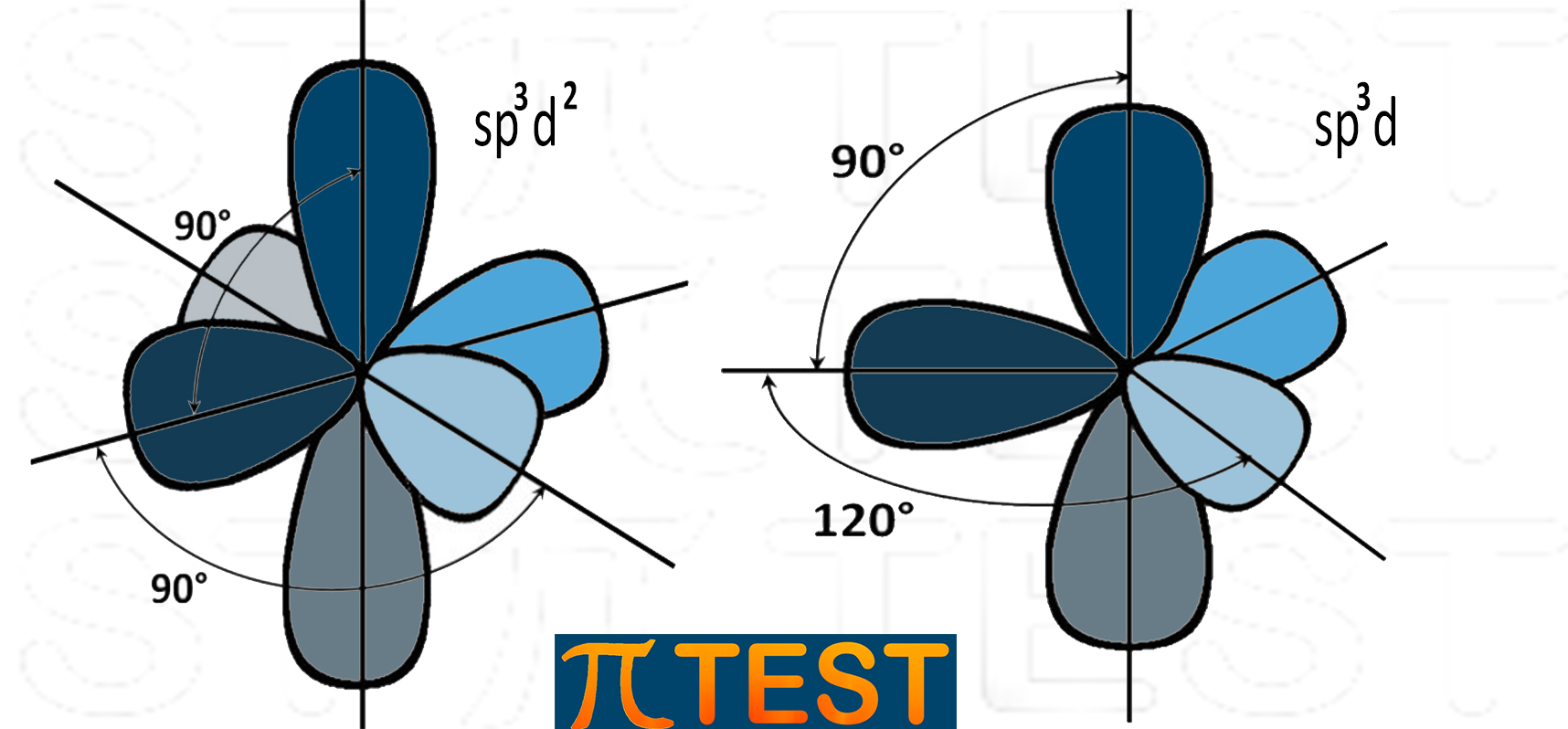 |
Oltre alle ibridazioni sp3, sp2 e sp esistono anche altre ibridazioni che coinvolgono anche gli orbitali di tipo d. Sono le ibridazioni sp3d e sp3d2 che corrispondono alle geometrie trigonale-bipiramidale e ottaedrica. Non sono però mai state richieste nei quiz dei test di ammissione ad eccezione di un quiz che faceva riferimento a queste ibridazioni senza però nominarle – quiz 48 Medicina 2020 e quiz 47 Medicina 2020 (indirettamente nella risposta C).
© il testo è di esclusiva proprietà dell’autore ed è sottoposto a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito
QUIZ Ibridazione degli orbitali |
|||
|---|---|---|---|