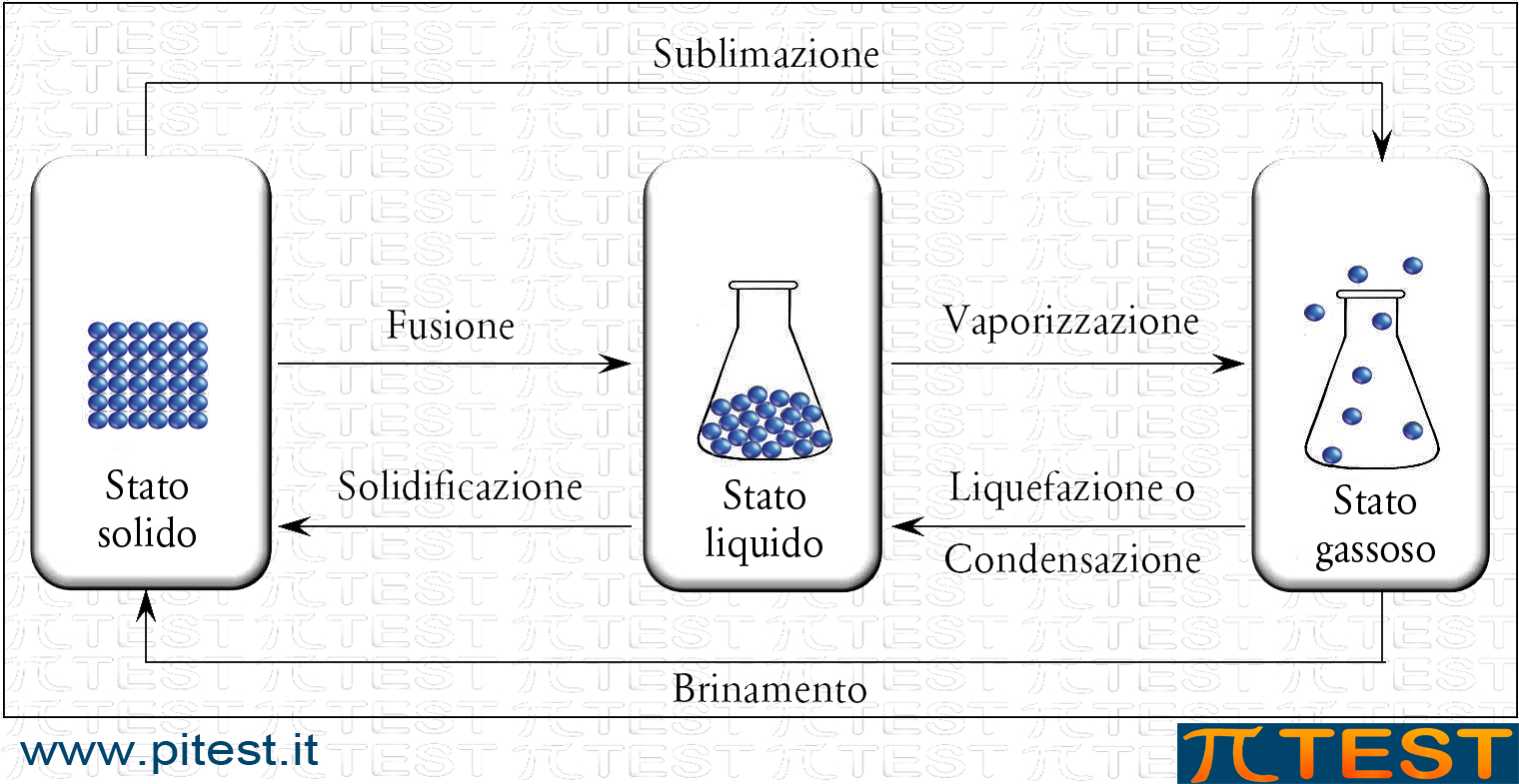
1.3 Gli stati di aggregazione
Gli stati di aggregazione della materia sono:
| Solido | volume proprio (incomprimibile), forma propria. |
| Liquido | Volume proprio (incomprimibile), non possiede forma. |
| Aeriforme (o gassoso) | Volume che dipende dalla pressione, non possiede forma. |
1.3.1 I passaggi di stato
Possono avvenire trasformazioni (fisiche) tra tutti gli stati di aggregazione. Il lessico specifico va conosciuto.
| ! | Si ponga attenzione ai termini brinamento e sublimazione, di uso meno frequente nel parlare ma possibili nei quiz. |
Un esempio di brinamento si ha quando nelle notti invernali il vapore acqueo dell’atmosfera raggiunge temperature inferiori agli 0°C. Le molecole di vapore si depositano sulle superfici (per esempio cruscotto delle automobili) già nello stato solido senza passare per lo stato liquido. Si usa infatti dire che si è formata la brina.
Anche nel formarsi dei fiocchi di neve avviene lo stesso fenomeno. Per le particolari proprietà delle molecole d’acqua che formano “legami a ponte idrogeno” (vedi) il fiocco di neve assume la sua caratteristica forma stellata.
Un classico esempio di sublimazione, possibile nei quiz, si verifica per la naftalina (o naftalene, C10H8, un composto aromatico policiclico – vedi) che ha la caratteristica di sublimare. È stato diffusissimo il suo uso domestico nel passato come prodotto antitarme. Una o più sferette di naftalina venivano messe dentro gli armadi; la naftalina sublimava e i suoi vapori dal forte odore aromatico proteggevano gli abiti dall’attacco dei parassiti; dopo un certo numero di mesi le palline di naftalina si riducevano di volume per la sublimazione e andavano sostituite [si è poi scoperto che la naftalina è cancerogena ed è stata sostituita dalla canfora].
Un altro esempio di sublimazione si verifica nel ghiaccio dei ghiacciai ad alta quota dove il vento lambisce il ghiaccio asportandone, per sublimazione, le molecole superficiali. Il ghiaccio assume così conformazioni particolari a volte esteticamente molto belle.
Curva di riscaldamento
Consideriamo il passaggio dallo stato che inizia dallo stato solido ed arriva progressivamente allo stato di vapore. Facciamo, per semplicità, l’esempio di un cubetto di ghiaccio estratto da un surgelatore alla temperatura di ─20°C.
Immaginiamo di fornire calore uniformemente nel tempo al nostro sistema costituito dal cubetto di ghiaccio. Rappresentiamo in un diagramma il variare della temperatura del sistema al passare del tempo. In ascissa rappresentiamo il tempo (oppure il calore fornito) ed in ordinata la temperatura.
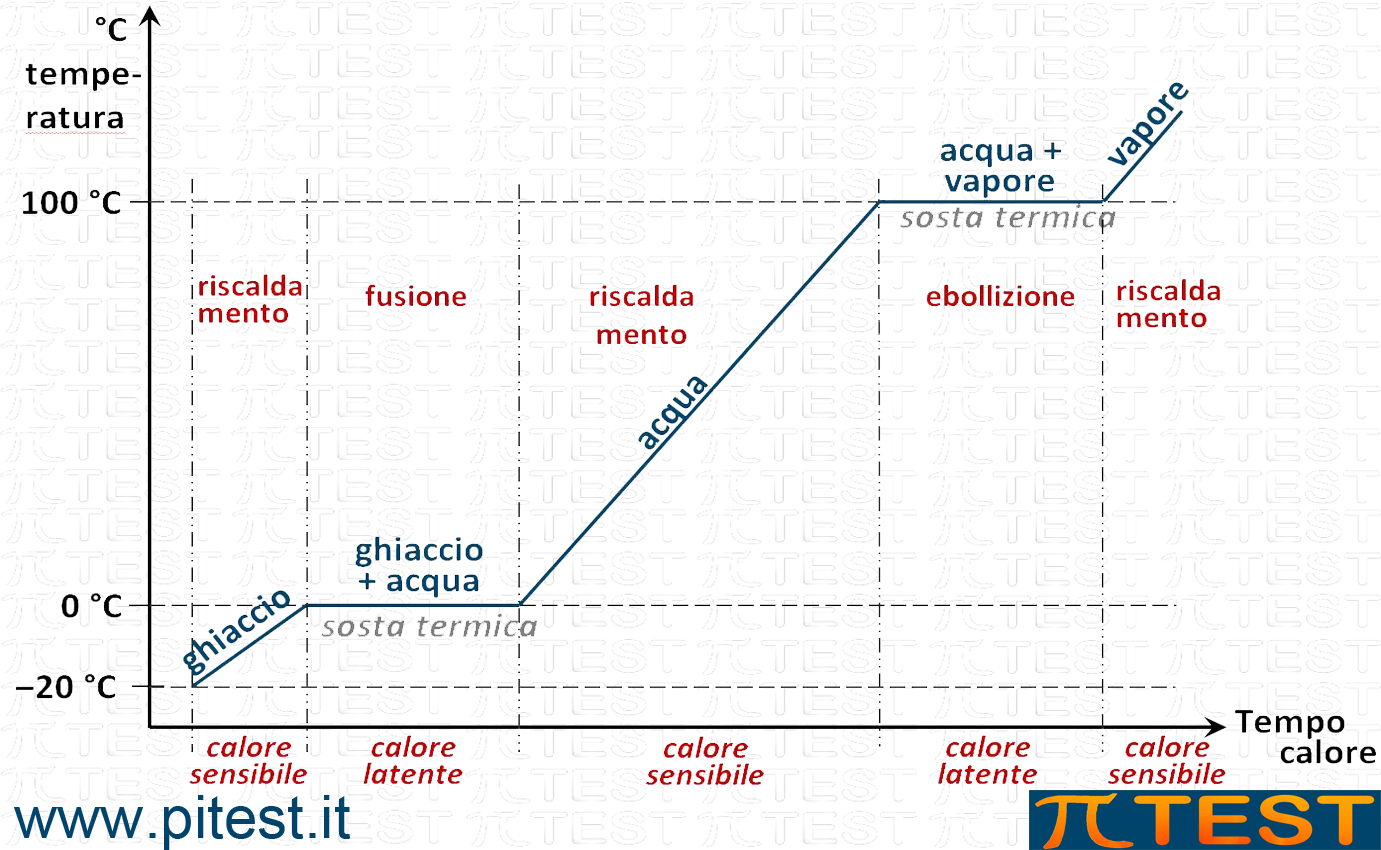
Il cubetto di ghiaccio, inizialmente alla temperatura di ─20°C si riscalda fino alla temperatura di 0°C, detta temperatura di fusione o punto di fusione. Poiché l’effetto del calore fornito è visibile in un termometro che misura la temperatura del sistema, lo chiamiamo calore sensibile.
Da questo momento il ghiaccio fonde e tutto il calore che assorbe serve alla fusione e non all’innalzamento della temperatura che si mantiene costante. Questo fenomeno è detto sosta termica.
Quando tutto il ghiaccio si sarà disciolto e il sistema sarà formato solo da acqua, la temperatura riprenderà a salire fino alla temperatura di ebollizione di 100°C. Durante questa fase di riscaldamento il calore è detto calore sensibile. Abbiamo adesso una nuova sosta termica alla temperatura di ebollizione (detta anche punto di ebollizione).
Soltanto quando tutta l’acqua sarà evaporata per ebollizione si potrà riscaldare il sistema composto ora da solo vapore. Nel lessico specifico si parla di vapore surriscaldato.
1.3.2 Evaporazione ed ebollizione
Anche se le molecole presenti sulla superficie di un liquido hanno un valore medio della propria energia cinetica insufficiente a farle distaccare, a livello microscopico abbiamo una distribuzione statistica di valori di energia con molecole meno energetiche ed altre più energetiche che riescono a distaccarsi dalla fase liquida (volano via).
Al di sopra del liquido si forma una quantità di vapore che possiede una sua pressione detta pressione di vapore o tensione di vapore.
| Per comprendere il fenomeno possiamo immaginare un recipiente inizialmente vuoto e senza aria e vi inseriamo un liquido senza riempirlo completamente. Dopo un certo tempo il volume non occupato dal liquido conterrà una quantità di vapore ed avrà una sua pressione. |  |
La tensione (pressione) di vapore aumenta all’aumentare della temperatura.
Immaginiamo una fase liquida a cielo aperto, cioè in presenza di aria esterna e quindi sottoposta a pressione atmosferica. Arrivati ad una certa temperatura la pressione di vapore avrà un valore pari alla pressione atmosferica e si potranno formare bolle di vapore al di sotto della superficie del liquido in quanto avranno pressione sufficiente per non essere rischiacciate e richiuse dalla pressione esterna. Le bolle di vapore risalgono rapidamente verso l’alto. L’evaporazione a questo punto diventa più violenta e prende il nome di ebollizione. La temperatura alla quale avviene questo fenomeno prende il nome di temperatura di ebollizione o punto di ebollizione.
Un caso sul quale porre attenzione si ha per l’ebollizione dell’acqua quando la pressione esterna varia. In alta montagna la pressione atmosferica è sensibilmente più bassa rispetto al livello del mare e di conseguenza la temperatura di ebollizione è più bassa; la cottura dei cibi ne risente perché è possibile che non avvengano le desiderate trasformazioni chimiche. Al contrario quando viene imposta una pressione maggiore come all’interno di una pentola a pressione, la temperatura di ebollizione si alza determinando una maggior velocità di cottura dei cibi.
Il punto di ebollizione viene utilizzato come un indicatore della volatilità dei liquidi. Ad esempio l’acqua ha teb di 100°C, mentre l’alcol etilico ha teb di 78°C ed è perciò più volatile dell’acqua.
La pressione di vapore di un solvente può variare in presenza di un soluto.
| ! | Si ponga attenzione al termine vaporizzazione che è generico. Si parla di evaporazione quando avviene ad una temperatura inferiore a quella di ebollizione, altrimenti si parla di ebollizione. |
1.3.3 Punto triplo
Anche la fase solida, come la liquida può trasferirsi alla fase aeriforme per sublimazione. Esiste un particolare valore di temperatura e pressione ai quali sia la fase liquida che la solida possiedono la stessa pressione di vapore; questa condizione viene detta punto triplo. Al punto triplo coesistono in equilibrio i tre stati di aggregazione solido, liquido ed aeriforme. Per l’acqua vale +0,01°C e 0,006 atm.
1.3.4 Gas e vapore
Un aeriforme, genericamente chiamato gas, a volte è composto dai vapori di un liquido e lo chiamiamo più propriamente vapore. Per distinguere rigorosamente un gas da un vapore facciamo riferimento alla temperatura critica che è la temperatura al di sopra della quale un vapore non può mai essere condensato.
L’acqua ha una temperatura critica di 374°C. Alla pressione di 1 atm la sua fase aeriforme viene chiamata vapore tra 100°C e 374°C; al di sopra è un gas. Mentre l’ossigeno O2 ha una temperatura critica di -118°C e nelle condizioni di temperature normali viene considerato sempre un gas.
QUIZ 1.3 Gli stati di aggregazione |
|||
|---|---|---|---|
© il testo è di esclusiva proprietà dell’autore ed è sottoposto a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito