10.1 Idrocarburi
Iniziamo a studiare le catene di atomi di carbonio legati tra di loro e al solo idrogeno, gli IDROCARBURI, per poi passare a composti più complessi nei quali il carbonio si lega ad ossigeno e azoto e ad altri elementi.
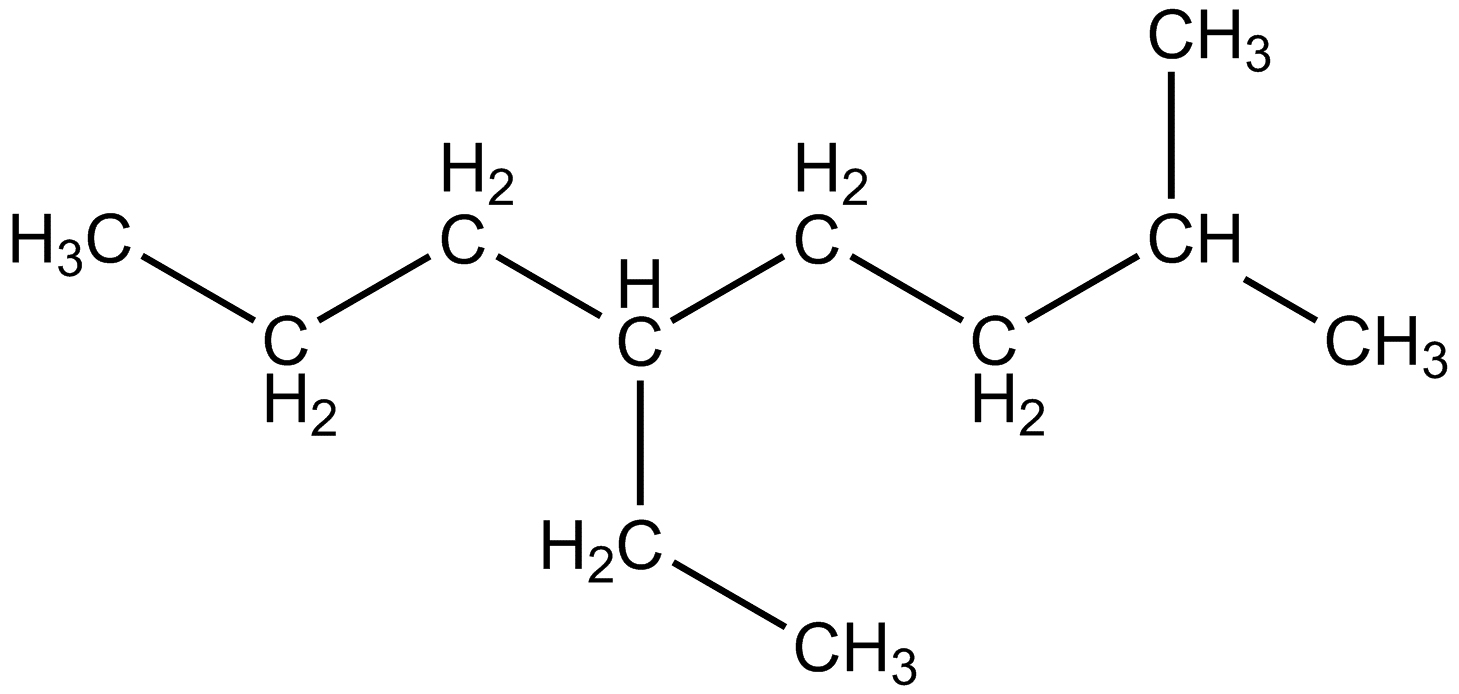 |
Tipica catena di atomi di carbonio |
Le catene di atomi di carbonio possono essere aperte o chiuse, lineari o ramificate.
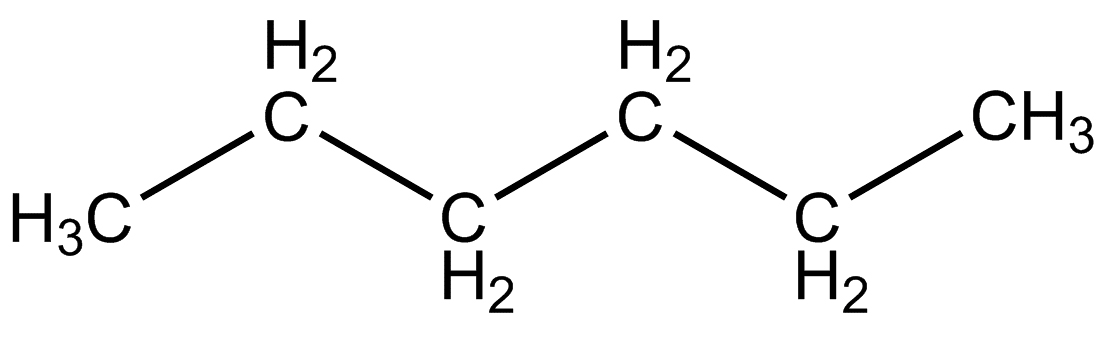 |
Catena lineare aperta |
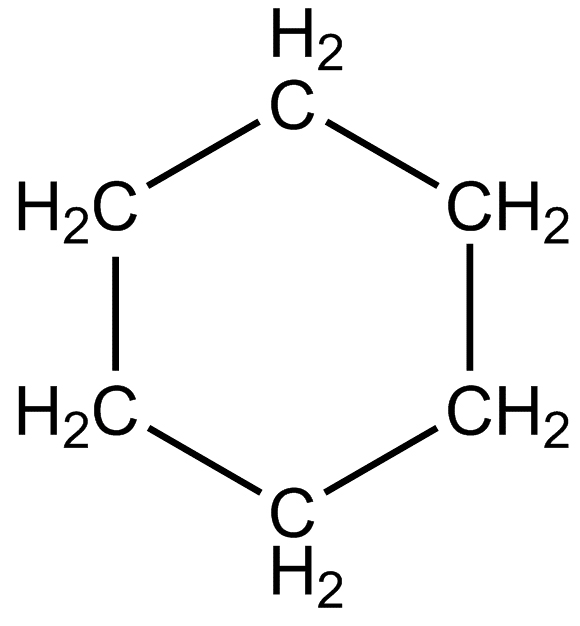 |
Catena chiusa |
 |
Catena ramificata |
Esiste una gran varietà di idrocarburi che vengono classificati secondo questo schema di nomenclatura.
In questo schema evidenziamo alcune grandi distinzioni:
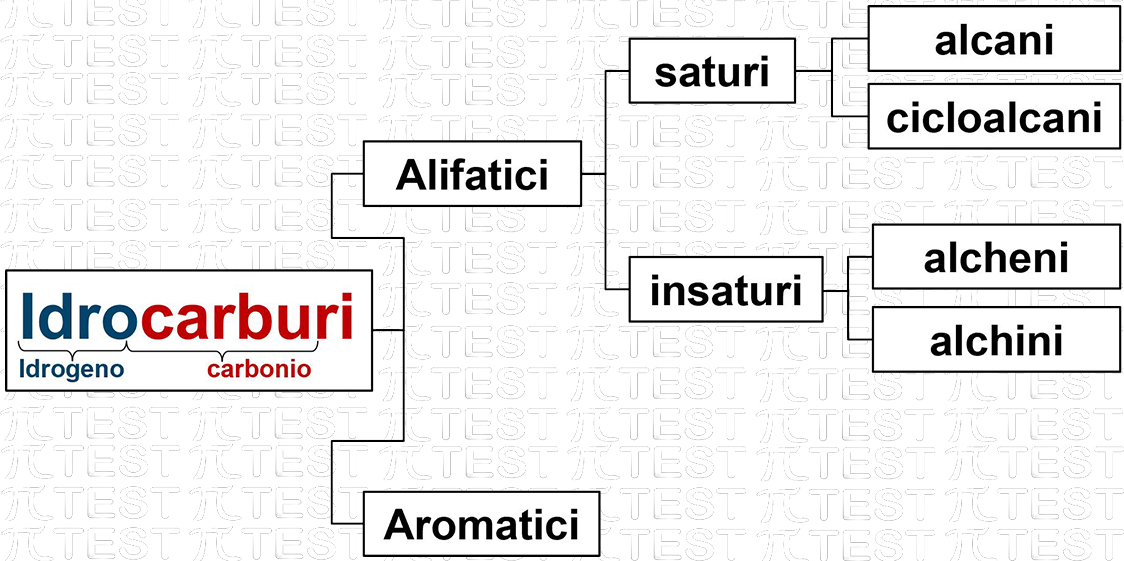 Alifatici – Aromatici
Alifatici – Aromatici
- Gli alifatici sono costituiti da catene di atomi di carbonio di svariati tipi.[1]
- Gli aromatici sono caratterizzati dalla presenza di uno o più anelli insaturi (vedremo nel dettaglio)
Note: [1] Il termine alifatico trae la sua etimologia dal greco ἄλειϕαρ (unguento) in quanto idrocarburi alifatici con un certo numero di atomi di carbonio hanno l’aspetto oleoso
10.2 Idrocarburi alifatici
All’interno degli idrocarburi alifatici distinguiamo quelli saturi da quelli insaturi. Il concetto di “saturo” fa riferimento al “massimo numero possibile di atomi di idrogeno presenti”. Il concetto “saturo” significa “completamente pieno di qualcosa”. In questo caso di atomi di idrogeno.
10.2.1 Idrocarburi alifatici saturi: gli ALCANI
Gli alcani sono idrocarburi nei quali TUTTI gli atomi di carbonio possiedono una ibridazione sp3 (vedi).
A seconda del numero degli atomi presenti il loro nome si forma da un prefisso che indica il numero di atomi di carbonio presenti e dal suffisso -ano.
Per il prefisso vale la seguente regola
| Numero di atomi di C | Prefisso | |
| 1 atomo di C | Met- | Met- Et- Prop- But- da ricordare |
| 2 atomi di C | Et- | |
| 3 atomi di C | Prop- | |
| 4 atomi di C | But- | |
| 5 atomi di C | Pent- | |
| 6 atomi di C | Es- | |
| 7 atomi di C | Ept- | |
| 8 atomi di C | Ott- | |
| Ecc. | Ecc. |
Il numero di atomi di idrogeno che si associano a quelli di carbonio seguono la regola 2n+2 dove n è il numero di atomi di C. La formula generale sarà perciò CnH2n+2
| CnH2n+2 | Alcano | |
| n=1 | CH4 | Metano |
| n=2 | C2H6 | Etano |
| n=3 | C3H8 | Propano |
| n=4 | C4H10 | Butano |
| n=5 | C5H12 | Pentano |
| n=6 | C6H14 | Esano |
| … | … | … |
Negli alcani tutti gli atomi di carbonio sono ibridati sp3 (vedi)
 |
Ibridazione sp3 |
Vediamo I PRIMI TRE ALCANI DELLA SERIE.
METANO CH4
Abbiamo numerosi modi di rappresentare graficamente il metano. La formula di struttura con i quattro legami a croce rappresenta su un piano la molecola. A volte si preferiscono altre rappresentazioni tridimensionali che ricordano meglio la forma della molecola.
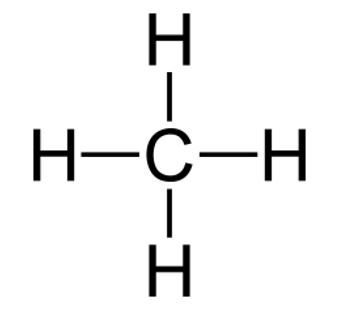
Formula di struttura |
|
ETANO C2H6
Come per il metano abbiamo la formula si struttura ed anche una rappresentazione tridimensionale.
|
|
|
|
Il legame semplice σ (sigma) tra i due atomi di carbonio permette la rotazione della molecola attorno al legame. Il carbonio di destra rispetto a quello di sinistra può ruotare insieme ai tre atomi di idrogeno a lui uniti.
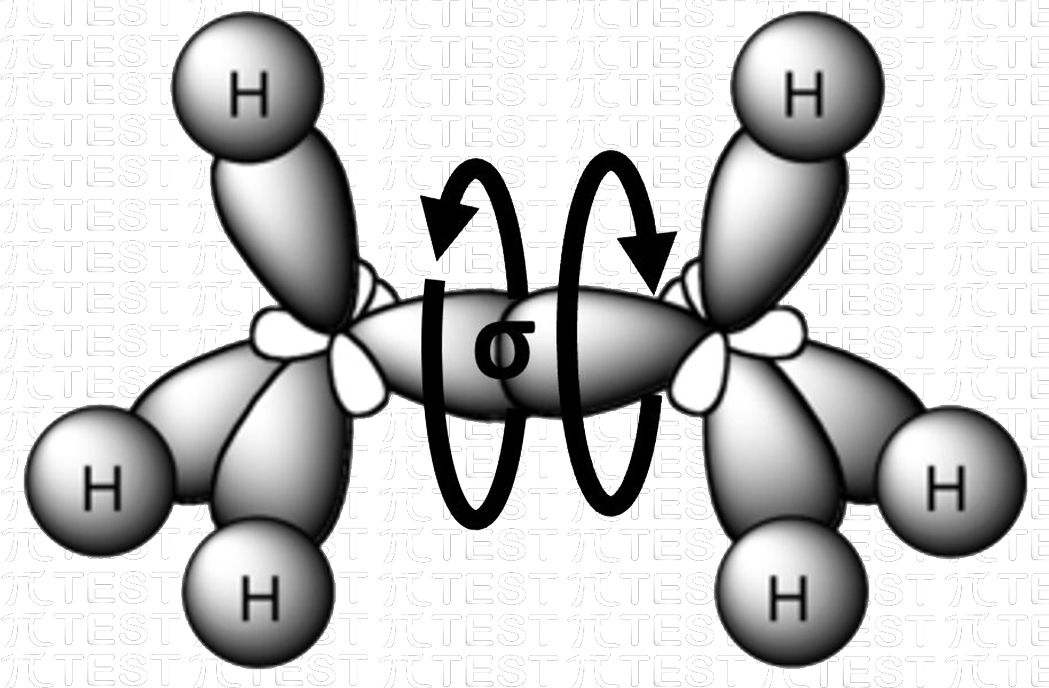 |
Possibilità di rotazione attorno al legame C−C |
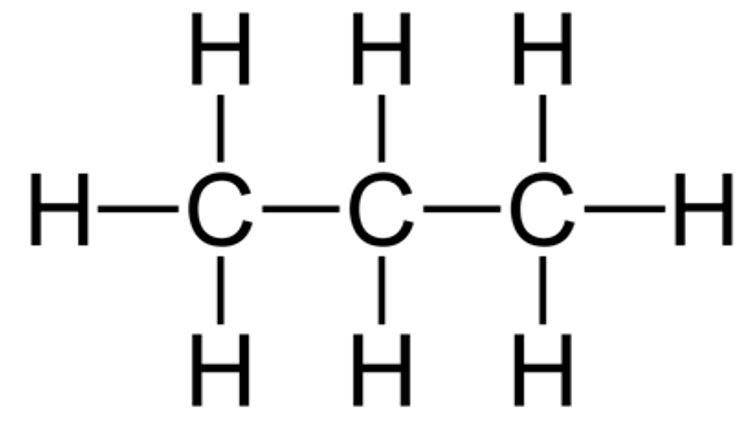
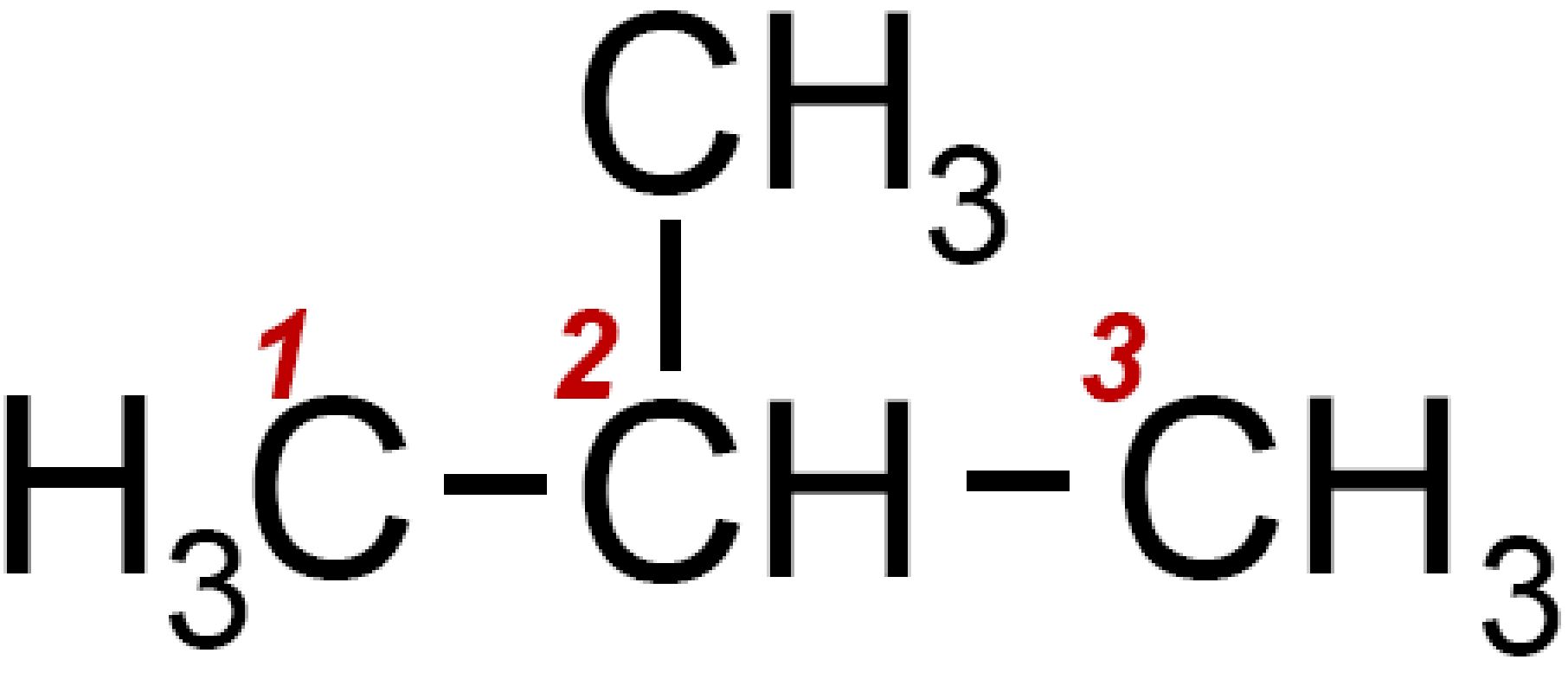
PROPANO C3H8
Come per il metano abbiamo la formula si struttura ed anche una rappresentazione tridimensionale.
|
|
|
|
La serie degli alcani continua senza interruzione all’aumentare del numero degli atomi di carbonio.
Le FORMULE con le quali si può rappresentare un idrocarburo sono le seguenti:
- la formula bruta che individua solo il numero totale di atomi presenti CnC2n+2.
- La formula di struttura che disegna con piccole linee tutti i legami esistenti e rappresenta in forma a croce i quattro legami degli atomi di carbonio.
- La formula di semistruttura che rappresenta la molecola in modo più coinciso
CH3−CH2−CH3
- La formula razionale o condensata che si utilizza per molecole lineari molto lunghe per poter abbreviare la lunghezza di scrittura. Per esempio nel n-decano (decano a struttura lineare) C10H22 al posto della formula di semistruttura:
CH3−CH2−CH2−CH2−CH2−CH2−CH2−CH2−CH2−CH3
possiamo avere la formula razionale:
CH3− (CH2)8−CH3
In questa seconda formula vediamo che gli otto atomi centrali di carbonio, legati ciascuno a due atomi di idrogeno, sono stati scritti in modo condensato.
- La formula semplificata che evita di scrivere gli atomi di idrogeno presenti, i quali sono comunque ricavabili dalla regola che ogni atomo di carbonio deve avere quattro legami. La formula semplificata riporta solo uno scheletro delle molecole dove gli atomi di carbonio si trovano agli estremi dei segmenti.
Per esempio consideriamo il 2,3 di metil pentano che studiamo nel seguente paragrafo 1.1.3.
La sua molecola può essere rappresentata con la formula di struttura seguente:
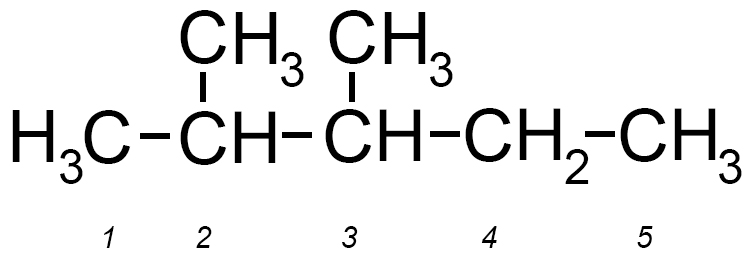
E può anche essere rappresentato dalla seguente formula semplificata:
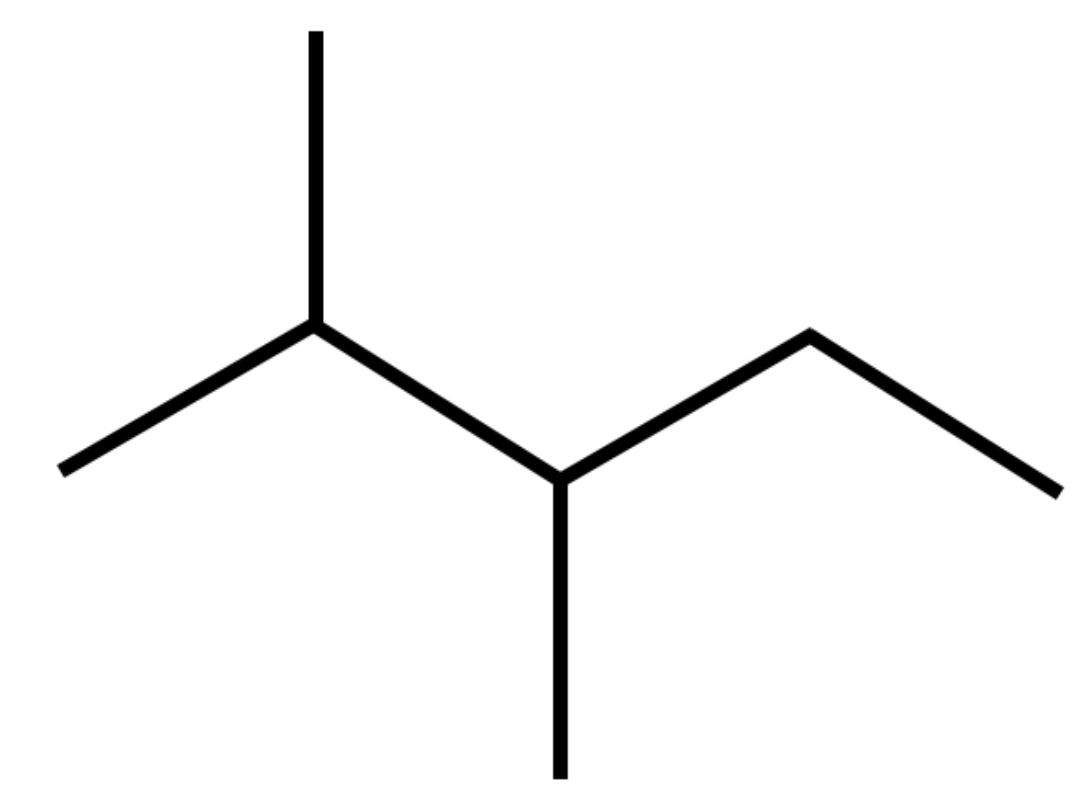 Formula semplificata Formula semplificata |
|
L’angolo che risulta tra segmenti contigui nel disegno delle formule semplificate ricorda (anche se non con precisione) l’angolo di legame di 109,5° delle ibridazioni sp3.
10.2.2 Radicali alchilici
Per poter creare la nomenclatura degli idrocarburi ramificati diamo un nome ai tratti incompleti di catena che chiamiamo radicali.
Se in una catena lineare di cinque atomi di carbonio (pentano) troviamo al posto in un atomo di idrogeno una ramificazione composta da un solo atomo di carbonio legato ad altri tre atomi di idrogeni, cioè −CH3, chiameremo questo tratto metile in quanto lo immaginiamo derivante idealmente dal metano CH4.
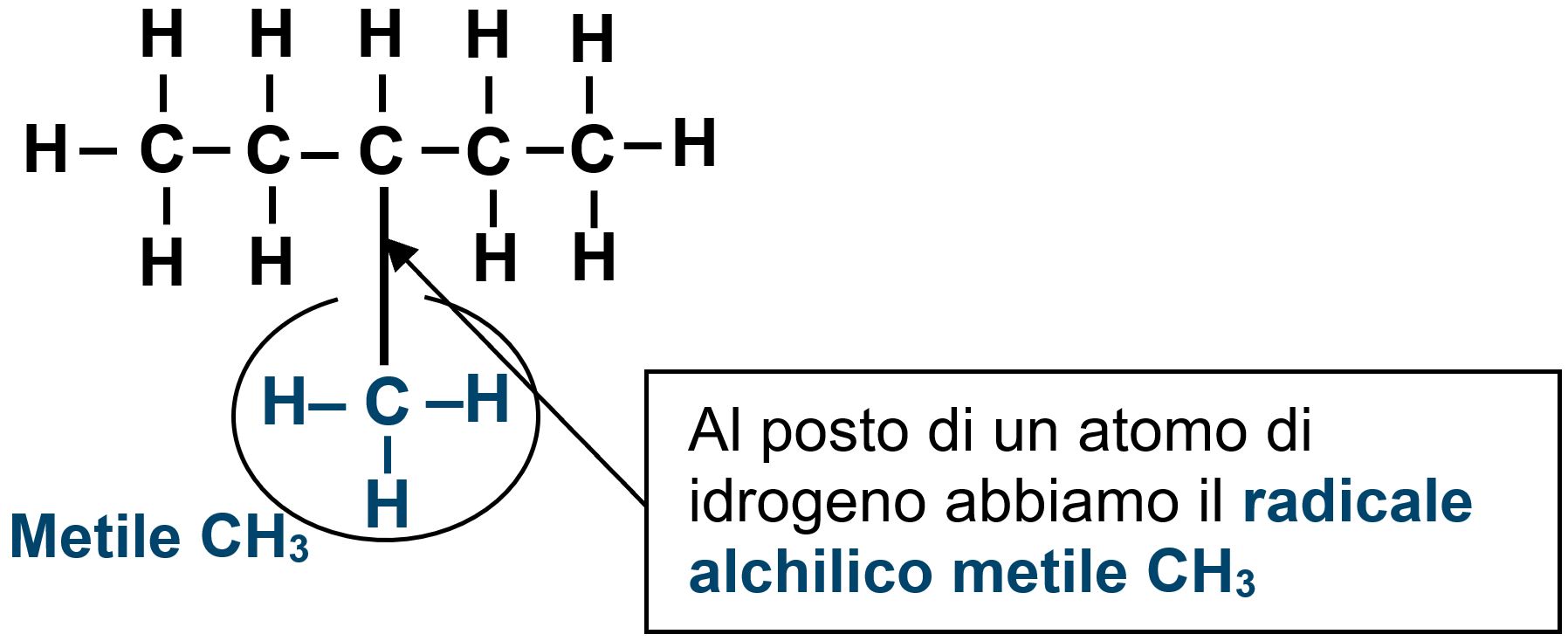
Possiamo rappresentare la stessa struttura con questa scrittura:
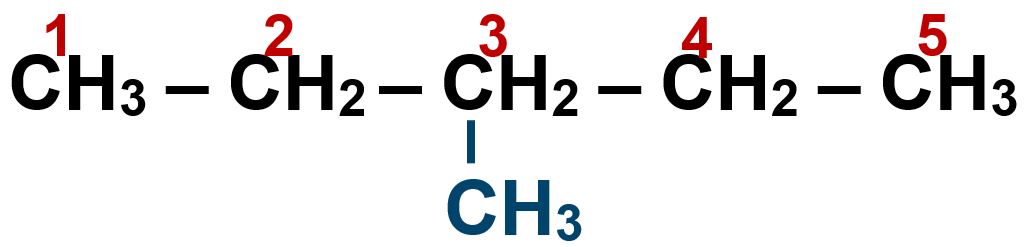
Il nome di questa molecola prende il nome dalla ramificazione laterale costituita dal metile che parte dal terzo atomo di carbonio (carbonio 3) del pentano:
3 metil-pentano
Il metile è il più piccolo dei radicali esistenti:
| metile | −CH3 |
| etile | −C2H5 |
| propile | −C3H7 |
| butile | −C4H9 |
| pentile | −C5H11 |
| … | … |
10.2.3 Idrocarburi ramificati
Utilizziamo la nomenclatura dei radicali appena detta per dare un nome univocamente determinato degli idrocarburi ramificati. Vediamo alcuni esempi.
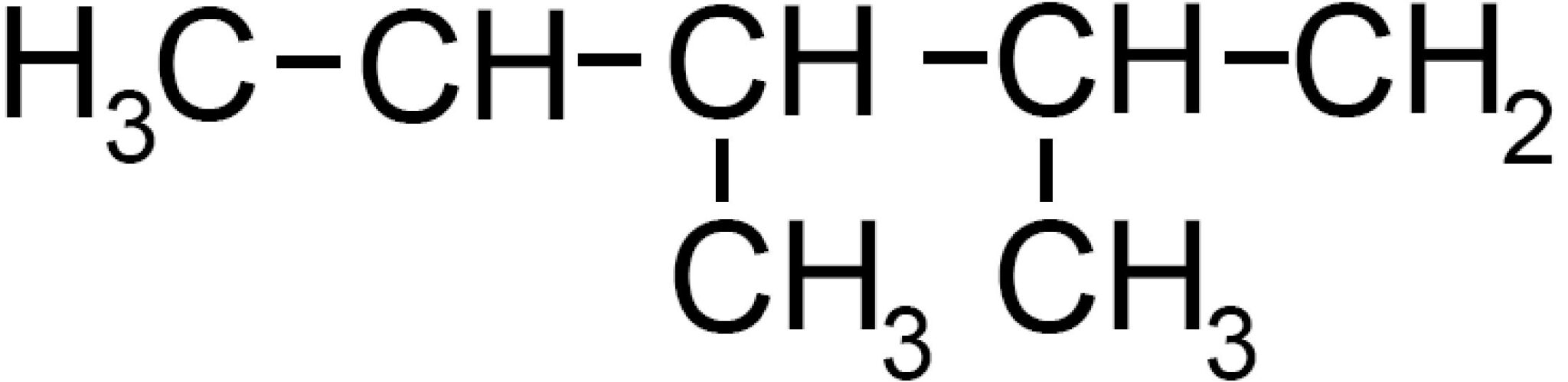
Davanti a questa struttura ramificata dobbiamo individuare una catena lineare che sia la più lunga possibile. Nel nostro caso individuiamo una catena di cinque atomi di carboni che numeriamo da 1 a 5.
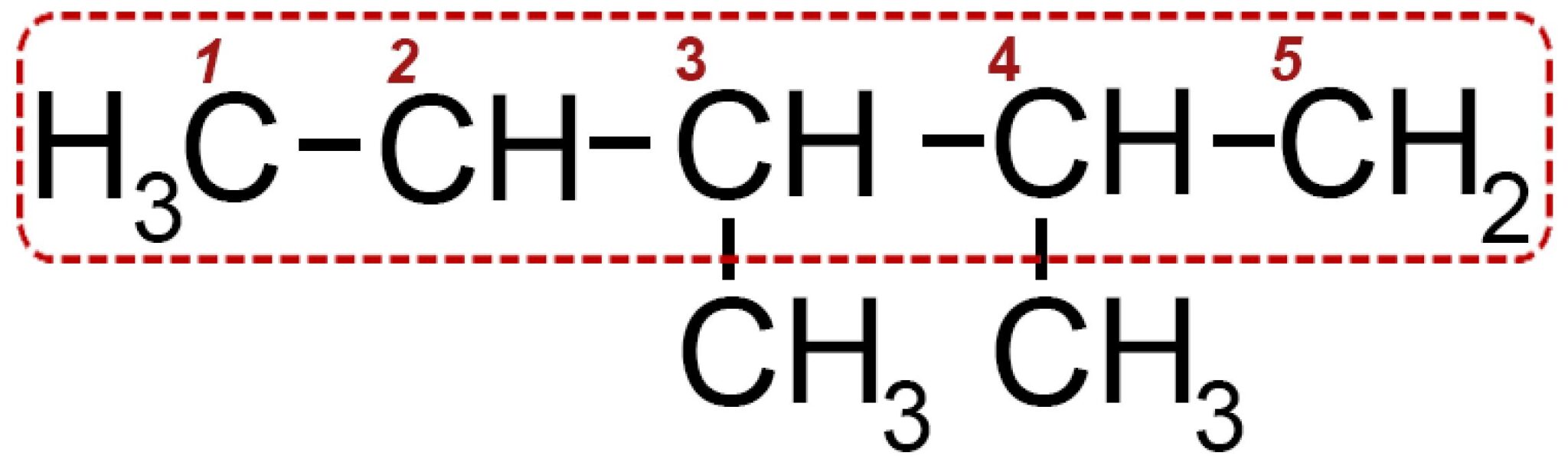
Nel carbonio 2 e nel carbonio 3 individuiamo la presenza di due radicali metile −CH3.
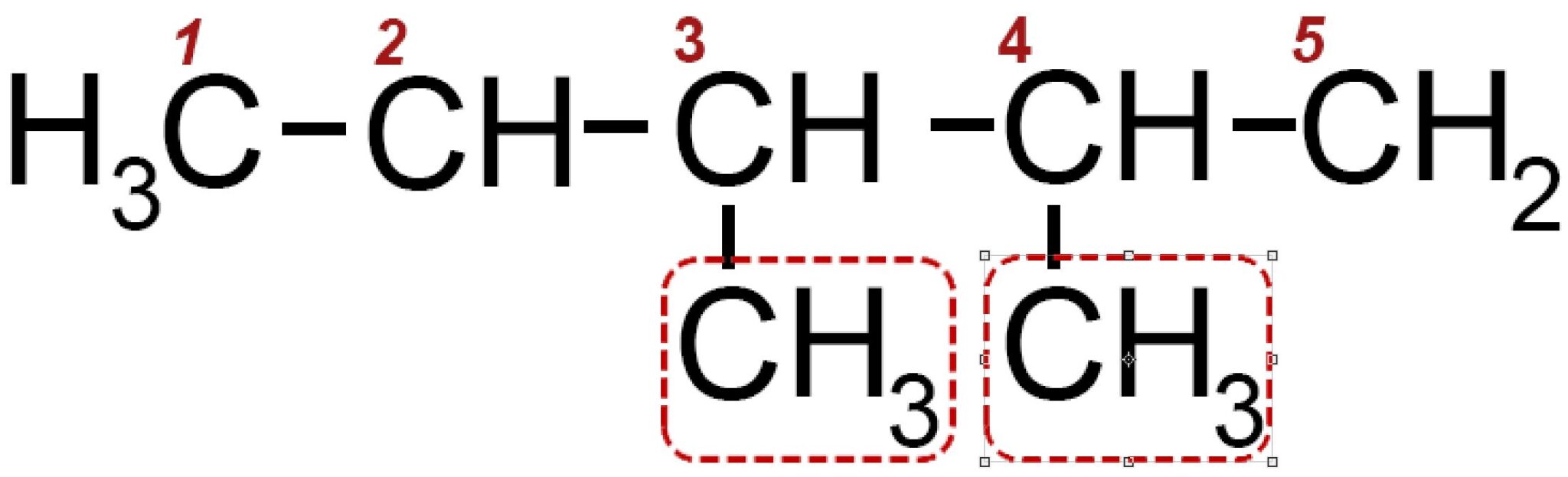
Il nome della molecola è 2,3 di_metil_pentano e in generale la molecola è una delle possibili forme dell’eptano perché possiede in tutto sette atomi di carbonio. All’interno del nome la parte “di_metil” indica due volte il metile.
Dicendo “una possibile forma” stiamo introducendo il concetto di isomeria, cioè la possibilità di avere diverse varianti della stessa formula bruta. Il 2,3 dimetilpentano è cosi un isomero di catena dell’eptano C7H16.
Vediamo per ulteriore esempio un altro idrocarburo ramificato:
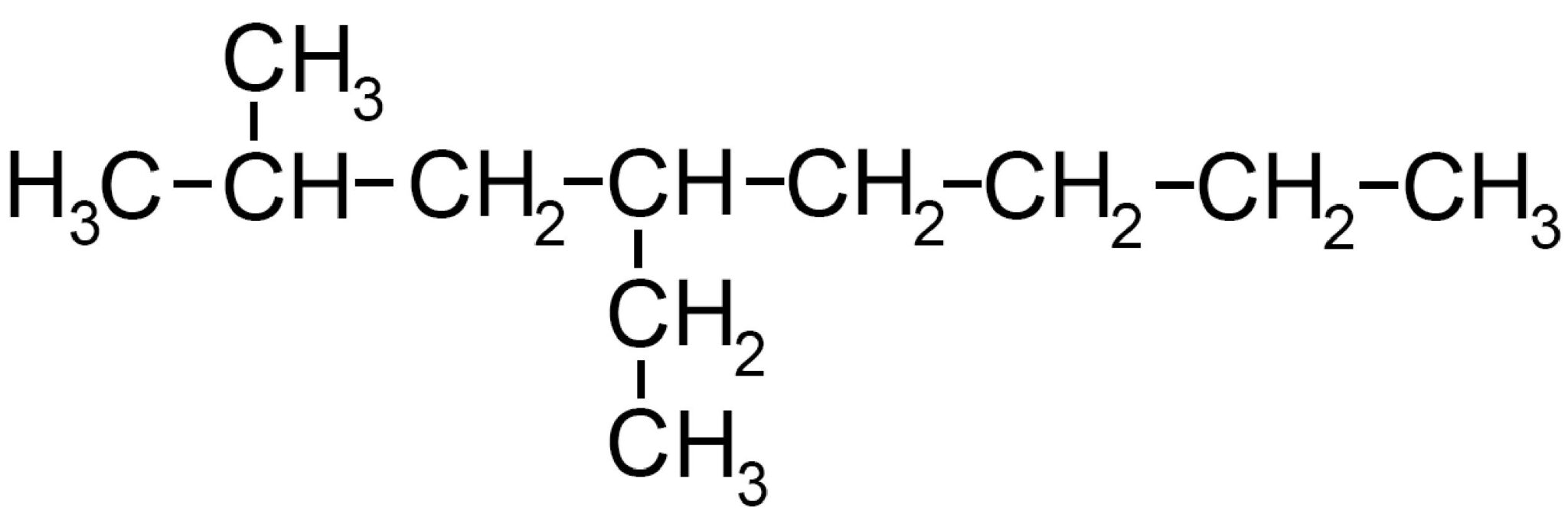
Dopo aver numerato da 1 ad 8 la catena più lunga individuiamo la presenza di un radicale metile −CH3 sul carbonio 2 e di un radicale etile ‒CH2 ‒CH3 sul carbonio 4.
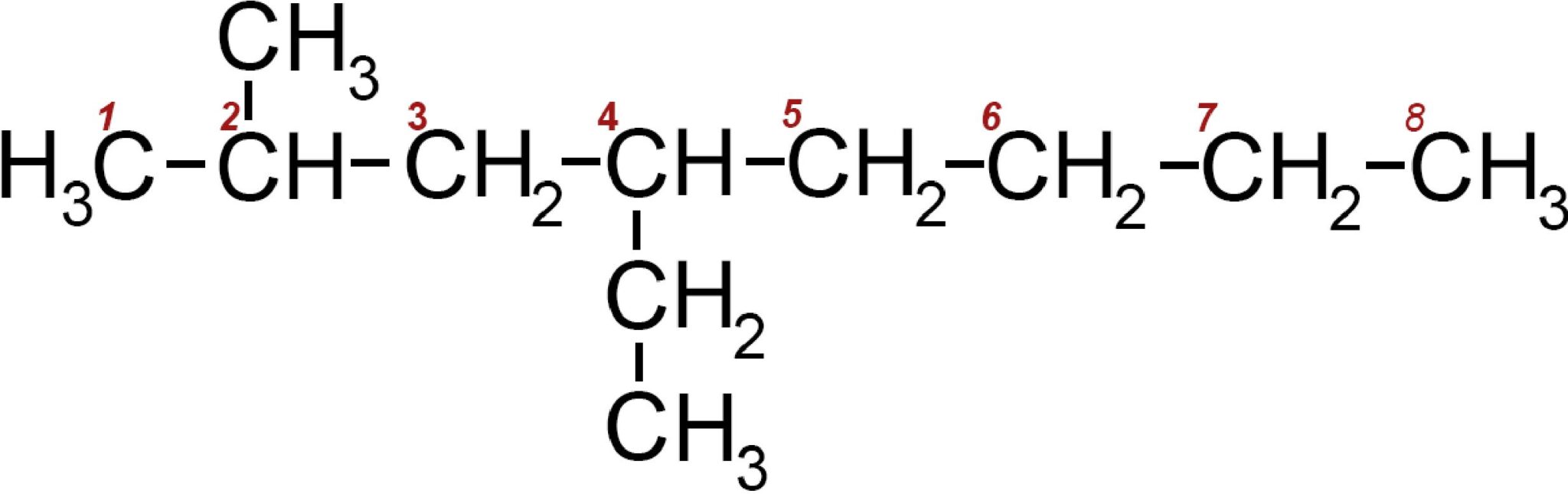
Il nome della molecola è 2 metil 4 etil ottano e in generale la molecola è una delle possibili forme dell’undecano C11H24 perché possiede in tutto undici atomi di carbonio. Diciamo che è un isomero di catena dell’undecano.
Nelle strutture degli idrocarburi un atomo di carbonio può essere definito primario, secondario, terziario o quaternario a seconda di quanti altri atomi di carbonio sono a lui legati.
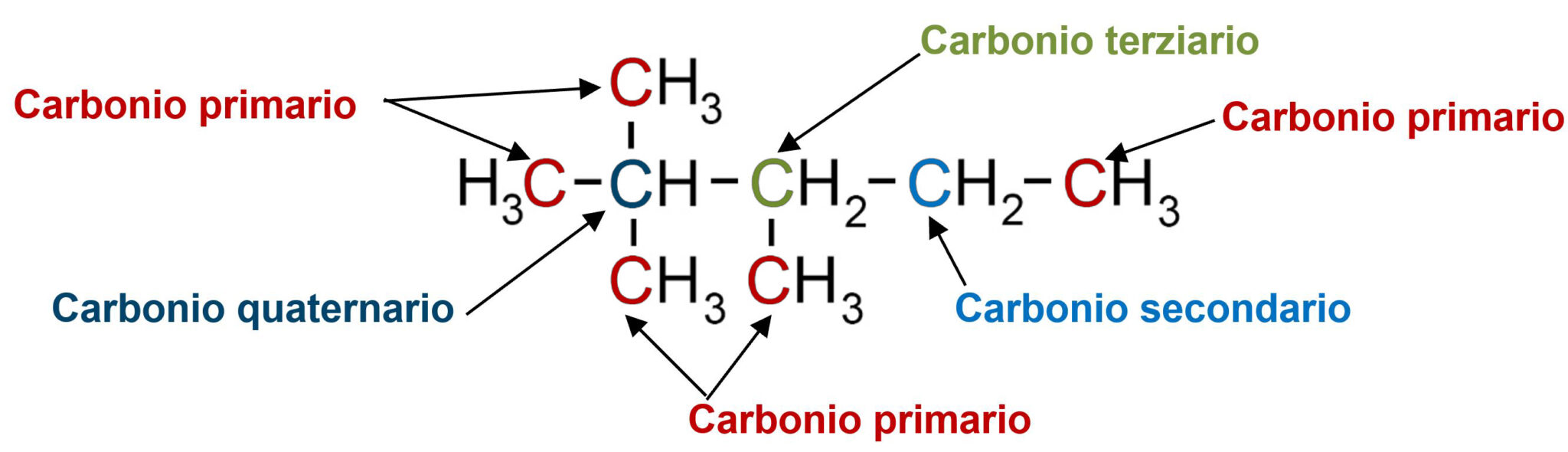
Questa classificazione degli atomi di carbonio ci risulterà utile nello studio di altri composti organici come gli alcoli.
Due casi da ricordare per la nomenclatura dei loro isomeri: il BUTANO e il PENTANO.
BUTANO
Per il butano C4H10 abbiamo i due seguenti possibili isomeri di catena:
1) il n-butano (si pronuncia normal-butano) dove il prefisso “normal” sta ad indicare la forma lineare.
 Formula semplificata Formula semplificata |
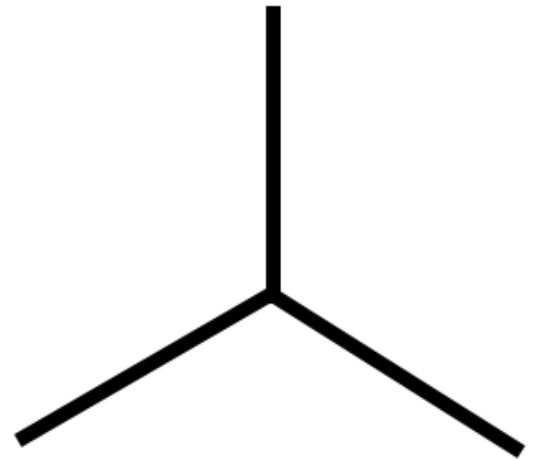
2) il 2-metil propano detto anche isobutano nella nomenclatura tradizionale
Formula di semistruttura |
 Formula semplificata Formula semplificata |
Il prefisso “iso” dell’isobutano nasce da una simmetria spaziale della molecola. (iso significa uguale e la molecola possiede due parti uguali e simmetriche)
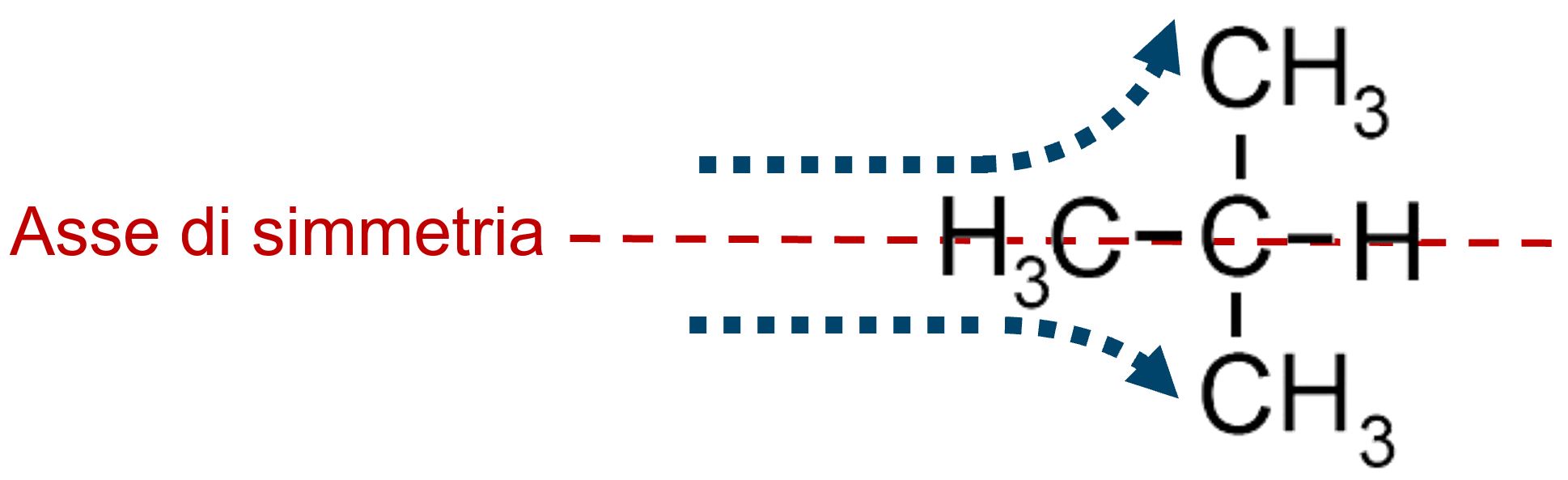 |
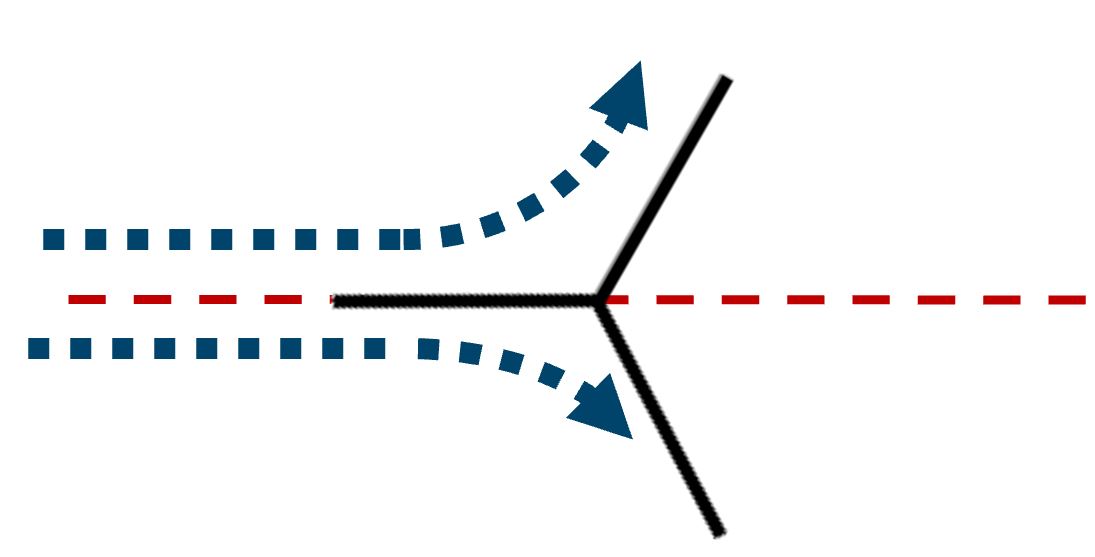 |
PENTANO
Per il pentano C5H12 abbiamo i tre seguenti possibili isomeri di catena:
1) il n-pentano (si pronuncia normal-pentano)
| Formula di semistruttura |
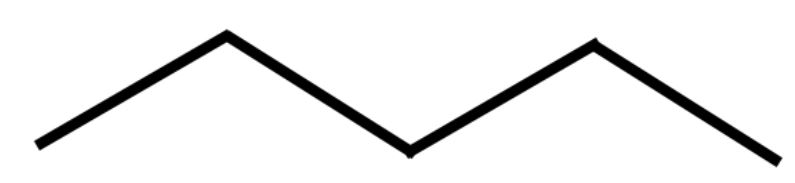 Formula semplificata Formula semplificata |
2) il 2-metil butano detto anche isopentano nella nomenclatura tradizionale
Il prefisso “iso” dell’isobutano nasce da una simmetria spaziale della molecola. (“iso” significa uguale; infatti la molecola possiede due parti uguali e simmetriche)
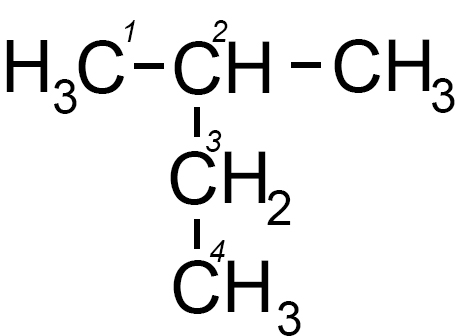 Formula di semistruttura Formula di semistruttura |
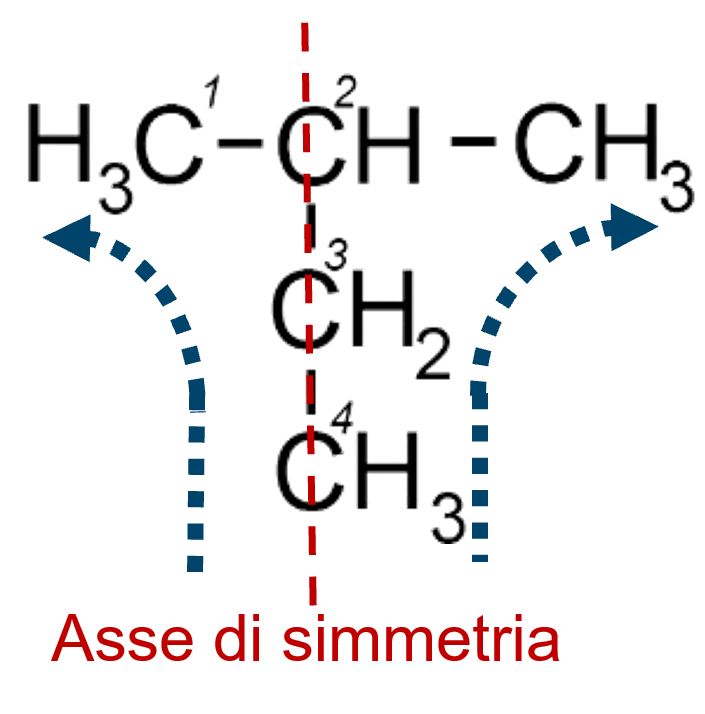 |
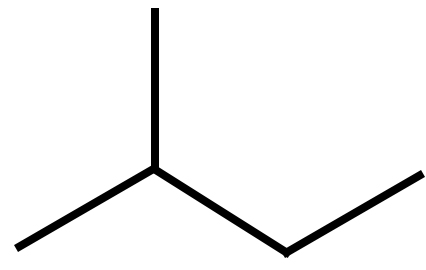
Formula semplificata |
3) il 2-metil butano detto anche neopentano nella nomenclatura tradizionale
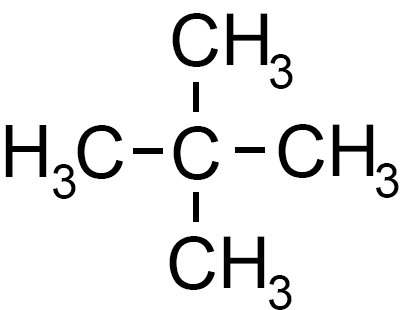 Formula di semistruttura Formula di semistruttura
Questo idrocarburo possiede al centro un atomo di carbonio quaternario ovvero legato ad altri quattro atomi di carbonio. |
 Formula semplificata Formula semplificata
|
10.2.4 Proprietà fisiche e chimiche degli alcani
PROPRIETÀ FISICHE
Gli alcani venivano denominati anche col nome paraffine che viene dal latino parum affinis a denotare la scarsa propensione a reagire chimicamente. Infatti gli alcani sono apolari e risultano pertanto immiscibili con i liquidi polari, in particolare con l’acqua. Sono però dei buoni solventi di sostanza organiche non polari. La loro densità è inferiore a quella dell’acqua; 0,8 g/mL contro 1,0 g/mL dell’acqua. Per questo motivo galleggiano.
All’aumentare del numero degli atomi di carbonio, e quindi del peso molecolare, gli alcani si presentano gassosi (dal metano al butano), liquidi (da 5 fino a circa 17 atomi di carbonio) e solidi per più di 17 atomi di carbonio.
Molte delle candele in commercio sono composte da paraffine (alcani) derivate dal petrolio.
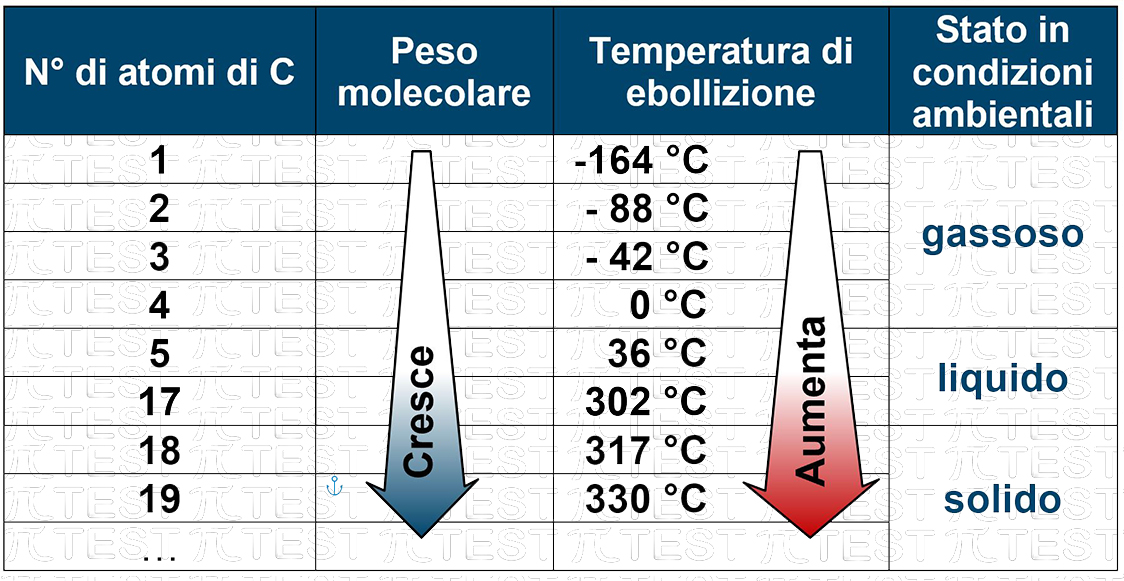 A parità del numero di atomi di carbonio l’idrocarburo con più ramificazioni, rispetto a quello lineare possiede un punto di ebollizione più basso.
A parità del numero di atomi di carbonio l’idrocarburo con più ramificazioni, rispetto a quello lineare possiede un punto di ebollizione più basso.
PROPRIETÀ CHIMICHE
In condizioni ambientali gli alcani non reagiscono con acidi e basi. La struttura dei legami carbonio-carbonio è particolarmente stabile e per arrivare a reagire c’è bisogno di elevata energia che può essere fornita dall’alta temperatura in caso di combustione.
La combustione degli idrocarburi è semplice da bilanciare. Vediamo due esempi:
CH4 + 2 O2 → CO2 + 2 H2O
2 C4H10 + 13 O2 → 8 CO2 + 10 H2O
Per gli alcani esistono anche le reazioni di cracking che spezzano le catene più lunghe producendo idrocarburi più corti.
© il testo e le immagini sono di esclusiva proprietà dell’autore e sono sottoposti a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito


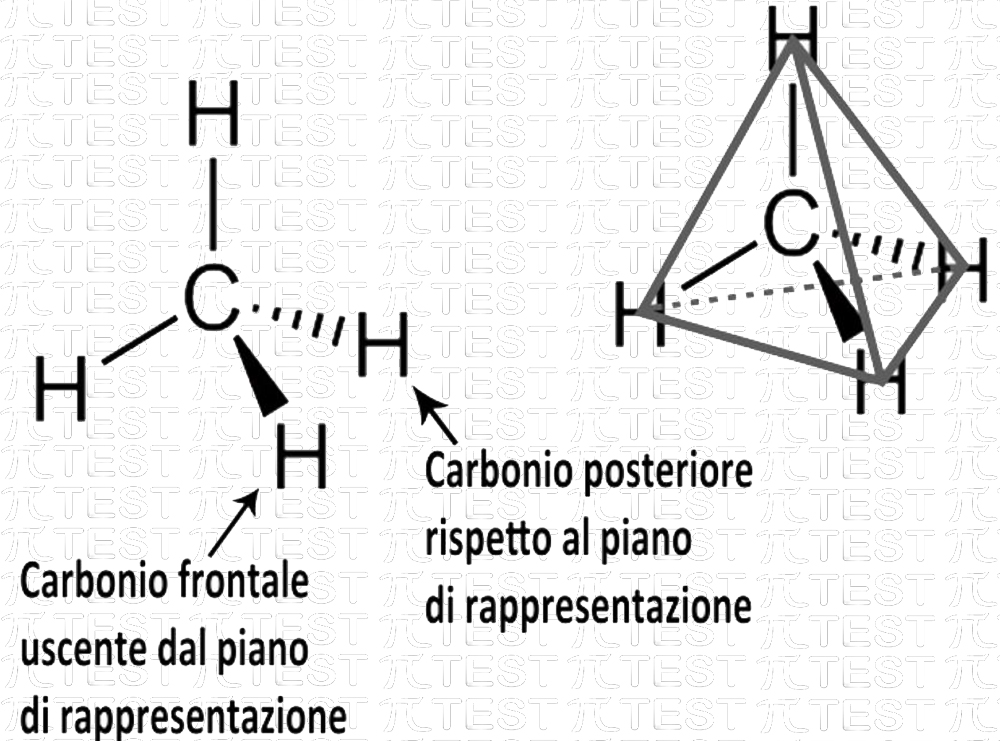 Formula di struttura con rappresentazione tridimensionale della forma tetraedrica sp3
Formula di struttura con rappresentazione tridimensionale della forma tetraedrica sp3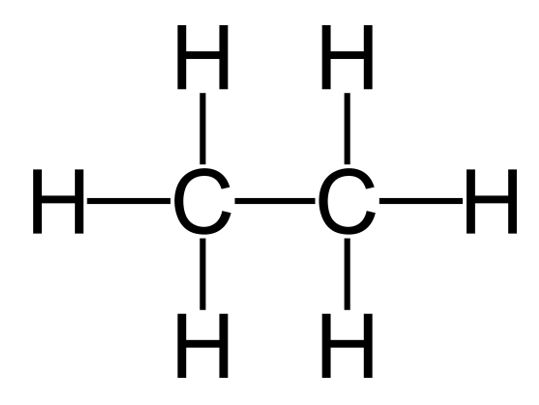 Formula di struttura
Formula di struttura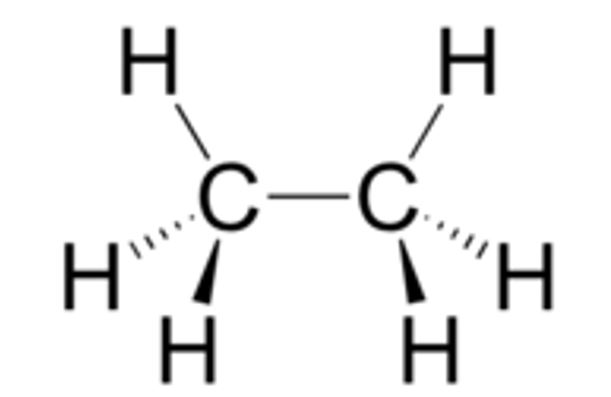 Rappresentazione tridimensionale dei due tetraedri sp3
Rappresentazione tridimensionale dei due tetraedri sp3 Formula semplificata
Formula semplificata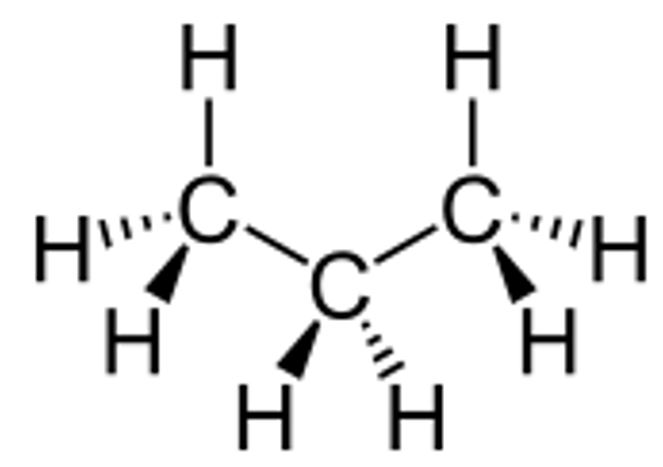 Rappresentazione tridimensionale dei due tetraedri sp3
Rappresentazione tridimensionale dei due tetraedri sp3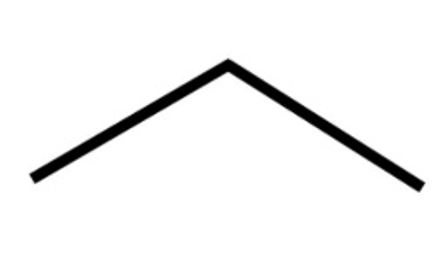 Formula semplificata
Formula semplificata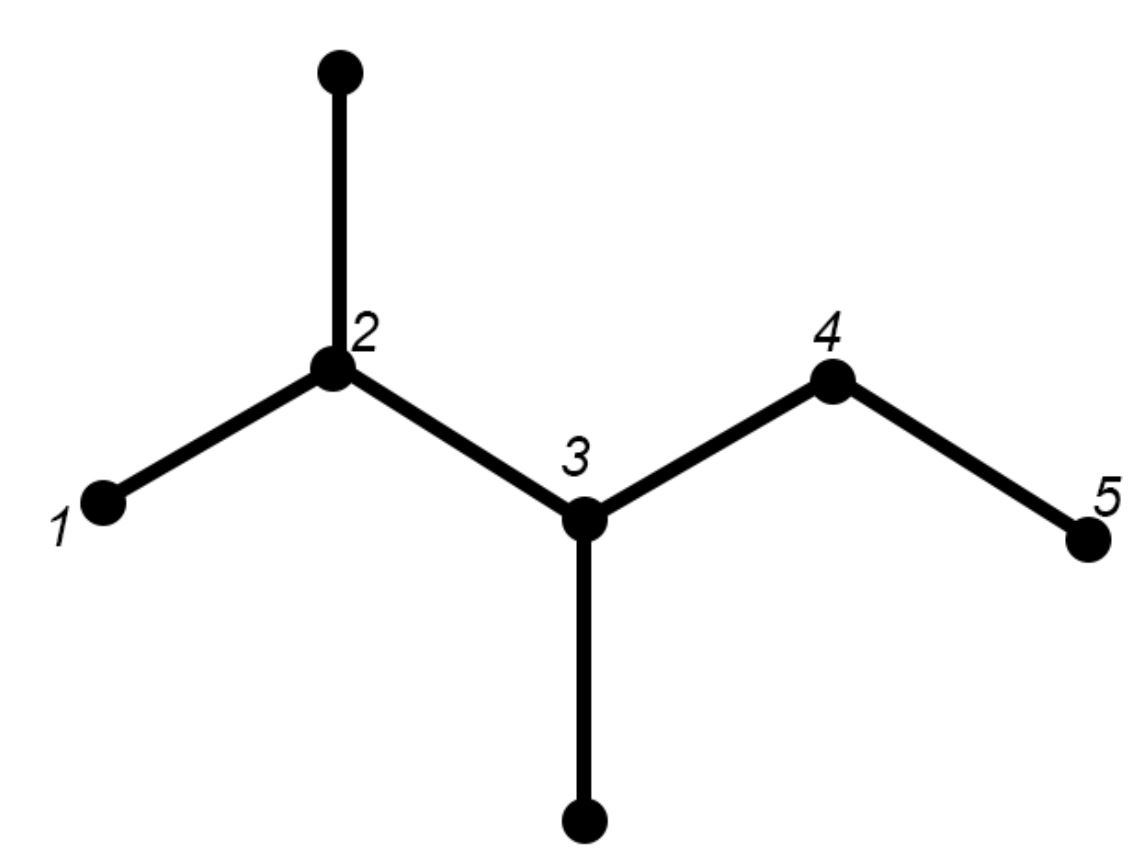 Formula semplificata con
Formula semplificata con 