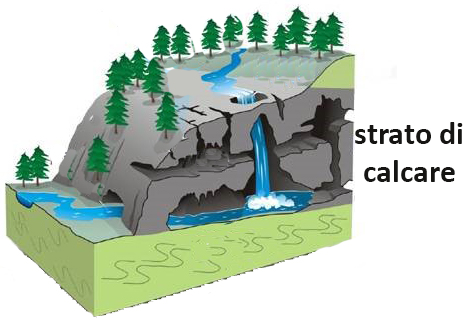
8.7 Dissoluzione del carbonato di calcio
Tutti i carbonati degli elementi del II gruppo sono poco solubili in acqua, e si trovano in natura come minerali solidi; il più comune tra questi composti è il carbonato di calcio CaCO3, che forma le rocce calcaree e costituisce uno dei minerali più diffusi, praticamente insolubile in acqua pura. Risulta invece assai solubile in acqua contenente anidride carbonica: la soluzione acquosa di CO2 scioglie il carbonato di calcio, perché lo converte in idrogenocarbonato (o bicarbonato) di calcio, solubile; le rocce calcaree vengono pertanto erose dalle acque del suolo che durante le precipitazioni piovose si sono arricchite di CO2
CO2 + H2O + CaCO3 ⇆ Ca(HCO3)2
Osservazione:
Esistono notevoli differenze tra le solubilità in acqua dei carbonati e degli idrogenocarbonati degli elementi del primo e del secondo gruppo. Infatti i carbonati dei metalli alcalini sono notevolmente più solubili dei rispettivi idrogenocarbonati, mentre per i metalli alcalino – terrosi si verifica il fenomeno opposto.
| Ca(HCO3)2 bicarbonato di calcio |
Più solubile | CaCO3 carbonato di calcio |
meno solubile |
| NaHCO3 bicarbonato di sodio |
Meno solubile | Na2HCO3 carbonato di sodio |
Più solubile |
© il testo e le immagini sono di esclusiva proprietà dell’autore e sono sottoposti a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito
Continua lo studio
8.8 Le proprietà colligative


