3.3 I numeri quantici
Le caratteristiche dei diversi orbitali che abbiamo visto possono essere espresse invece che con parole anche con i numeri quantici. Ciò che abbiamo espresso a parole e con lettere simboliche per le forme degli orbitali (s, p, d, f) sarà ridotto a semplici numeri.
Immaginiamo di individuare un particolare elettrone del quale potremo indicare:
- in quale livello energetico si trova;
- in quale tipo di orbitale;
- all’interno di un tipo di orbitale, potremo dire in quale specificamente si trova; ad esempio per i tre orbitali p, che sono orientati secondo gli assi cartesiani (px, py e pz) possiamo indicare in quale dei tre specificamente si trova l’elettrone.
- per ultima informazione consideriamo anche che in un orbitale possono trovarsi solo due possibili elettroni con spin opposto. Diciamo allora quale dei due possibili sensi di rotazione ha l’elettrone che stiamo considerando.
Passiamo a descrivere queste quattro caratteristiche che individuano il ruolo di un elettrone con i Numeri Quantici:
| n | numero quantico
principale n |
Assume i valori 1, 2, 3, 4,… . indica il livello energetico ovvero il guscio elettronico | ||||||||||
| l | numero quantico
secondario l (elle) detto anche del momento angolare |
In funzione della forma assume i seguenti valori:
|
||||||||||
| m | numero quantico
magnetico m |
Per indicare quale orbitale di un gruppo utilizza valori numerici a cavallo del numero zero:
|
||||||||||
| ms | numero quantico
(magnetico) di spin ms |
Indica il senso di rotazione dell’elettrone attorno al proprio asse e assume i valori +1/2 e -1/2 |
Possiamo fare alcune considerazioni matematiche sui possibili valori dei numeri quantici:
- il numero quantico secondario l assume valori interi che sono legati al numero quantico principale n secondo la relazione: 0 ≤ l ≤ n‒1
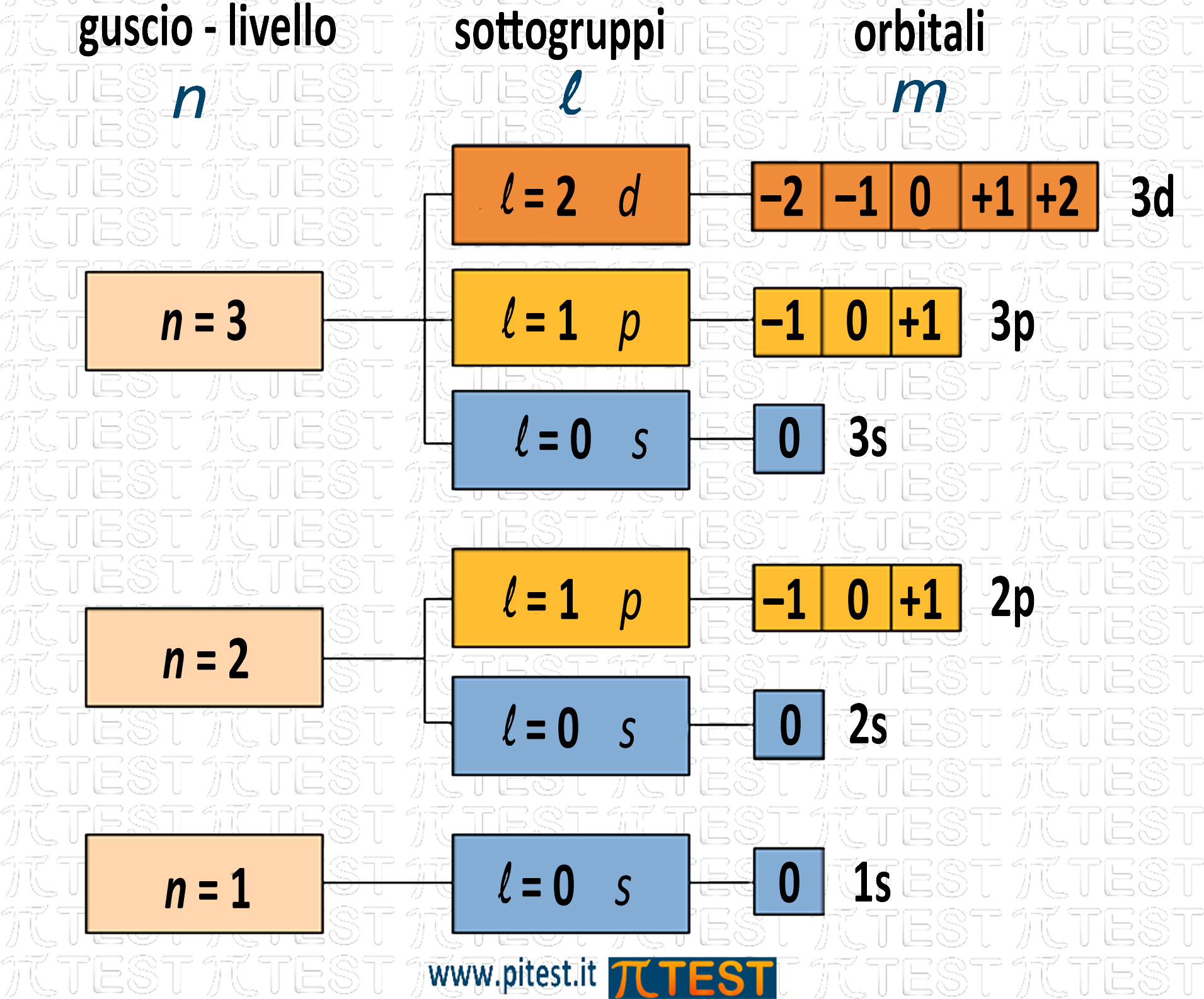
Ad esempio al primo livello (n = 1) l può assumere il solo valore 0. Infatti nel primo livello è presente un solo orbitale s. Al secondo livello (n = 2) l può assumere valori 0 ≤ l ≤ 1. Infatti nel secondo livello sono presenti orbitali s e p. Al terzo livello (n=3) l può assumere valori 0 ≤ l ≤ 3. Infatti nel secondo livello sono presenti orbitali s, p e d.
- il numero quantico magnetico m assume valori interi che sono legati al numero quantico secondario l secondo la relazione: + l ≤ m ≤ ‒l
Nella seguente tavola troviamo un utile schema riassuntivo dei numeri quantici che caratterizzano i diversi orbitali.
QUIZ 3.3 I numeri quantici |
|||
|---|---|---|---|
© il testo è di esclusiva proprietà dell’autore ed è sottoposto a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito
3.4 La Tavola periodica degli elementi


