7.3 L’equilibrio chimico
Facciamo riferimento ad una generica reazione chimica nella quale i reagenti A e B danno i prodotti C e D secondo generici coefficienti stechiometrici α, β,γ e δ. Immaginiamo che all’inizio siano presento solo i reagenti. La reazione procederà verso la produzione di C e D:
αA + βB → γC + δD
Quando però C e D si sono formati, avverrà che da questi si potranno formare A e B secondo la reazione inversa:
αA + βB ⥄ γC + δD
Arriveremo al punto che le due reazioni (diretta e inversa) hanno la stessa velocità e le concentrazioni di reagenti e prodotti rimangono costanti. La reazione a questo punto è in equilibrio:
αA + βB ⇆ γC + δD
Nella precedente scrittura abbiamo indicato le doppie frecce ⇆ che indicano la presenza di entrambe le reazioni.
All’equilibrio le concentrazioni di reagenti e prodotti assumono valori costanti nel tempo. Possiamo dire che a livello macroscopico la reazione è ferma, mentre a livello microscopico ci sono sempre reagenti A e B che si trasformano in C e D insieme a C e D che si trasformano in A e B.
In altre parole, mentre a livello macroscopico la reazione sembra ferma, a livello microscopico invece la reazione è in continua attività.
I valori delle concentrazioni di A, B, C e D all’equilibrio sono stabiliti dal valore della costante di equilibrio Kc :
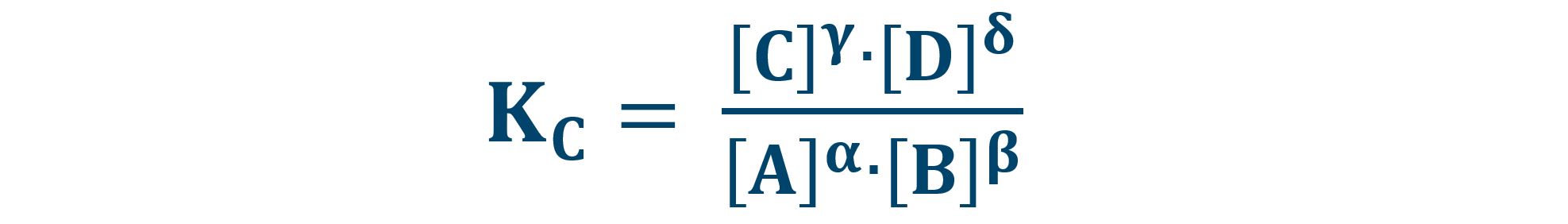 La scrittura [X] indica la concentrazione molare della sostanza in fase acquosa. Si misura in moli/litro.
La scrittura [X] indica la concentrazione molare della sostanza in fase acquosa. Si misura in moli/litro.
Analizziamo la formula della costante di equilibrio. Al numeratore sono presenti le concentrazioni dei prodotti e al denominatore le concentrazioni dei reagenti. Per ogni reazione chimica Kc ha un valore definito e tutte le concentrazioni devono assestarsi, entro un certo tempo, su valori tali da rispettare il valore di Kc.
| Kc grande | Le concentrazioni dei prodotti C e D sono grandi e le concentrazioni dei reagenti A e B sono piccoli | La reazione è spostata verso destra. Si formano molti prodotti e si consumano molti reagenti. |
| Kc piccolo | Le concentrazioni dei prodotti C e D sono piccoli e le concentrazioni dei reagenti A e B sono grandi | La reazione è spostata verso sinistra Si formano pochi prodotti e si consumano pochi reagenti. |
Vediamo alcuni esempi:
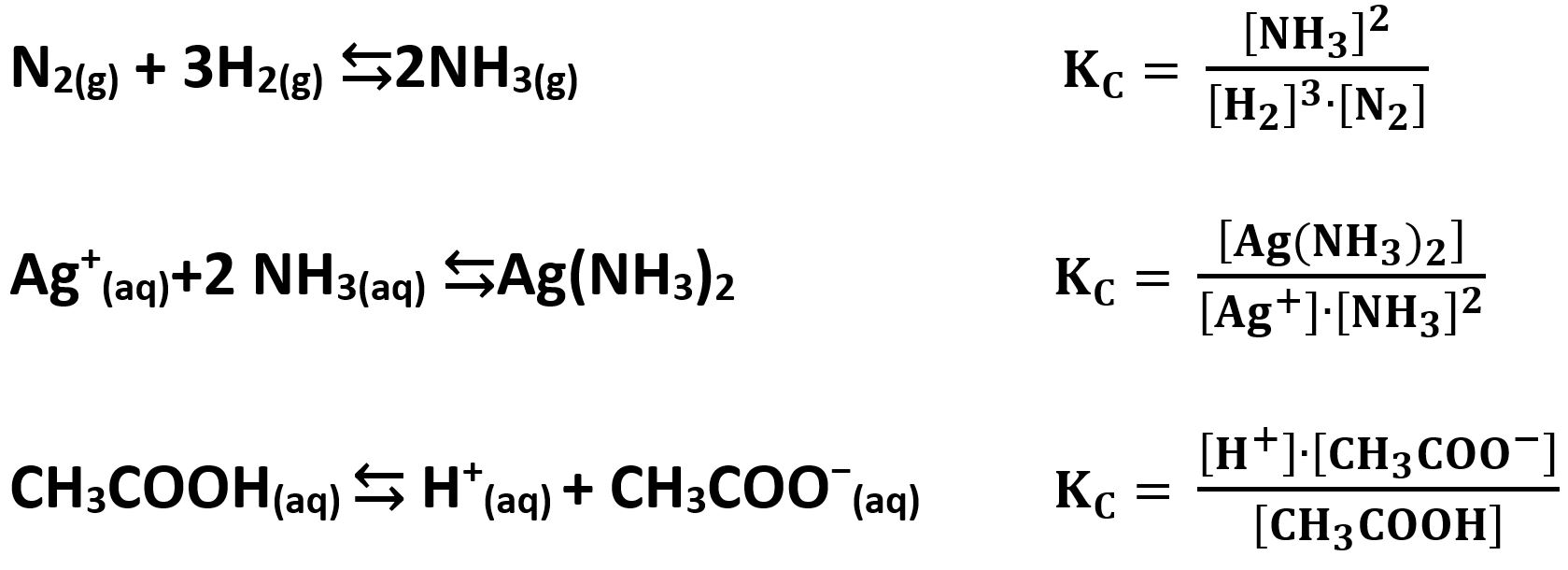
I pedici accanto alle specie presenti indicano il tipo di fase nella quale sono presenti:
(s) = solido (g) = gas (aq)= in soluzione acquosa
Nella scrittura della costante di equilibrio le specie solide non compaiono.

Questa è la reazione di dissoluzione del sale ioduro di argento AgI. Il sale è presente come solido in acqua in equilibrio con i suoi ioni disciolti ioduro I−(aq) e Argento Ag+(aq). A determinare l’equilibrio sono le concentrazioni degli ioni mentre la quantità di sale AgI(s) (presente sul fondo del recipiente) non è influente sull’equilibrio.
Similmente per quest’altro esempio di un’ossidoriduzione:
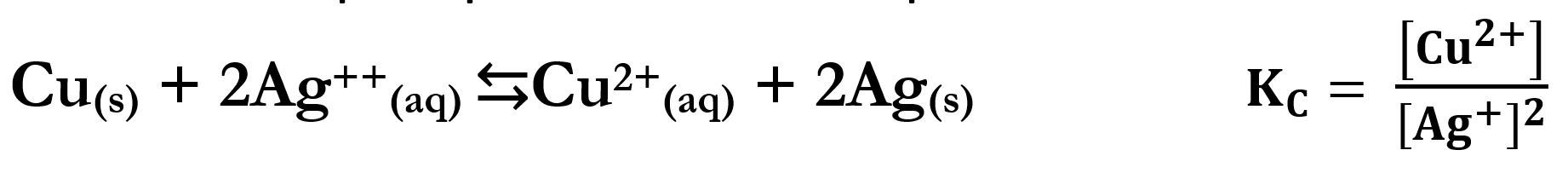
7.3.1 Kc è legato al ΔG della reazione
La variazione di energia libera associata ad una reazione chimica ΔGreaz. determina la sua maggiore o minore spontaneità e di conseguenza va a determinare il valore della costante di equilibrio.
| ΔG<0 spontanea |
Kc grande | Reazione spostata verso destra |
| ΔG<0 non spontanea |
Kc piccolo | Reazione spostata verso sinistra |
7.3.2 Kc dipende dalla temperatura
Il valore della costante di equilibrio di una ogni reazione chimica è un valore noto che dipende solo dalla temperatura e può aumentare o diminuire in funzione di T a seconda della reazione.
La relazione tra e ΔG è dato dalla equazione di Arrhenius (finora mai chiesta nei test di ammissione)![]() Nella espressone esponenziale abbiamo la temperatura al denominatore (espressa in Kelvin) e ΔG al numeratore che a sua volta dipende dalla temperatura secondo la relazione ΔG = ΔH − T·ΔS. È evidente che Kc dipende dalla temperatura in modo non sempre uguale. Possiamo solo affermare che Kc segue una regola non uguale per tutte le reazioni chimiche.
Nella espressone esponenziale abbiamo la temperatura al denominatore (espressa in Kelvin) e ΔG al numeratore che a sua volta dipende dalla temperatura secondo la relazione ΔG = ΔH − T·ΔS. È evidente che Kc dipende dalla temperatura in modo non sempre uguale. Possiamo solo affermare che Kc segue una regola non uguale per tutte le reazioni chimiche.
7.3.3 Dimensioni fisiche di Kc
La costante di equilibrio ha una dimensione fisica che dipende dai coefficienti stechiometrici α, β,γ e δ della reazione.
Si veda il Quiz 2
Non tutte le reazioni però presentano una costante di equilibrio adimensionale.
Ad esempio per la reazione
N2(g) + 3H2(g) ⇆ 2NH3(g)
avremo
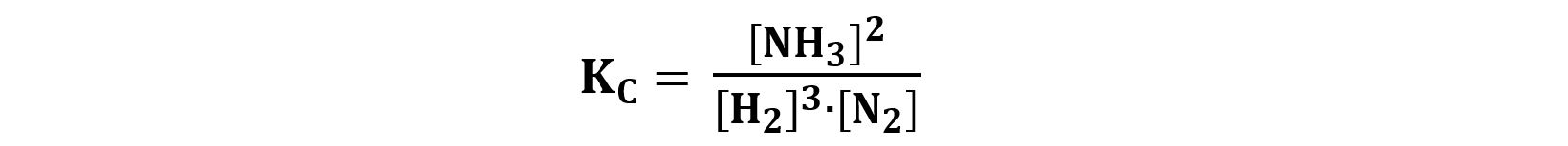
le cui dimensioni fisiche sono:
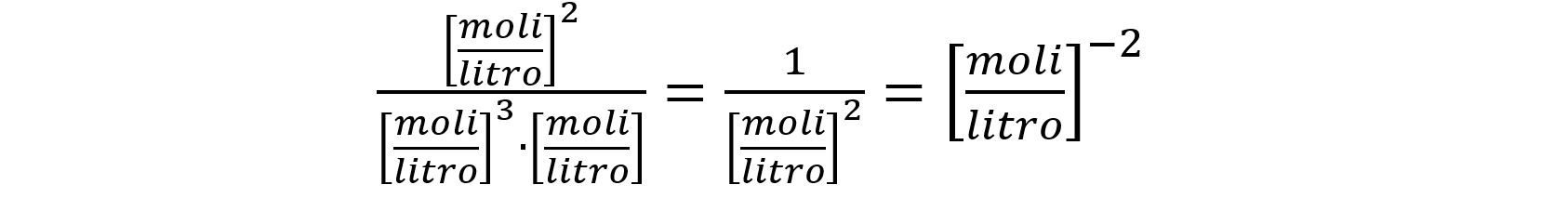
7.3.4 Costante di equilibrio espressa in funzione delle pressioni parziali
Per le reazioni chimiche che avvengono in fase gassosa è più comodo esprimere la costante di equilibrio in funzione delle pressioni parziali.
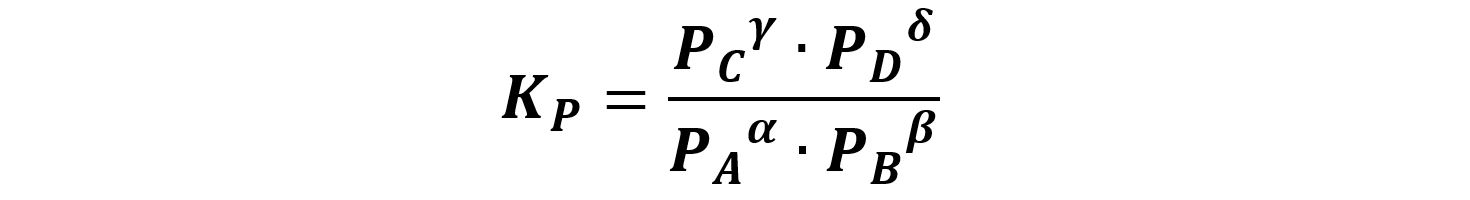
Abbiamo definito le pressioni parziali nel paragrafo 1.4.2.
Ad esempio, per la reazione di sintesi dell’ammopniaca:
3H2(g)+N2(g) ⇆2NH3(g)
possiamo scrivere
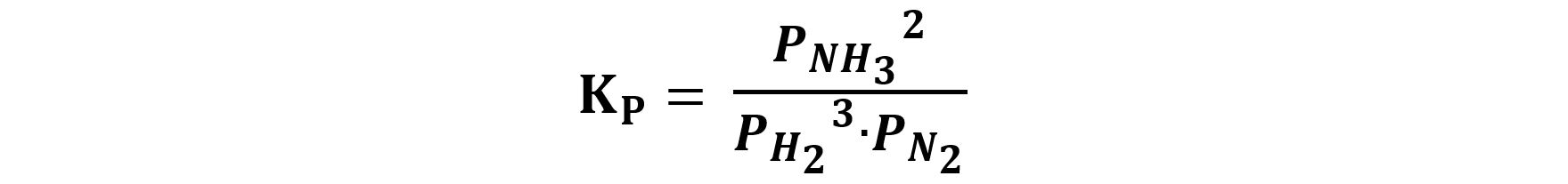
© il testo e le immagini sono di esclusiva proprietà dell’autore e sono sottoposti a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito
QUIZ sull'equilibrio chimico |
|||
|---|---|---|---|


