9.5 Costante di equilibrio di acidi e basi
Come tutte le reazioni l’idrolisi acida e basica sono reazioni che hanno la loro costante di equilibrio.
Vediamo come esempio l’idrolisi(1) acida dell’acido acetico:
CH3COOH + H2O ⇆ H3O+ + CH3COO‒
La costante di equilibrio(2) di questa reazione è:
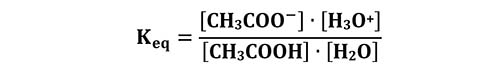
Si considera una grandezza che chiamiamo costante acida Ka, che è definita come:
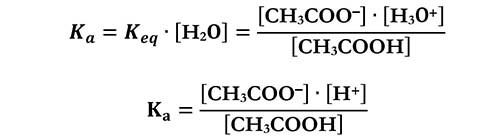
Se facciamo riferimento ad un acido generico AH per la sua idrolisi avremo:
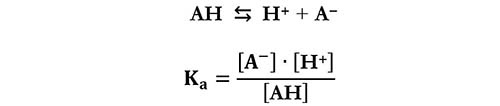
Per le basi vediamo come esempio l’idrolisi(1) basica dell’ammoniaca:
NH3 + H2O ⇆ NH4+ + OH−
La costante di equilibrio di questa reazione è:
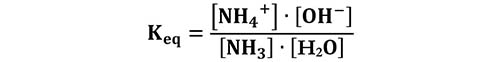
Analogamente a quanto abbiamo visto per gli acidi, si considera una grandezza che chiamiamo costante basica Kb, che è definita come:
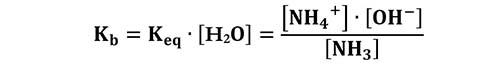 Se facciamo riferimento ad una base generica BOH per la sua idrolisi avremo:
Se facciamo riferimento ad una base generica BOH per la sua idrolisi avremo:
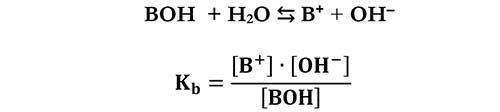
I valori della costante acida e della costante basica vengono dati indicando il valore di temperatura. Al variare della temperatura variano le costanti di equilibrio.
Note
(1) Il termine idrolisi significa rottura/taglio in soluzione acquosa (idro=acqua; lisi=spezzare). Si parla di idrolisi acida o basica quando una molecola in soluzione acquosa libera H+ o OH‒. Si parla di idrolisi salina quando un sale si discioglie in acqua.
(2) Per una generica reazione αA + βB ⇆ γC + δD la costante di equilibrio è data dalla relazione:
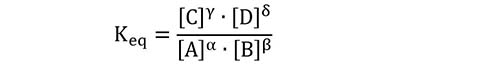 Dove con le parentesi quadre indichiamo le concentrazioni molari.
Dove con le parentesi quadre indichiamo le concentrazioni molari.
© il testo e le immagini sono di esclusiva proprietà dell’autore e sono sottoposti a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito
9.1 Autoprotolisi
9.2 Soluzioni acide e basiche – pH
9.3 Definizione di acido e base
9.4 Acidi mono e poli-protici
9.5 Costante di equilibrio di acidi e basi
9.6 Acidi e basi forti e deboli
9.7 Rapporto tra Ka e Kb
9.8 Acidi e basi FORTI in soluzione
9.9 Diluizioni di acidi e basi forti in soluzione
9.10 Acidi e basi DEBOLI in soluzione
9.11 Neutralizzazione
9.12 Sali neutri, acidi e basici
9.13 Tamponi


