9.4 Acidi mono e poli-protici
Un acido è un composto che possiede uno o più atomi di idrogeno che possono essere ceduti.
Lo ione H+ è un atomo di idrogeno che ha perso il suo unico elettrone; si tratta così del solo nucleo dell’atomo costituito da un solo protone. Per questo motivo spesso chiamiamo con il termine “protone” lo ione H+.
Il termine protone viene utilizzato anche quando un acido si dissocia rilasciando H+; chiamiamo questa reazione “deprotonazione”. Chiamiamo così mono-protici gli acidi che cedono un solo H+ e bi-protici, tri-protici e in generale poli-protici gli acidi che ne cedono più di uno.
Le cessioni di H+ sono dette prima deprotonazione, seconda deprotonazione, ecc.
Vediamo gli acidi più comuni utilizzati nei quiz di ammissione:
| Acidi monoprotici | ||
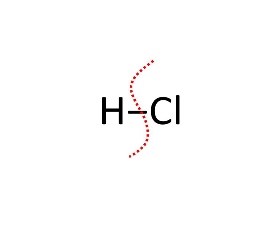
| HCl | Acido cloridrico |
HCl → H+ + Cl‒ possiamo scrivere la reazione di deprotonazione anche nella forma: HCl +H2O → H3O+ + Cl‒
|
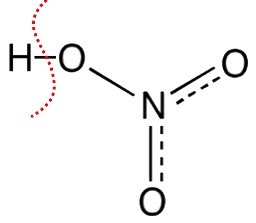
| HNO3 | Acido nitrico |
HNO3 → H+ + NO3‒ possiamo scrivere la reazione di deprotonazione anche nella forma: HNO3 +H2O → H3O+ + NO3‒
|
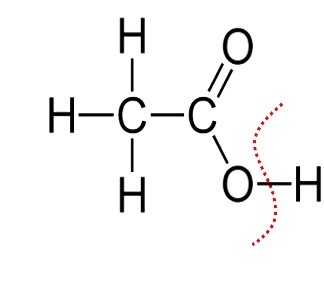
| CH3COOH | Acido acetico |
CH3COOH ⇆ H+ + CH3COO‒ possiamo scrivere la reazione di deprotonazione anche nella forma: CH3COOH + H2O ⇆ H3O+ + CH3COO‒
|
| Acidi biprotici | ||
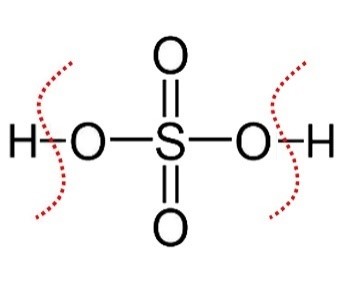
| H2SO4
|
Acido solforico | Prima deprotonazione:
H2SO4 → H+ + HSO4‒ Seconda deprotonazione: HSO4‒ → H+ + SO4=
|
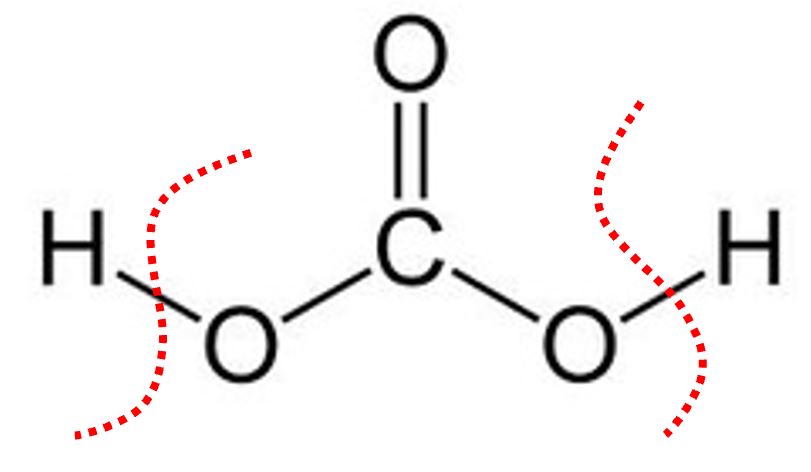
| H2CO3
|
Acido carbonico | Prima deprotonazione:
H2CO3 → H+ + HCO3‒ Seconda deprotonazione: HCO3‒ → H+ + CO3=
|
| Acidi triprotici | ||
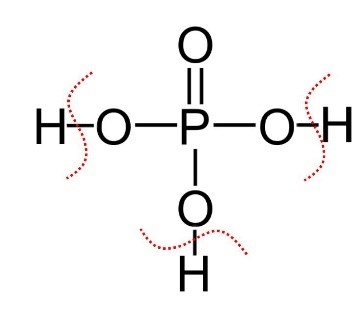
| H3PO4
|
Acido fosforico | Prima deprotonazione:
H3PO4 → H+ + H2PO4‒ Seconda deprotonazione: H2PO4‒ → H+ + HPO42‒ Terza deprotonazione: HPO4= → H+ + PO43‒
|
Consideriamo le forme intermedie di deprotonazione degli acidi poliprotici come ad esempio:
- HCO3− ione bicarbonato (IUPAC: idrogenocarbonato)
- H2PO4− diidrogenofosfato
- HPO42− idrogenofosfato
Questi ioni hanno comportamento anfotero o anfilitico. Per esempio lo ione bicarbonato può spostarsi verso lo ione carbonato deprotonando con un comportamento acido, oppure può spostarsi verso l’acido carbonico con un comportamento basico.
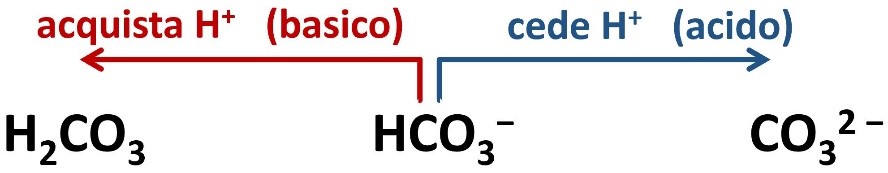
Consideriamo le forme intermedie di deprotonazione degli acidi poliprotici come ad esempio:
HCO3− ione bicarbonato (IUPAC: idrogenocarbonato)
H2PO4− diidrogenofosfato
HPO42− idrogenofosfato
Questi ioni hanno comportamento anfotero o anfilitico. Per esempio lo ione bicarbonato può spostarsi verso lo ione carbonato deprotonando e avendo un comportamento acido, oppure può spostarsi verso l’acido carbonico con un comportamento basico.
© il testo e le immagini sono di esclusiva proprietà dell’autore e sono sottoposti a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito
© il testo e le immagini sono di esclusiva proprietà dell’autore e sono sottoposti a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito
9.1 Autoprotolisi
9.2 Soluzioni acide e basiche – pH
9.3 Definizione di acido e base
9.4 Acidi mono e poli-protici
9.5 Costante di equilibrio di acidi e basici
9.6 Acidi e basi forti e deboli
9.7 Rapporto tra Ka e Kb
9.8 Acidi e basi FORTI in soluzione
9.9 Diluizioni di acidi e basi forti in soluzione
9.10 Acidi e basi DEBOLI in soluzione
9.11 Neutralizzazione
9.12 Sali neutri, acidi e basici
9.13 Tamponi