9.12 Sali neutri, acidi e basici
Un sale può essere immaginato come derivante dalla neutralizzazione di un acido con una base. A seconda che questi siano forti o deboli, possiamo capire la natura del sale.
SALE NEUTRO
Ad esempio un sale come il cloruro di sodio NaCl ha origine dalla neutralizzazione di un acido forte HCl con una base forte NaOH. I due ioni “spettatori” di origine forte Cl‒ e Na+ formeranno il sale che risulta un sale neutro in quanto i due ioni non danno alcuna reazione.
SALE BASICO
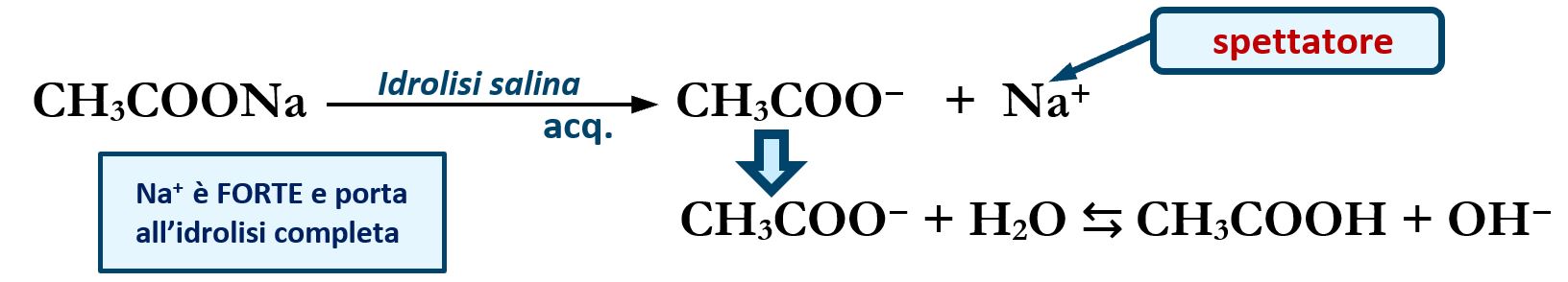
Ad esempio un sale come l’acetato di sodio CH3COONa ha origine dalla neutralizzazione di un acido debole CH3COOH con una base forte NaOH. Lo ione “spettatore” di origine forte Na+ non reagisce in acqua e per la sua natura forte in acqua rimane in forma ionica. Di conseguenza alla natura indipendente di Na+, anche lo ione acetato è costretto a stare in acqua in forma ionica; lo ione acetato, per la sua natura debole, tende a riformare l’acido indissociato:
CH3COO− + H2O ⇆ CH3COOH + OH−
così facendo si libera in acqua uno ione ossidrile OH‒ determinando una certa basicità della soluzione.
In sintesi l’acetato di sodio CH3COONa in acqua possiede un comportamento basico.
SALE ACIDO
Ad esempio un sale come il cloruro di ammonio NH4Cl ha origine dalla neutralizzazione di un acido forte HCl con una base debole NH3. Lo ione “spettatore” di origine forte Cl‒ non reagisce in acqua e per la sua natura forte in acqua rimane in forma ionica. Di conseguenza alla natura indipendente di Cl‒ , anche lo ione ammonio è costretto a stare in acqua in forma ionica; lo ione ammonio, per la sua natura debole, tende a riformare la base ammoniaca:
NH4+ + H2O ⇆ NH3 + H3O+
così facendo si libera in acqua uno ione H+ determinando una certa acidità della soluzione.
In sintesi cloruro di ammonio NH4Cl in acqua possiede un comportamento acido.
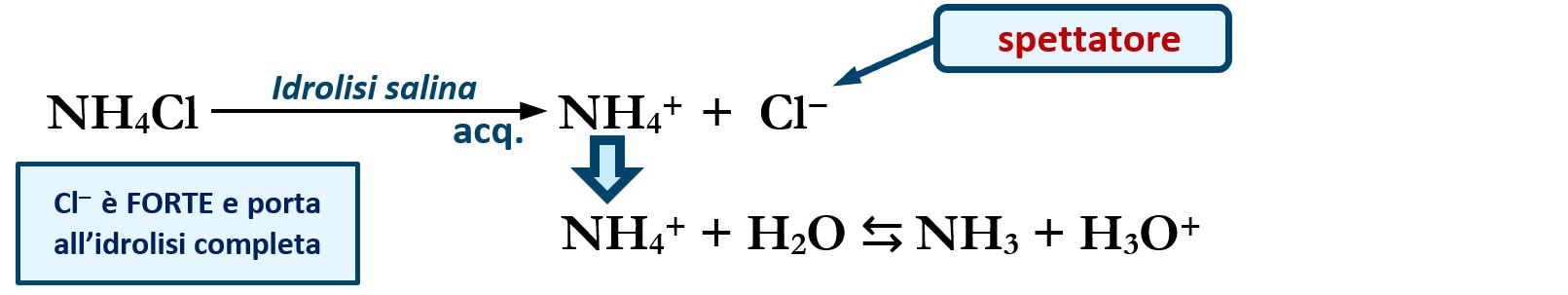
Come considerazione finale possiamo osservare che esistono:
IONI SPETTATORI, ACIDI, BASICI
Ioni spettatori, che derivano da acidi e basi forti come Cl− e Na+. Sono detti spettatori perché, quando sono presenti, non reagiscono con altre sostanze e rimangono inalterati, similmente allo spettatore che osserva uno spettacolo senza prendervi parte.
Ioni acidi (per esempio l’ammonio NH4+)
Ioni basici (per esempio l’acetato CH3COO−) che all’interno di un sale ne determinano la natura.
© il testo e le immagini sono di esclusiva proprietà dell’autore e sono sottoposti a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito
9.1 Autoprotolisi
9.2 Soluzioni acide e basiche – pH
9.3 Definizione di acido e base
9.4 Acidi mono e poli-protici
9.5 Costante di equilibrio di acidi e basici
9.6 Acidi e basi forti e deboli
9.7 Rapporto tra Ka e Kb
9.8 Acidi e basi FORTI in soluzione
9.9 Diluizioni di acidi e basi forti in soluzione
9.10 Acidi e basi DEBOLI in soluzione
9.11 Neutralizzazione
9.12 Sali neutri, acidi e basici
9.13 Tamponi


