7.5 Cinetica chimica – Catalizzatori
Quanto detto finora riguarda la spontaneità delle reazioni chimiche ed il conseguente equilibrio che si raggiunge tra reagenti e prodotti. Il tempo necessario per raggiungere la condizione di equilibrio dipende invece da altri fattori ed è un dato indipendente dalla spontaneità della reazione stessa.
In una certa reazione chimica i reagenti, visti come singole molecole, devono avere una sufficiente energia cinetica ed il giusto orientamento per poter innescare la trasformazione.
ANALOGIA
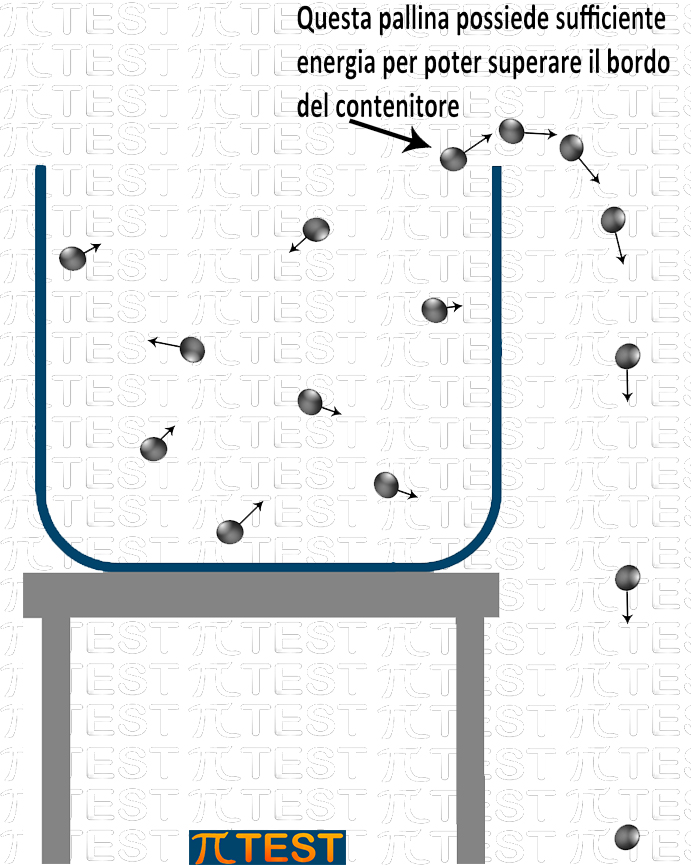
Per capire il fenomeno consideriamo per analogia un sistema fisico nel quale alcune palline sono contenute in un recipiente aperto. Le palline possiedono energia cinetica e si muovono urtandosi e rimbalzando elasticamente. Il fenomeno fisico che studiamo è “riuscire a superare i bordi del recipiente e cadere al di fuori”. Una volta fuori la pallina cadrà in basso. Tra la posizione iniziale all’interno del recipiente e quella finale più in basso la variazione di energia potenziale gravitazionale è tale da andare verso uno stato di energia minore, trasformazione questa che risulta spontanea. La difficoltà sta però nel riuscire a superare lo scoglio iniziale. Solo le palline che possiedono una certa energia riescono a saltare abbastanza in alto da poter saltare il bordo del recipiente. Il valore di energia delle palline non è uguale per tutte a causa degli urti tra palline.
Se vogliamo aumentare la velocità della reazione, cioè il numero di palline che in un secondo riescono a saltare il bordo possiamo agire in due modi:
-
- Aumentare l’energia cinetica media di tutte le palline in modo che aumenta il numero di palline che raggiungono una altezza sufficiente da superare il bordo;
- Abbassare il bordo del recipiente.
Similmente alle palline della analogia, le molecole dei reagenti che riescono ad interagire per dare un prodotto devono avere sufficiente energia per rompere i legami intramolecolari esistenti e formarne di nuovi. Tale energia è detta energia di attivazione. Nel grafico si vede il percorso energetico che devono compiere le molecole in gioco.
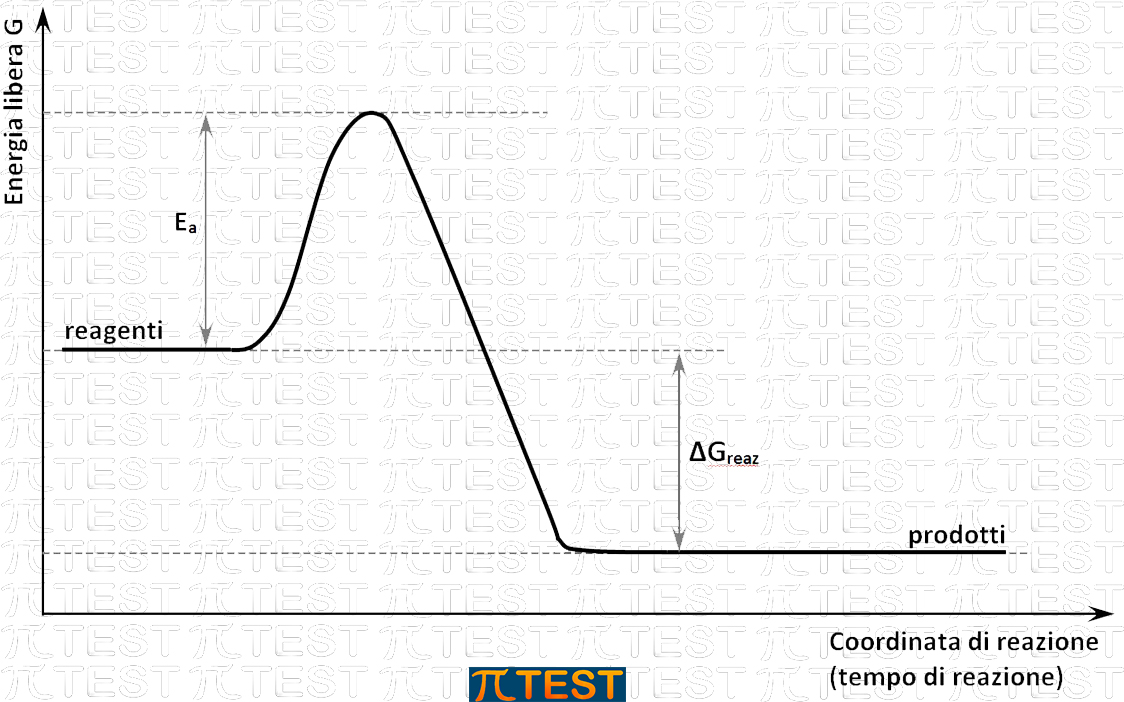
Per aumentare la velocità di reazione deve aumentare il numero di molecole che possiedono un’energia pari o superiore all’energia di attivazione. Per raggiunger questo scopo possiamo agire in due modi possibili:
- Aumentare la temperatura del sistema che comporta un aumento delle energia delle molecole;
- Abbassare l’energia di attivazione.
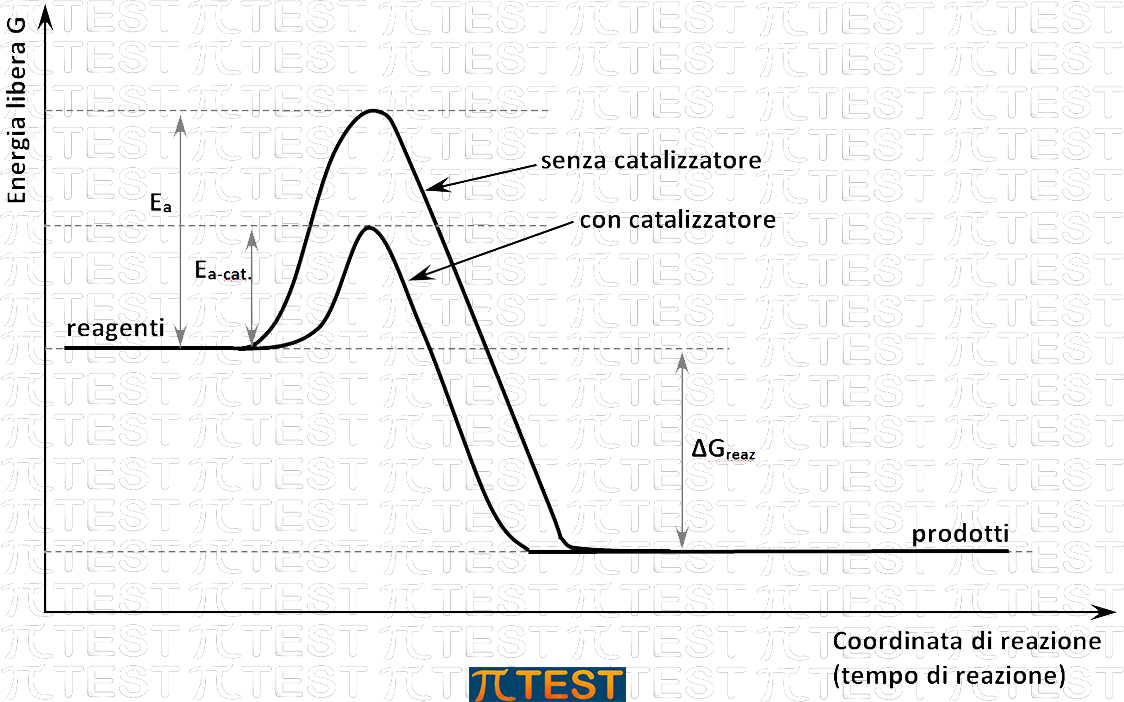
Aumentare la temperatura del sistema comporta sempre un aumento della velocità di reazione, ma può dare in alcuni casi altri inconvenienti.
Abbassare l’energia di attivazione è possibile facendo ricorso ad un catalizzatore.
Un catalizzatore è una sostanza che partecipa al meccanismo di reazione senza però comparire nel bilancio di materia e senza alterare la spontaneità della reazione (ΔG invariato).
Quando si scrive una reazione chimica che avviene in presenza di catalizzatore, questo non viene indicato né tra i reagenti né tra i prodotti in quanto non partecipa ai bilanci di materia, ma compare una indicazione nella freccia della reazione. Ad esempio nella reazione che avviene nelle marmitte catalitiche degli autoveicoli si scrive:

Grazie a questo catalizzatore i gas di scarico nocivi CO e NO vengono trasformati in CO2 e N2 , gas molto meno pericolosi.
I catalizzatori sono quasi sempre presenti nei processi metabolici degli esseri viventi e vengono chiamati enzimi. Si tratta molto spesso di proteine.
La sostanza su cui agisce un enzima è detto substrato.
Il nome degli enzimi biologici spesso termina in –asi. Ad esempio l’enzima che permette l’idrolisi del saccarosio che si scinde in glucosio e fruttosio è detta saccarasi.
 |
 |
 |
| Il substrato entra nel sito attivo dell’enzima | L’enzima facilita la reazione (idrolisi) | I prodotti abbandonano l’enzima |
© il testo e le immagini sono di esclusiva proprietà dell’autore e sono sottoposti a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito
QUIZ sui Catalizzatori |
|||
|---|---|---|---|
7.6 Cinetica Chimica – velocità di reazione


