9.6 Acidi e basi forti e deboli
Acidi e basi forti
Con il concetto di “forte” intendiamo un acido o una base che in soluzione acquosa si dissocia completamente con reazione rispettivamente di idrolisi acida o basica. Il fatto che si dissocia completamente comporta che la costante acida Ka o la costante basica Kb hanno valori molto elevati. Si considerano acidi o basi forti quando il valore della costante è superiore a 0,1.
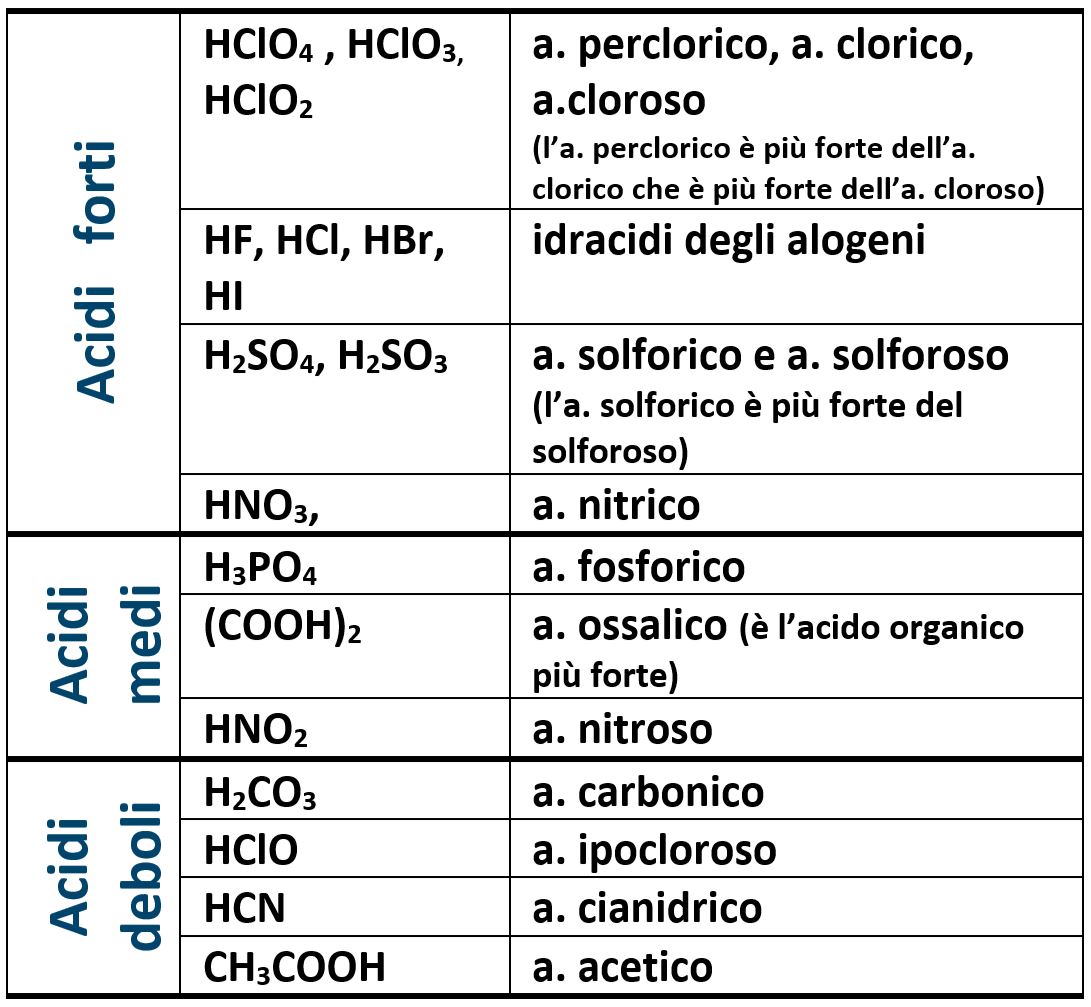
Per esempio l’acido cloridrico HCl è un acido forte perché ha una costante acida che vale 1,3·106 a 298K (25°C).
Scriviamo la reazione di idrolisi acida dell’acido cloridrico:
HCl ⇆ H+ + Cl−
Possiamo anche scriverla nella forma:
HCl + H2O ⇆ H3O+ + Cl−
La costante acida è:
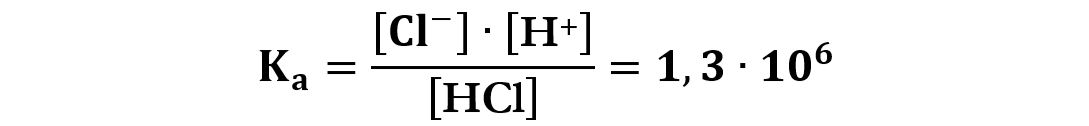
Un valore così elevato della Ka fa sì che il numeratore [H+]·[Cl−] deve essere molto grande e il denominatore [HCl] molto piccolo, questo comporta che in soluzione avremo soprattutto ioni H+ e Cl− e pochissimo acido HCl indissociato.
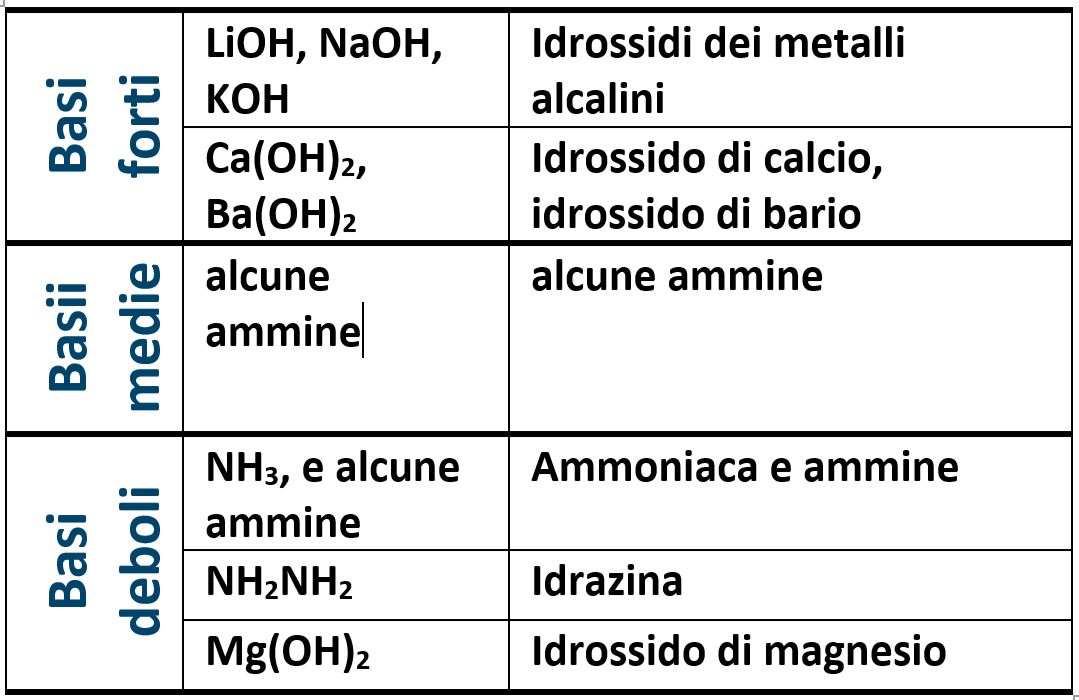
Un altro esempio è la base forte idrossido di sodio NaOH che ha una costante basica che vale 270 a 298K (25°C).
Con un ragionamento simmetrico a quello fatto per l’acido cloridrico scriviamo la reazione di idrolisi basica:
NaOH ⇆ Na+ + OH−
La costante basica è:
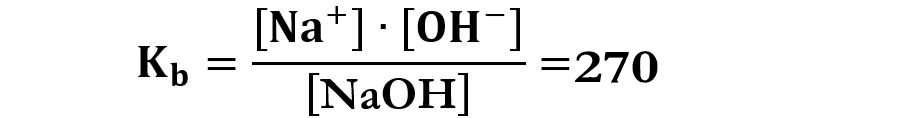 Un valore così elevato della Kb fa sì che il numeratore [Na+]·[OH−] deve essere molto grande e il denominatore [NaOH] molto piccolo, questo comporta che in soluzione avremo soprattutto ioni Na+ e OH− e pochissimo idrossido di sodio NaOH indissociato.
Un valore così elevato della Kb fa sì che il numeratore [Na+]·[OH−] deve essere molto grande e il denominatore [NaOH] molto piccolo, questo comporta che in soluzione avremo soprattutto ioni Na+ e OH− e pochissimo idrossido di sodio NaOH indissociato.
Gli ioni che si formano in soluzione da acidi e basi forti sono detti ioni spettatori. Riferendoci agli esempi visti finora lo ione cloruro Cl‒ che si forma da HCl in soluzione e lo ione sodio Na+ che si forma da NaOH in soluzione sono detti ioni spettatori in quanto non riformano quasi mai una forma indissociata ma rimangono in soluzione in forma ionica.
Acidi e basi deboli
Quando invece utilizziamo il concetto di “debole”, intendiamo il caso opposto, un acido o una base che si dissociano molto poco. Si considerano acidi o basi deboli quando il valore della costante è inferiore a 10‒4.
Per esempio l’acido acetico CH3COOH è un acido debole perché ha una costante acida che vale 1,8·10‒5 a 298K (25°C).
Scriviamo la reazione di idrolisi acida dell’acido acetico:
CH3COOH ⇆ H+ + CH3COO‒
Possiamo anche scriverla nella forma:
CH3COOH + H2O ⇆ H3O+ + CH3COO‒
La costante acida è:
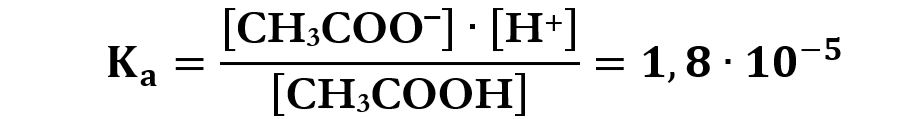
Un valore così basso della Ka fa sì che il numeratore [H+]·[ CH3COO‒] deve essere molto piccolo e il denominatore [CH3COOH] molto grande, questo comporta che in soluzione avremo pochi ioni H+ e CH3COO‒ e molto acido CH3COOH indissociato.
Un altro esempio è la base debole ammoniaca NH3 che ha una costante basica che vale 1,8·10‒5 a 298K (25°C).
Con un ragionamento simmetrico a quello fatto per l’acido acetico scriviamo la reazione di idrolisi basica:
NH3 + H2O ⇆ NH4+ + OH−
La costante basica è:
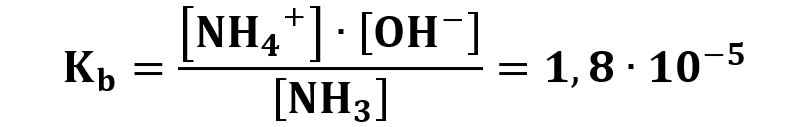
Un valore così basso della Kb fa sì che il numeratore [NH4+]·[OH−] deve essere molto piccolo e il denominatore [NH3] molto grande, questo comporta che in soluzione avremo pochi ioni NH4+ e OH− e molta ammoniaca NH3 indissociata.
Nota: il valore Ka dell’acido acetico è vicinissimo al Kb dell’ammoniaca per pura coincidenza.
Acidi e basi medi
Per valori intermedi tra 10‒4 e 10‒1 classifichiamo gli acidi e la basi come “medi”.
Ricordare i valori delle costanti acide e basiche dei composti non è richiesto per affrontare i test di ammissione all’università; è però bene ricordare alcuni acidi e alcune basi in funzione del fatto che siamo forti, medi o deboli.
Gli ioni che si formano in soluzione da acidi e basi deboli NON sono ioni spettatori ma possono reagire andando a riformare i composti indissociati.
© il testo e le immagini sono di esclusiva proprietà dell’autore e sono sottoposti a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito
9.1 Autoprotolisi
9.2 Soluzioni acide e basiche – pH
9.3 Definizione di acido e base
9.4 Acidi mono e poli-protici
9.5 Costante di equilibrio di acidi e basici
9.6 Acidi e basi forti e deboli
9.7 Rapporto tra Ka e Kb
9.8 Acidi e basi FORTI in soluzione
9.9 Diluizioni di acidi e basi forti in soluzione
9.10 Acidi e basi DEBOLI in soluzione
9.11 Neutralizzazione
9.12 Sali neutri, acidi e basici
9.13 Tamponi


