9.10 Acidi e basi DEBOLI in soluzione
Gli acidi e le basi deboli in soluzione acquosa NON si dissociano completamente ma si instaura un equilibrio più o meno spostato verso le forme dissociate in funzione del valore delle costanti di acidità / basicità.
Il calcolo del pH risultante può essere complesso, ma esiste una situazione semplificata quando si verificano certe condizioni che ora vediamo.
Iniziamo a parlare di acidi deboli.
Chiamiamo Ca la concentrazione dell’acido messo in soluzione e Ka la costante acida.
Se si verifica che:
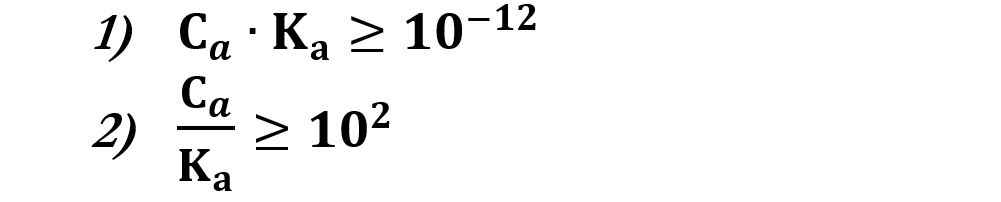
Allora possiamo calcolare la concentrazione [H+] con la formula:
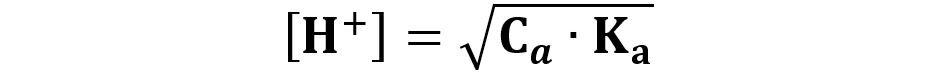 Dalla concentrazione [H+] segue il calcolo del pH.
Dalla concentrazione [H+] segue il calcolo del pH.
La verifica delle condizioni 1) e 2) per decidere se possiamo applicare la formula in un quiz può risultare molto pesante da fare; per questo motivo è lecito dare per scontato che le condizioni siano soddisfatte.
Similmente per le basi deboli abbiamo:
Chiamiamo Cb la concentrazione della base messa in soluzione e Kb la costante basica.
Se si verifica che:
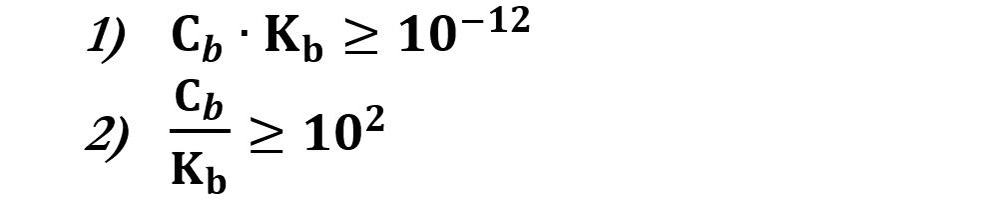
Allora possiamo calcolare la concentrazione [OH‒] con la formula:
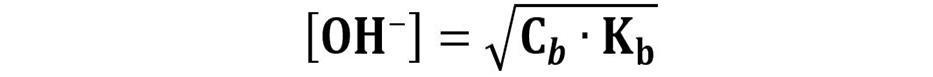 Dalla concentrazione [OH‒] segue il calcolo del pOH.
Dalla concentrazione [OH‒] segue il calcolo del pOH.
Vale la stessa considerazione fatta per gli acidi deboli: La verifica delle condizioni 1) e 2) per decidere se possiamo applicare la formula in un quiz può risultare molto pesante da fare; per questo motivo è lecito dare per scontato che le condizioni siano soddisfatte.
© il testo e le immagini sono di esclusiva proprietà dell’autore e sono sottoposti a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito
9.1 Autoprotolisi
9.2 Soluzioni acide e basiche – pH
9.3 Definizione di acido e base
9.4 Acidi mono e poli-protici
9.5 Costante di equilibrio di acidi e basici
9.6 Acidi e basi forti e deboli
9.7 Rapporto tra Ka e Kb
9.8 Acidi e basi FORTI in soluzione
9.9 Diluizioni di acidi e basi forti in soluzione
9.10 Acidi e basi DEBOLI in soluzione
9.11 Neutralizzazione
9.12 Sali neutri, acidi e basici
9.13 Tamponi


