4.2 Il legame ionico
Ricordiamo la definizione di elettronegatività come tendenza di un atomo ad attrarre verso di sé gli elettroni del guscio di valenza e di conseguenza anche degli orbitali molecolari.
Quando la differenza di elettronegatività tra i due atomi coinvolti nella formazione di un legame supera il valore di 1,7, non riesce a formarsi un orbitale molecolare, come vedremo nel prossimo paragrafo, ma piuttosto un elettrone dell’atomo meno elettronegativo viene ceduto all’atomo più elettronegativo e si formano due ioni, cioè due particelle cariche elettrostaticamente che si attraggono formando il legame ionico.
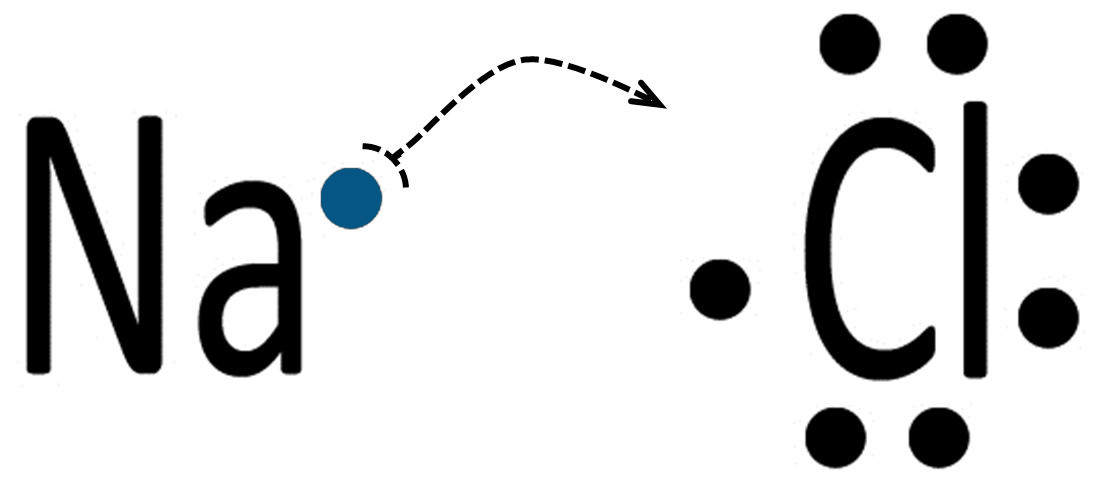
| Un atomo di sodio Na ed uno di cloro Cl possiedono una differenza di elettronegatività superiore a 1,7.
3,16 – 0,93 = 2.23 |
|
 |
|
| L’atomo di sodio cede un elettrone all’atomo di cloro e si formano il catione (ione positivo) Na+ e l’anione (ione negativo) Cl‒.
Il sodio, perdendo l’unico elettrone presente nel guscio esterno, rimane con il guscio più interno completo. Il cloro completa l’ottetto del guscio di valenza. |
|
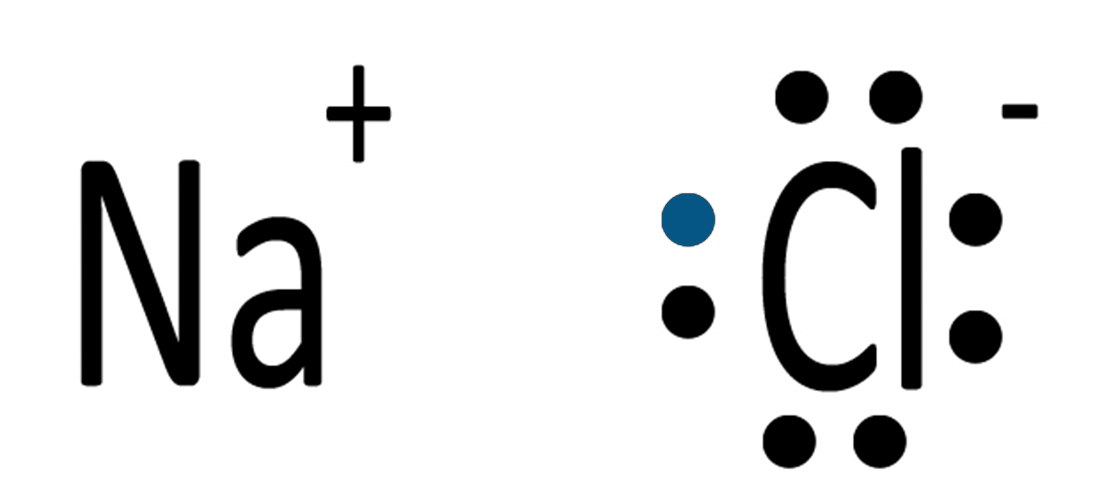 |
|
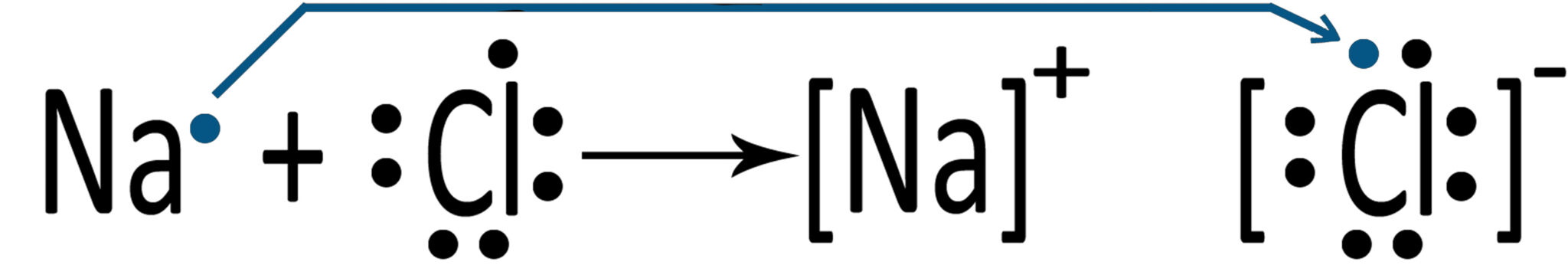
| Possiamo rappresentare la creazione di questo legame ionico nel seguente modo | |
 |
|
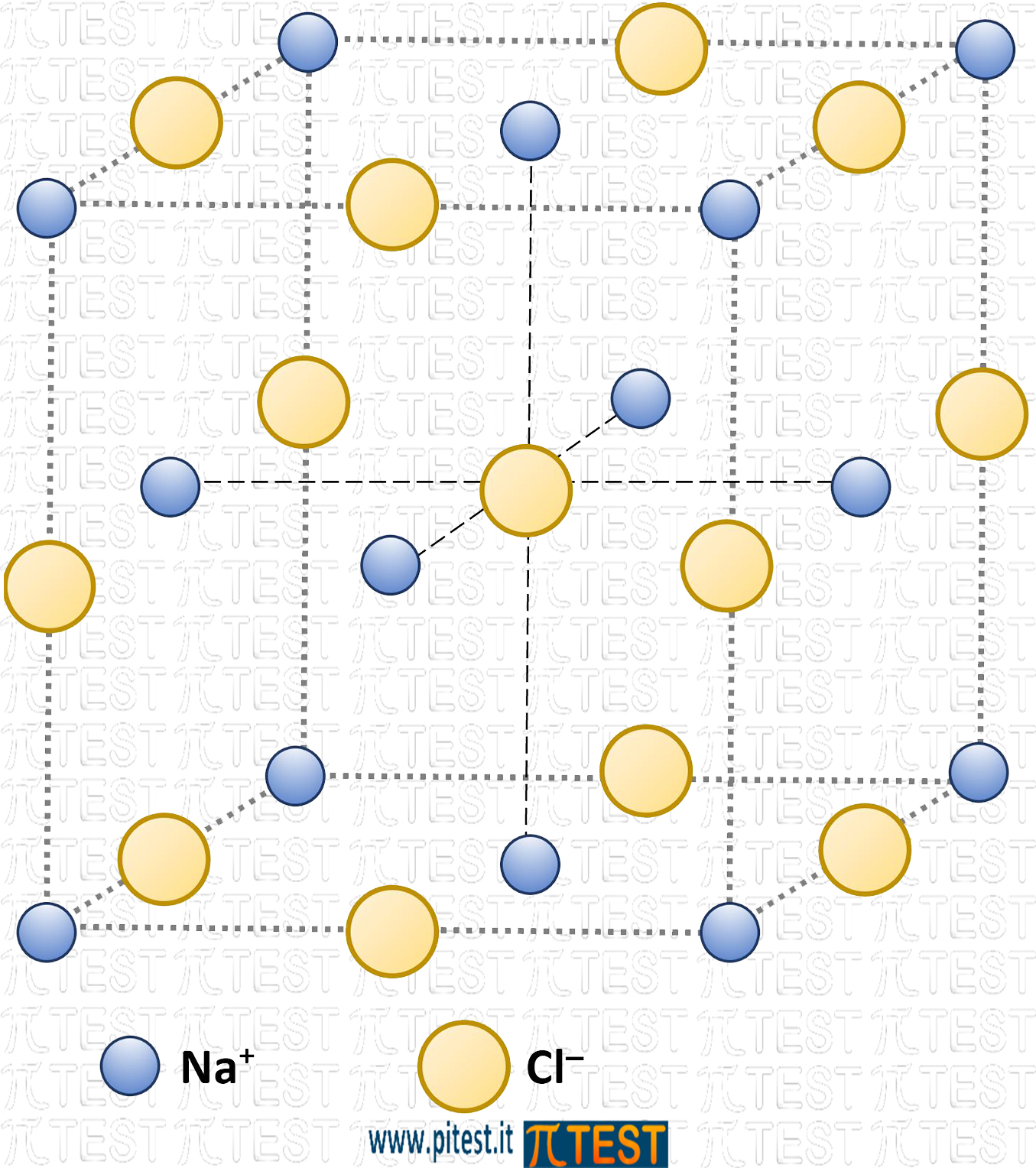
In questo tipo di sostanze gli ioni positivi (cationi) e quelli negativi (anioni) si attraggono a vicenda formando strutture cristalline.
Ciascuno ione presente in una struttura cristallina da più ioni si segno opposto. Nell’esempio del disegno qui accanto uno ione cloruro Cl‒ è attratto da sei ioni Na+ individuati dalle linee tratteggiate nel disegno; questo avviene per ciascuno ione cloruro. Simmetricamente accade per gli ioni Na+ attratti da sei ioni Cl‒.
 |
| I composti ionici sono formati da cationi (+) ed anioni (-), organizzati in strutture tridimensionali (reticolo cristallino) in cui cationi ed anioni sono disposti in maniera:
ORDINATA |
I composti dei gruppi 1 e 2 (metalli alcalini e alcalino-terrosi) formano sempre composti ionici con elementi dei gruppi 16 e 17 (alogeni) per la forte differenza di elettronegatività.
L’idrogeno H possiede una elettronegatività di 2,2 , molto più elevata di quella degli elementi del primo gruppo. Infatti non è corretto dire che l’idrogeno appartiene al primo gruppo anche se si trova allineato verticalmente con questi elementi nella tavola periodica. Si tenga conto di questo suo alto valore quando si considera la differenza di elettronegatività per stabilire se si forma un legame ionico.
Abbiamo così che l’acido cloridrico HCl non è un composto polare a differenza dei sali LiCl, NaCl e KCl.
QUIZ sul Legame ionico |
|||
|---|---|---|---|
© il testo è di esclusiva proprietà dell’autore ed è sottoposto a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito


