6.5 Ossidoriduzioni
In generale diciamo che si ossidano gli elementi che aumentano il proprio numero di ossidazione cedendo elettroni e che si riducono gli elementi che riducono il proprio numero di ossidazione acquistando elettroni. La perdita e l’acquisto di elettroni di diversi elementi avviene grazie ad uno scambio di elettroni tra le diverse specie atomiche presenti.
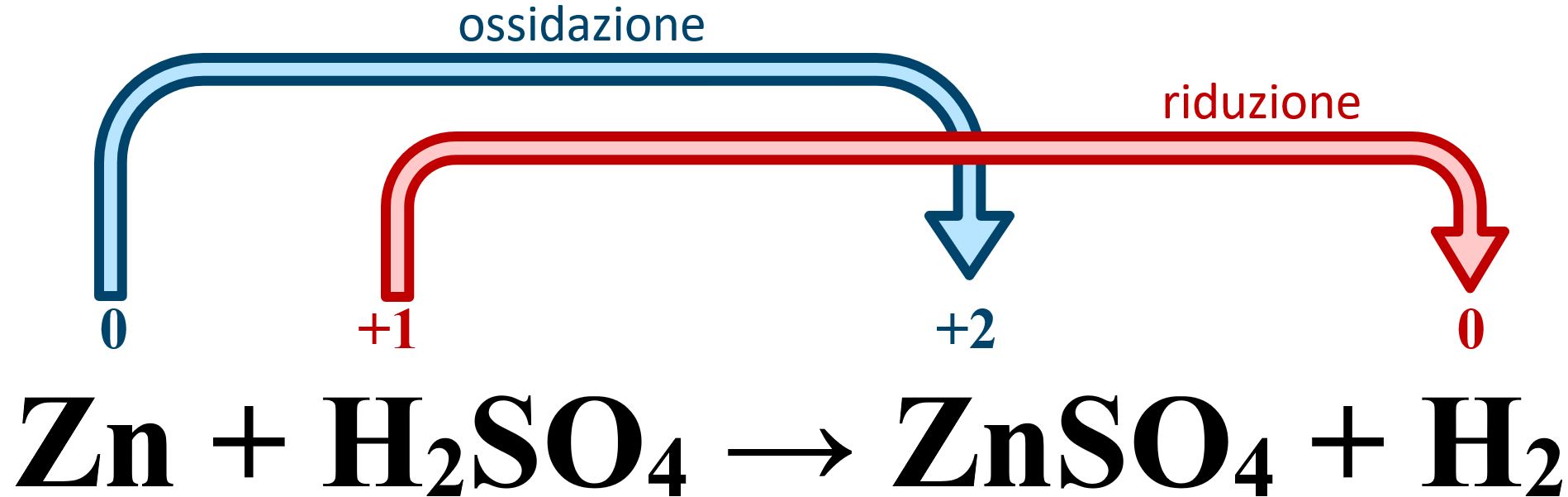
Una semplice ossidoriduzione è la seguente reazione:
Zn + H2SO4➝ ZnSO4 + H2
Lo zinco metallico Zn reagisce con l’acido solforico e viene ossidato. Passa dallo stato metallico di elemento puro nel quale assume un numero di ossidazione zero allo stato ossidato Zn2+ nel quale possiede un numero di ossidazione +2. Possiamo scrivere questa trasformazione di ossidazione così:
Zn ➝ Zn2+ +2e−
Chiamiamo questa trasformazione semi-reazione. Di contro l’idrogeno presente nell’acido solforico come H+ con numero di ossidazione +1 si trasforma in idrogeno puro gassoso H2 con numero di ossidazione zero. Scriviamo la semi-reazione di riduzione:
2 H+ + 2 e−➝ H2
Le due semi-reazioni possono avvenire perché gli elettroni ceduti dallo zinco che si ossida vengono acquistati dall’idrogeno. Lo zinco che si ossida permette all’idrogeno di ridursi e per questo lo zinco funge da agente riducente. Simmetricamente l’idrogeno che si riduce permette allo zinco di ossidarsi e per questo l’idrogeno funge da agente ossidante.
| Elemento | Semi-reazione | azione | funzione |
| Zn | Zn ➝ Zn2+ +2e− Perde elettroni |
Si ossida | Agente riducente |
| H | 2 H+ + 2 e−➝ H2 Acquista elettroni |
Si riduce | Agente ossidante |
 Alcune reazioni che sono già state classificate in altre categorie sono in realtà classificabili come ossidoriduzioni.
Alcune reazioni che sono già state classificate in altre categorie sono in realtà classificabili come ossidoriduzioni.
Tutte le combustioni sono anche ossidoriduzioni. Ad esempio nella combustione del metano
CH4 + O2 → CO2 + 2H2O
il carbonio passa dallo stato di ossidazione -4 nel metano CH4 allo stato +4 nell’anidride carbonica CO2.
QUIZ su Ossidoriduzioni |
|||
|---|---|---|---|


