6.5 Ossidoriduzioni
QUIZ 06
Veterinaria 2020
Nel corso di una reazione chimica, il rame metallico reagisce con una soluzione acquosa di HClO4 per produrre Cu(ClO4)2 in soluzione acquosa e idrogeno allo stato gassoso che si libera nell’ambiente.
In questa reazione la specie che si comporta da riducente è:
Dobbiamo avere una certa esperienza con le reazioni chimiche per riuscire a scrivere la corretta reazione chimica. Iniziamo col riportare tra i reagenti ed i prodotti le sostanza citate dal testo:
 Non c’è bisogno di bilanciare la reazione (1) in quanto la richiesta del quiz verte sull’individuare quale specie si comporta da riducente (ovvero si ossida).
Non c’è bisogno di bilanciare la reazione (1) in quanto la richiesta del quiz verte sull’individuare quale specie si comporta da riducente (ovvero si ossida).
Scriviamo sopra i singoli elementi il numero di ossidazione che possiedono all’interno dei diversi composti/stato puro. Dovremo seguire le regole dei numeri di ossidazione che determinano la formazione dei composti (2).
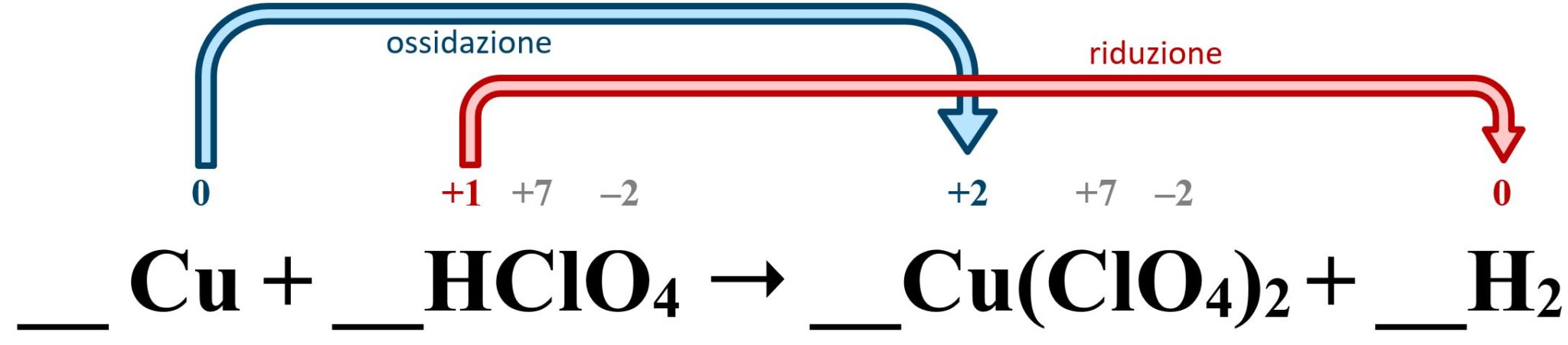
Dal punto di vista delle ossidazioni e delle riduzioni abbiamo:
Il rame metallico (puro) si ossida passando dal numero di ossidazione 0 al valore +2 (rame rameico); ossidandosi funge da agente riducente, ovvero permette all’idrogeno di ridursi.
L’idrogeno legato (nell’acido) si riduce passando dal numero di ossidazione +1 al valore 0 (idrogeno puro); riducendosi funge da agente ossidante, ovvero permette al rame metallico di ossidarsi.
La risposta corretta è pertanto la D)
Note (1)
Per chi volesse bilanciare la reazione, a titolo di esercizio e non al fine di risolvere il quiz, segue il bilanciamento:
Iniziamo dai metalli e non-metalli seguendo poi con ossigeno e idrogeno.
Per il rame la reazione si bilancia coni coefficienti stechiometrici 1 e 1 per il rame metallico Cu e per il perclorato rameico Cu(ClO4)2 :

Osserviamo che sono prodotti due atomi dell’elemento cloro in Cu(ClO4)2 , bilanciamo perciò con il coefficiente 2 l’acido perclorico HClO4 :

L’ossigeno risulta bilanciato perché troviamo otto atomi dell’elemento tra i reagenti e tra i prodotti.
Per l’idrogeno troviamo tra i reagenti due atomi dell’elemento, bilanciamo perciò con il coefficiente 1 per il prodotto H2 :

(2)
Le principali regole dei numeri di ossidazione sono:
- il numero di ossidazione di tutte le sostanze elementari è uguale a zero (es. Na, Mg, Fe hanno n.o. zero e così pure ogni atomo delle molecole degli elementi, come H2, O2, Cl2, S8);
- in tutti i composti l’ossigeno ha numero di ossidazione −2 (es. MgO), ad eccezione dei perossidi nei quali il n.o. è −1 (es. H2O2, Na2O2);
- in tutti i composti l’idrogeno ha numero di ossidazione +1 (es. HCl, H2O), ad eccezione degli idruri nei quali il n.o. è −1 (LiH, CuH);
- nelle molecole neutre la somma algebrica dei numeri di ossidazione dei singoli atomi è uguale a 0 (es. nell’acqua H2O l’idrogeno ha n.o. +1 x 2 atomi = +2 e l’ossigeno ha n.o. −2 x 1 atomo = −2, quindi +2 −2 = 0);
- gli ioni monoatomici hanno numero di ossidazione uguale alla carica dello ione (es. lo ione rame Cu2+ ha n.o. +2);
- in uno ione poliatomico la somma algebrica dei numeri di ossidazione di tutti gli atomi è uguale alla carica dello ione (es. SO42- ha la somma dei n.o. = −2).
- i metalli hanno solo numeri di ossidazione positivi;
- i non metalli possono avere numeri di ossidazione positivi o negativi;
- gli elementi del primo gruppo (metalli alcalini) hanno sempre n.o. = +1;
- gli elementi del secondo gruppo (metalli alcalino-terrosi) hanno sempre n.o. = +2;
- gli elementi del terzo gruppo hanno sempre n.o. = +3.
- i gruppi pari hanno sempre n.o. pari, quelli dispari (tranne l’azoto) sempre dispari;
- nel quarto gruppo il carbonio ha n.o. = –4, +4 e +2; il silicio –4 e +4; stagno e piombo +4 e +2;
- nel quinto gruppo l’azoto ha n.o. = –3, +1, +2, +3, +4 e +5; il fosforo –3, +3 e +5;
- nel sesto gruppo l’ossigeno ha praticamente sempre –2, lo zolfo ha –2, +4 e +6;
- nel settimo gruppo il fluoro ha sempre –1; gli altri elementi hanno tutti –1, e possono avere i valori +1, +3, +5 e +7;
- gli elementi di transizione non seguono regole particolari, per cui si rinvia alla tavola periodica o alla tabella dei numeri di ossidazione
QUIZ su Ossidoriduzioni |
|||
|---|---|---|---|
© il testo è di esclusiva proprietà dell’autore ed è sottoposto a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito


