10.6.11 LIVELLI DI OSSIDAZIONE DELLE MOLECOLE ORGANICHE
CALCOLO DEL NUMERO DI OSSIDAZIONE DEL CARBONIO NELLE MOLECOLE ORGANICHE
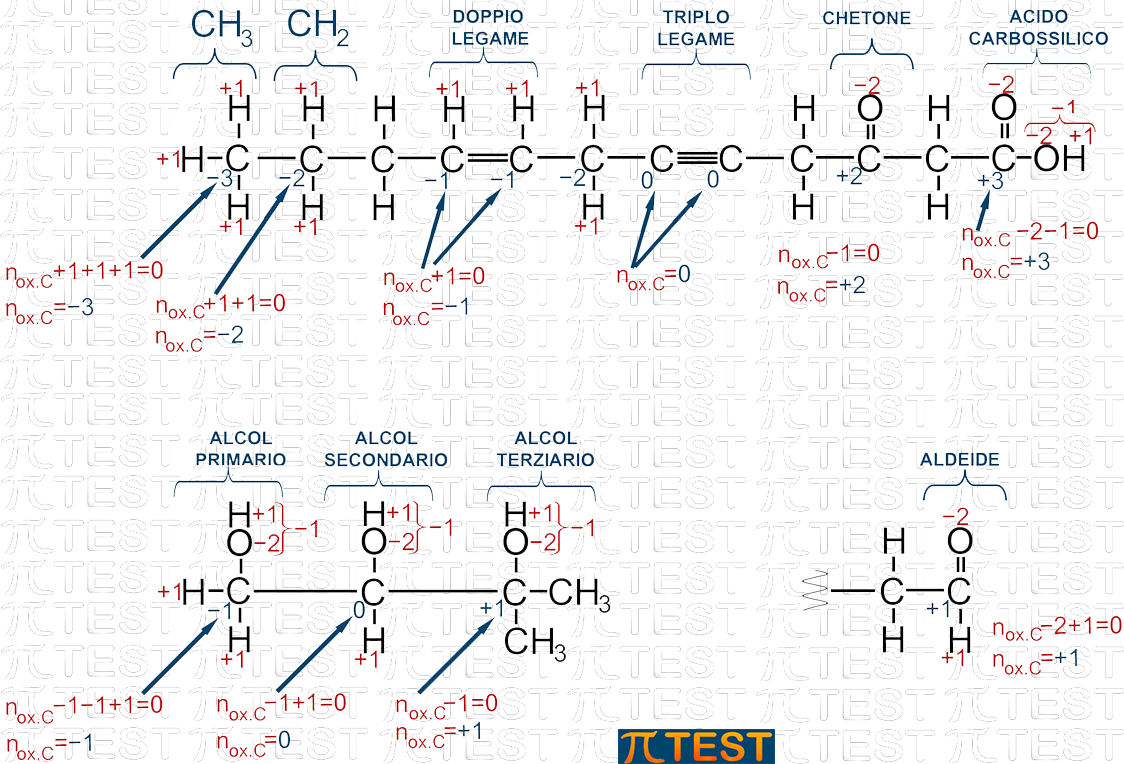 Nella chimica inorganica abbiamo visto l’uso del numero di ossidazione dei diversi atomi che compongono una molecola; in particolare abbiamo visto la regola in base alla quale la somma di tutti i numeri di ossidazione di tutti gli atomi di una stessa molecola debba valere zero se la molecola è neutra, o debba valere il numero di carica ionica se la molecola è uno ione.
Nella chimica inorganica abbiamo visto l’uso del numero di ossidazione dei diversi atomi che compongono una molecola; in particolare abbiamo visto la regola in base alla quale la somma di tutti i numeri di ossidazione di tutti gli atomi di una stessa molecola debba valere zero se la molecola è neutra, o debba valere il numero di carica ionica se la molecola è uno ione.
In chimica organica, in presenza di catene carboniose si valuta il numero di ossidazione di ciascun atomo di carbonio singolarmente. Al legame con altri atomi di carbonio si attribuisce convenzionalmente un valore nullo.
Nella figura precedente sono rappresentate, a titolo esemplificativo, alcune catene carboniose nelle quali sono presenti diverse situazioni.
- Iniziando dall’alto a sinistra si incontra prima un gruppo CH3− nel quale il carbonio possiede numero di ossidazione −3; tale valore si ottiene per compensare la presenza di tra atomi di idrogeno il cui numero di ossidazione è +1; poiché la somma dei numeri di ossidazione di tutti gli atomi presenti deve essere zero, si determina il numero di ossidazione del carbonio −3.
- Segue, andando verso destra nella figura, −CH2− ; il numero di ossidazione del carbonio è −2 per ragionamento simile.
- Continuando sempre verso destra incontriamo i due atomi di carbonio coinvolti in un doppio legame il cui numero di ossidazione risulta −1.
- Continuando ancora incontriamo i due atomi di carbonio coinvolti in un triplo legame il cui numero di ossidazione risulta 0.
- Incontriamo poi un gruppo carbossilico di un chetone −CO−. In questo caso il numero di ossidazione è +2.
- Infine troviamo il gruppo carbossilico di un acido organico −COOH il cui numero di ossidazione è +3.
- Nella parte bassa della figura incontriamo una serie carboniosa che presenta sul primo atomo di carbonio un gruppo alcolico −OH. Si tratta di un alcol primario CH2OH−. Il numero di ossidazione del carbonio è −1.
- Segue un alcol secondario con il gruppo alcolico −OH collegato ad un carbonio secondario −CHOH−. Il numero di ossidazione del carbonio è 0.
- Troviamo per ultimo un alcol terziario nel quale il gruppo alcolico −OH è legato ad un carbonio terziario (atomo di carbonio legato ad altri tra atomi di carbonio). Il numero di ossidazione del carbonio è +1.
- In basso a destra della figura troviamo una aldeide −CHO. L’atomo di carbonio del carbossile è legato a sinistra ad un radicale organico e ad un atomo di idrogeno. Il numero di ossidazione del carbonio è +1.
VALORI ESTREMI
I valori minimi e massimi del numero di ossidazione del carbonio si hanno:
Il valore minimo è −4 e si ha nel metano CH4.
Il valore massimo è +4 e si ha nell’anidride carbonica CO2.
OSSIDAZIONE E RIDUZIONE DELLE MOLECOLE ORGANICHE
Nello studio delle diverse famiglie di composti abbiamo visto reazioni tipiche che portano a cambiare i gruppi funzionali da uno all’altro.
Le reazioni che portano ad una variazione del numero di ossidazione degli atomi di carbonio sono classificate ossidazioni e riduzioni quando il numero di ossidazione aumenta o diminuisce, allo stesso modo di quanto si fa in chimica inorganica.
Consideriamo un percorso di crescente ossidazione partendo dal metano.
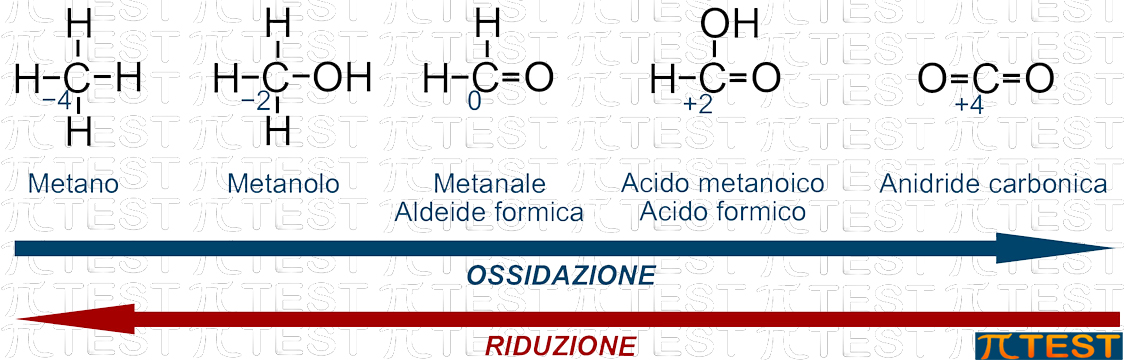
Consideriamo un percorso di crescente ossidazione partendo da un alcano.
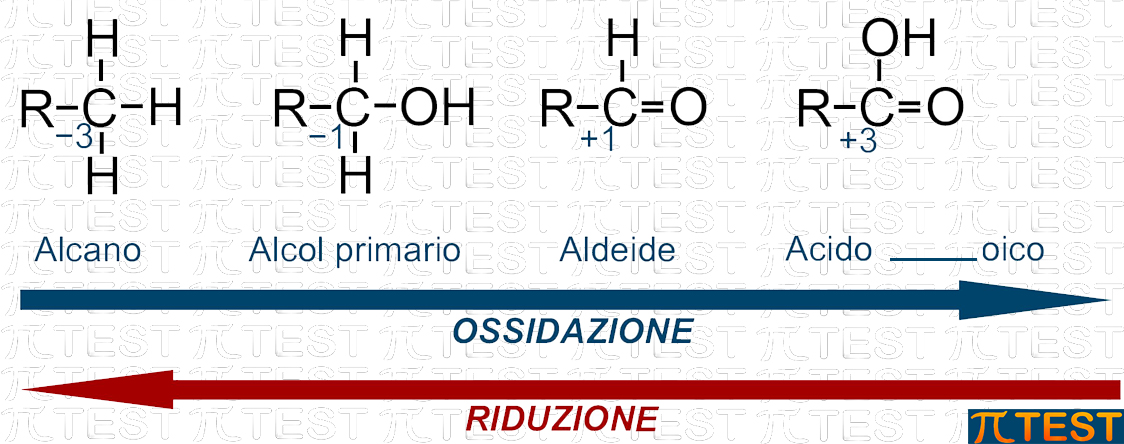
Se ossidiamo un carbonio primario, otterremo dapprima un alcol primario; proseguendo su una via di ossidazione avremo poi una aldeide ed infine un acido carbossilico.
Se invece ossidiamo un carbonio secondario, otterremo dapprima un alcol secondario; proseguendo su una via di ossidazione avremo poi un chetone. Qui ci fermiamo perché dall’ossidazione di un chetone non si può avere con immediatezza un acido carbossilico come quando ossidiamo un carbonio primario.
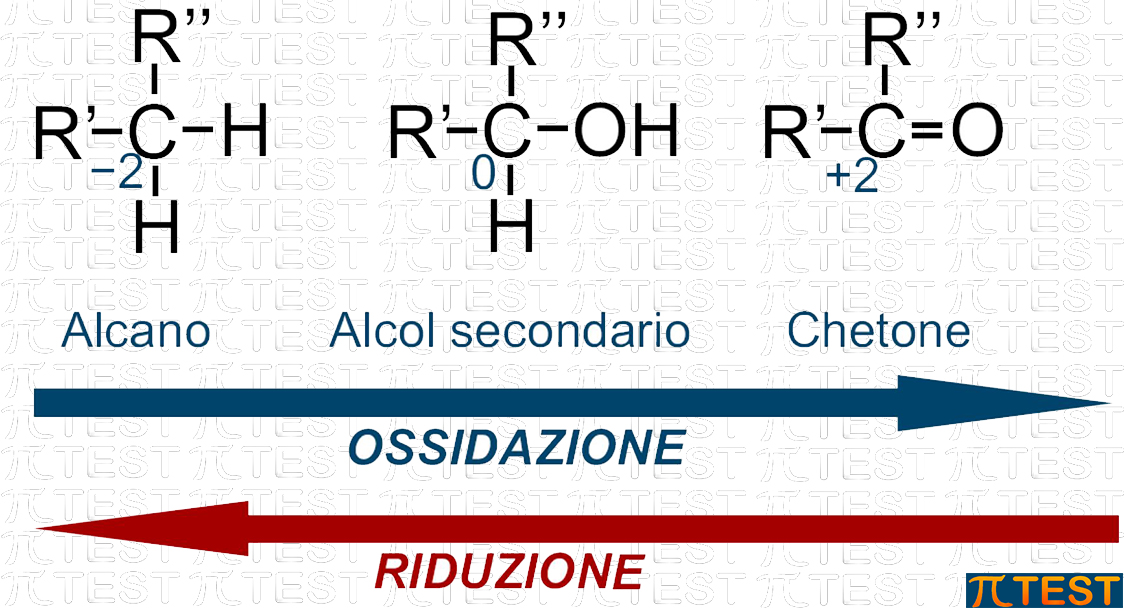
Tutti i percorsi di crescente ossidazione che abbiamo visto possono essere percorsi in senso inverso procedendo come riduzioni.
BLANDA OSSIDAZIONE E OSSIDAZIONE TOTALE
Le ossidazioni che abbiamo esaminato nelle pagine precedenti non sono combustioni ma ossidazioni incomplete e blande delle molecole organiche.
Nei quiz di ammissione quando si parla di “blanda ossidazione di…” si intendono appunto le progressive ossidazioni viste in questo capitolo.
Invece una ossidazione completa di una molecola organica binaria, composta da carbonio e idrogeno, o ternaria, composta da carbonio, idrogeno e ossigeno, produce alla fine sempre soltanto anidride carbonica ed acqua. Si tratta di reazioni di combustione. Vediamo alcuni esempi.
| CH4 + 2 O2 → CO2 + 2 H2O | combustione del metano |
| C2H5OH + 3 O2 → 2 CO2 + 3 H2 | combustione dell’etanolo |
| C3H8O3 + 5 O2 → 3 CO2 + 4 H2O | combustione del glicerolo |
| C6H12O6 + 6 O2 →6 CO2 + 6 H2O | combustione del glucosio |
ENERGIA CHIMICA DI UNA MOLECOLA
Una molecola organica possiede tanta più energia quanto più possiede atomi di carbonio ridotti, cioè con basso numero di ossidazione. Durante l’ossidazione la molecola libera la propria energia chimica. Una liberazione veloce di energia si ha nella combustione. Una liberazione lenta e controllata si ha nei cicli di catabolismo organico nei quali l’energia genera altre molecole a loro volta ricche di energia che entrano in gioco in altri processi anabolici o comunque vitali.
La combustione del metano è il processo a maggior contenuto energetico in quanto il carbonio si presenta con uno stato ossidativo −4 nel metano e conclude l’ossidazione con uno stato +4 nell’anidride carbonica.
![]()
Ossidazione del glucosio. Rispetto alla ossidazione del metano gli atomi di carbonio del glucosio hanno un numero di ossidazione più alto e liberano una minor energia. Nel caso di un processo di combustione la reazione è veloce (similemente alla combustione del metano); nel caso di ossidazione catabolica nel ciclo di krebs (catabolismo dei carboidrati) si producono molecole di ATP che sono le unità energetiche utili in usi biologici seguenti.
![]()
Se confrontiamo molecole biologiche ricche di energia utilizzate dall’uomo e in generale dalle forme animali, possiamo osservare che i carboidrati possiedono mediamente atomi di carbonio con numero di ossidazione pari a zero, mentre i grassi o lipidi (acidi grassi, trigliceridi, ecc) possiedono atomi di carbonio con numero di ossidazione negativo.
I lipidi durante il catabolismo liberano più energia in quanto è più alto il salto ossidativo verso il valore +4 del prodotto finale CO2.
Deduciamo che a fini energetici è più ricco di energia una stessa quantità in massa di grasso piuttosto che di un carboidrato.
© il testo è di esclusiva proprietà dell’autore ed è sottoposto a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito
CONTINUA LO STUDIO DELLA CHIMICA ORGANICA
10.1 Idrocarburi
10.2 Idrocarburi alifatici
10.2.1 Idrocarburi alifatici saturi: gli ALCANI
10.2.2 Radicali alchilici
10.2.3 Idrocarburi ramificati
10.2.4 Proprietà fisiche e chimiche degli alcani
10.2.5 Idrocarburi insaturi: ALCHENI
10.2.6 Proprietà fisiche e chimiche degli alcheni
10.2.7 Idrocarburi insaturi: ALCHINI
10.2.8 Proprietà fisiche e chimiche degli alchini
10.2.9 POLIENI
10.2.10 CICLOALCANI, CICLOALCHENI E COCLOALCHINI
10.2.11 Composti ETEROCICLICI SATURI
10.3 Gli isomeri
10.3.1 Isomeri COSTITUZIONALI DI CATENA
10.3.2 Isomeri COSTITUZIONALI DI POSIZIONE
10.3.3 Isomeri COSTITUZIONALI DI FUNZIONE
10.3.4 Stereoisomeri CONFORMAZIONALI
10.3.5 Stereoisomeri CONFIGURAZIONALI GEOMETRICI
10.3.6 Stereoisomeri CONFIGURAZIONALI OTTICI
10.4 IDROCARBURI AROMATICI
10.4.1 BENZENE
10.4.2 I PRINCIPALI COMPOSTI AROMATICI DERIVANTI DAL BENZENE ‒ ARENI
10.4.3 IDROCARBURI POLICICLICI AROMATICI
10.4.4 COMPOSTI ETEROCICLICI INSATURI
10.5 ADDIZIONE E SOSTITUZIONE ELETTROFILA
10.5.1 ADDIZIONE ELETTROFILA
10.5.2 SOSTITUZIONE ELETTROFILA
10.6 GRUPPI FUNZIONALI
10.6.1 ALOGENURI ALCHILICI E ARILICI
10.6.3 ALCOLI
10.6.4 Proprietà fisiche e chimiche e preparazione degli ALCOL
10.6.5 POLIALCOLI (POLIOLI)
10.6.6 ETERI
10.6.7 CARBONILE – ALDEIDI E CHETONI
10.6.8 CARBOSSILE – ACIDI ORGANICI
10.6.9 ANIDRIDI
10.6.10 ESTERI
10.6.11 LIVELLI DI OSSIDAZIONE DELLE MOLECOLE ORGANICHE
10.6.12 SAPONIFICAZIONE
10.6.13 FOSFOLIPIDI
10.6.14 LIPIDI O GRASSI
10.6.15 AMMINE
10.6.16 AMMIDI
10.6.17 AMMINOACIDI – PROTEINE
10.7 POLIMERI
10.8 CARBOIDRATI


