7.2 Le grandezze della termodinamica
Energia interna U
L’energia interna U di un sistema termodinamico è data dalla somma di tutte le energie, cinetica e potenziale delle particelle che lo compongono. Come ogni altra forma di energia si misura in Joule.
È una funzione di stato, cioè le sue variazioni dipendono solo dallo stato iniziale e finale della trasformazione termodinamica e non dal particolare percorso seguito per arrivare dallo stato iniziale allo stato finale.
Per un gas perfetto l’energia interna è legata solamente all’energia cinetica delle molecole la quale a sua volta è legata solamente alla temperatura del gas espressa in Kelvin.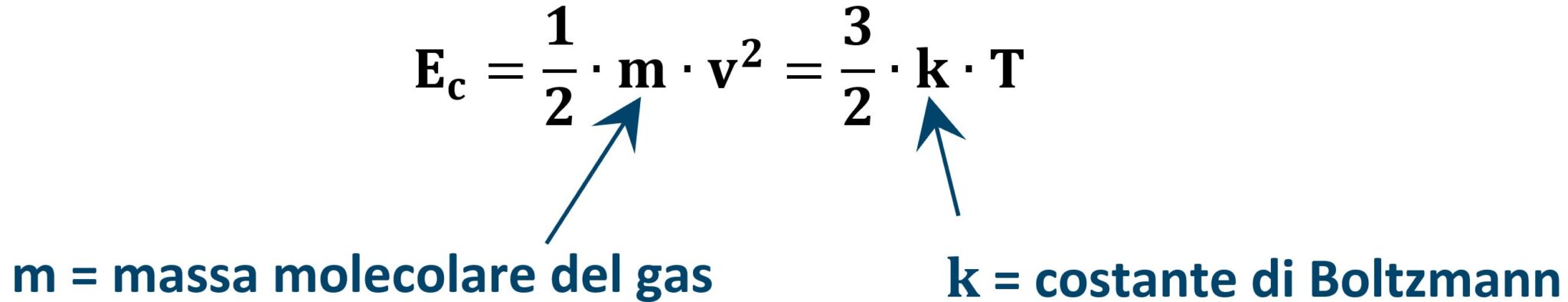
Ne consegue che l’unico modo che un gas (perfetto) ha per aumentare la sua energia interna e quello di aumentare la sua temperatura.
Entalpia H
reazioni endotermiche ed esotermiche
Si definisce un’altra grandezza che ha le dimensioni fisiche dell’energia ed è la combinazione di altre grandezze che sono tutte funzioni di stato, U, P e V.
H = U + P·V
L’ Entalpia H è una forma di energia posseduta dal sistema.
Rappresenta il calore scambiato a pressione costante. Poiché la pressione si mantiene quasi sempre costante durante le reazioni chimiche che avvengono sulla superficie della terra, l’entalpia è la grandezza termodinamica utilizzata per valutare il calore di reazione.
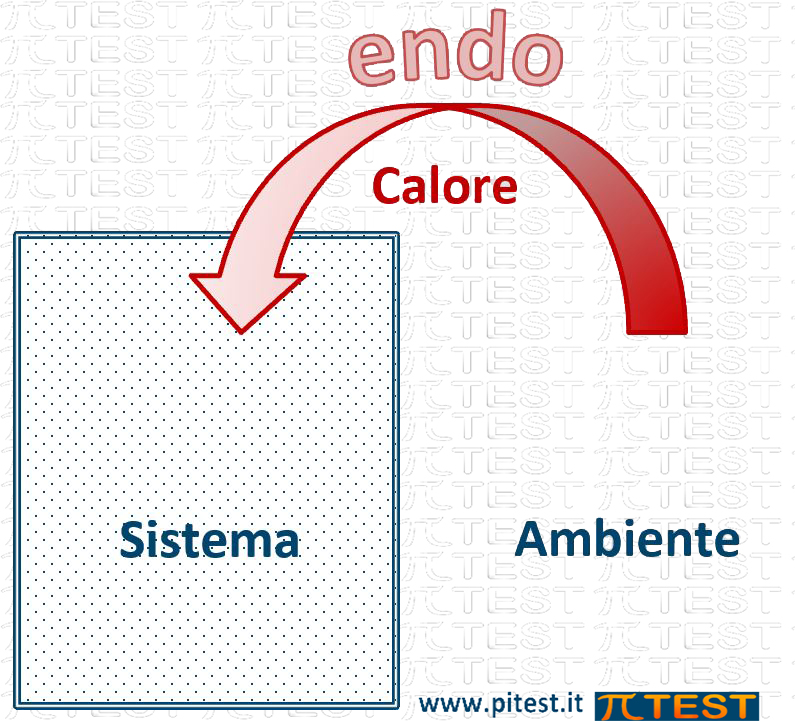
| Se il sistema assorbe energia dall’esterno, allora la sua Entalpia aumenta ΔH > 0 La reazione è endotermica |
||
 |
||
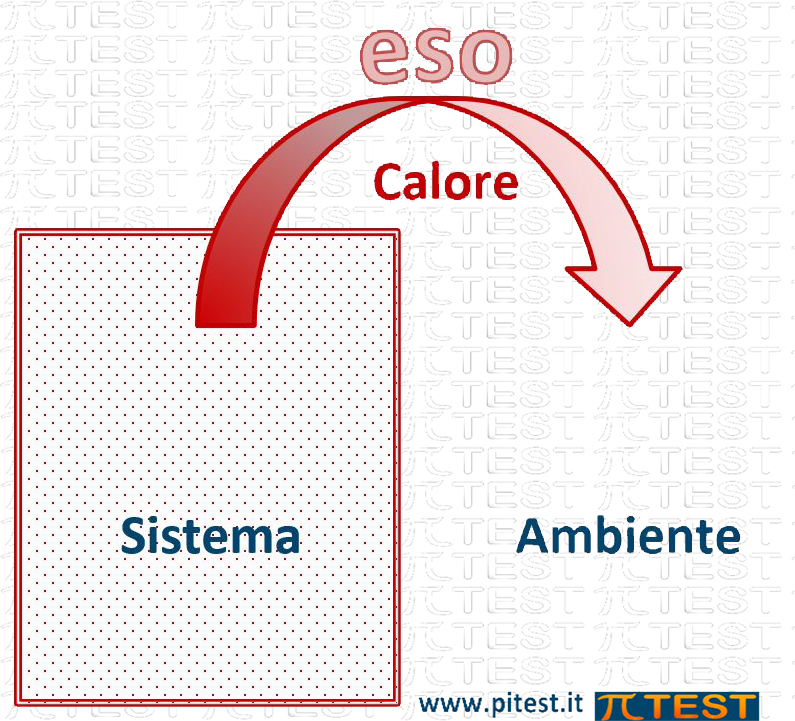
| Se il sistema cede energia all’esterno, allora la sua Entalpia diminuisce ΔH < 0 La reazione è esotermica |
||
 |
||
Le reazioni che comportano un assorbimento del calore dall’ambiente verso il sistema fanno aumentare l’energia del sistema ed hanno perciò ΔH>0 e sono dette endotermiche (“endo”=verso il dentro); al contrario le reazioni che comportano una cessione di calore dal sistema verso l’ambiente fanno diminuire l’energia del sistema ed hanno perciò ΔH<0 e sono dette esotermiche (“eso”=verso il fuori).
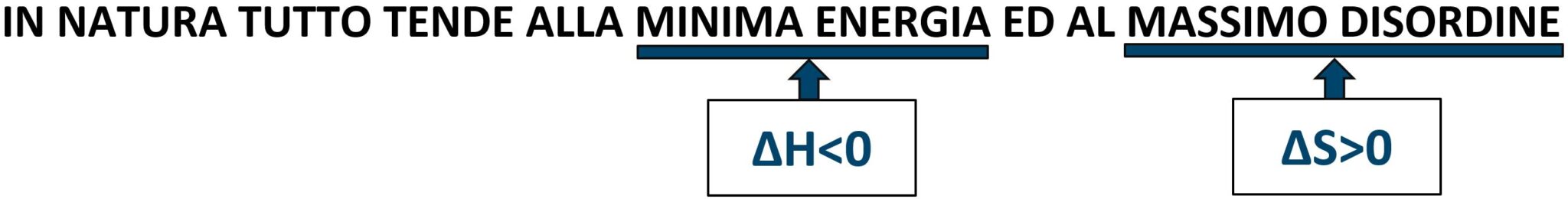
Una fondamentale legge della natura afferma che:
IN NATURA TUTTO TENDE ALLA MINIMA ENERGIA.
Questo si traduce dicendo che:
ΔH < 0 avviene spontaneamente
Entropia S
Una nuova grandezza che studiamo è l’Entropia S. È una grandezza complessa da studiare e ci limitiamo ad un uso minimo.
L’entropia S è un modo di rappresentare il disordine posseduto da un sistema.
|
Ad esempio la fase solida di una sostanza rappresenta uno stato più ordinato della fase gassosa. |
|
 |
 |
| Solido Sistema più ordinato |
Gas Sistema più disordinato |
Il Secondo Principio della Termodinamica afferma che:
IN NATURA TUTTO TENDE AL MASSIMO DISORDINE
Questo si traduce dicendo che:
ΔS > 0 avviene spontaneamente
Possiamo capire questo immaginando un sistema formato da due gas inizialmente contenuti in modo da essere separati in contenitori diversi. Si aprirà poi un varco che mette i due gas in comunicazione. I due gas si mescoleranno creando spontaneamente un sistema più disordinato.
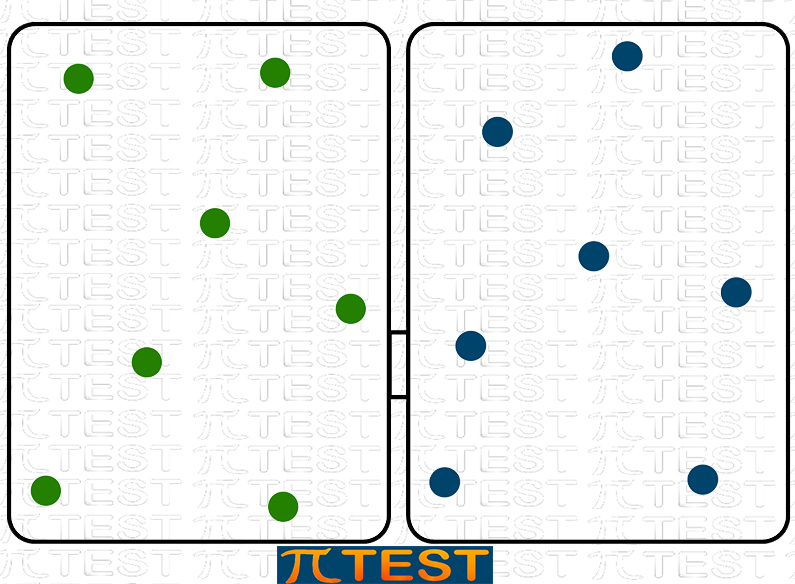 |
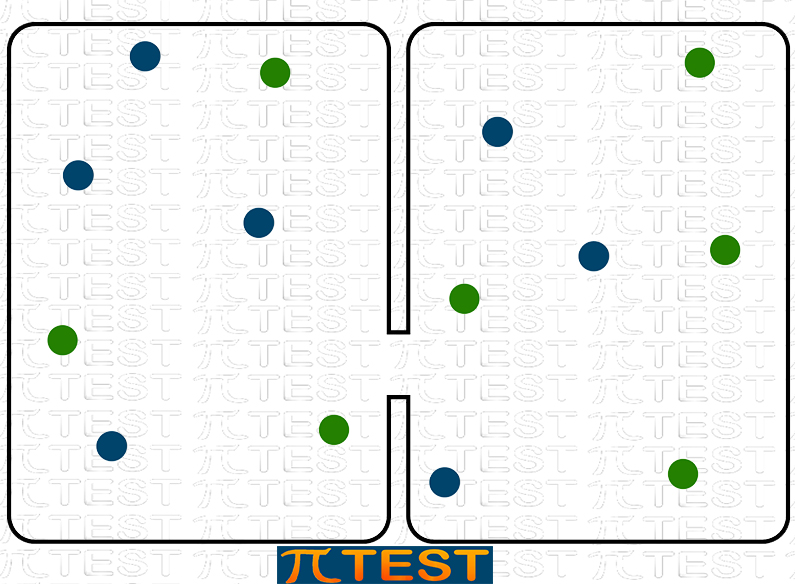 |
| Due gas mantenuti separati Sistema più ordinato |
Due gas mescolati Sistema più disordinato |
Energia libera di Gibbs
Abbiamo visto due grandi tendenze della natura: la tendenza alla minima energia e la tendenza al massimo disordine. Possiamo riunirle dicendo che:
Il chimico Gibbs riunì le due grandezze entalpia H ed entropia S in una nuova grandezza che chiamiamo Energia Libera di Gibbs G.
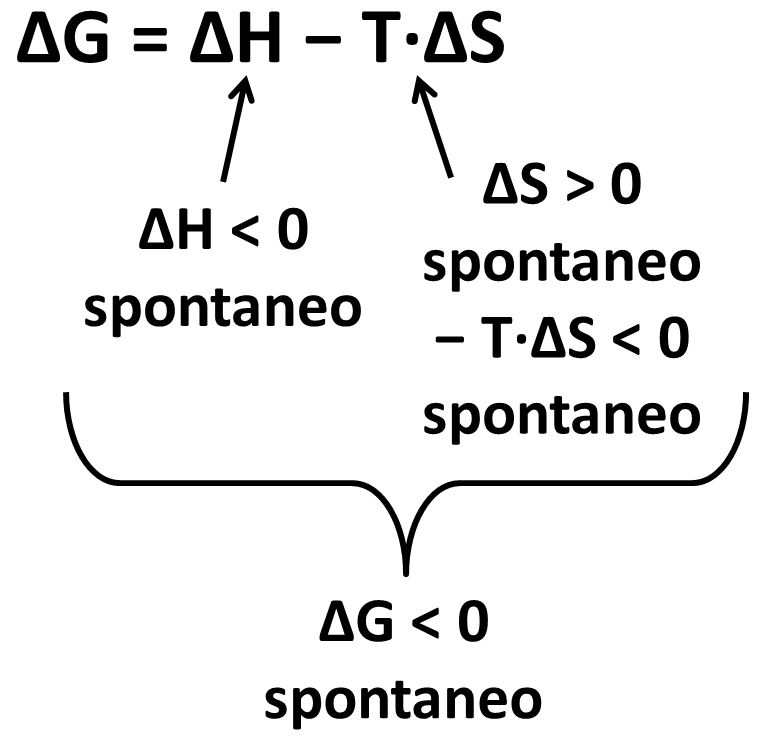
Le variazioni di G sono legate alle variazioni di H e di S dalla relazione:
ΔG = ΔH − T·ΔS
T è la temperatura assoluta espressa in Kelvin. Il segno meno davanti al termine entropico T·ΔS serve a raccordare il segno (negativo o positivo) con il termine entalpico ΔH.
La possibilità che una reazione avvenga secondo natura, ovvero in osservanza delle tendenze alla minima energia ed al massimo disordine, si esprime con il concetto di spontaneità della trasformazione del sistema ed è legata al segno negativo di ΔG.
Alla spontaneità di una trasformazione contribuiscono:
- valori negativi di ΔH che si hanno con trasformazioni esotermiche
- valori positivi di ΔS che si hanno con trasformazioni che aumentano lo stato di disordine; il valore positivo cambia segno perché T·ΔS è preceduto dal segno meno.
L’energia libera di Gibbs G ha le dimensioni fisiche dell’energia (si misura in Joule o in J/mole (mole se ci riferiamo ad una mole di sostanza). Immaginiamo G come una forma particolare di energia che il sistema può perdere o acquistare:
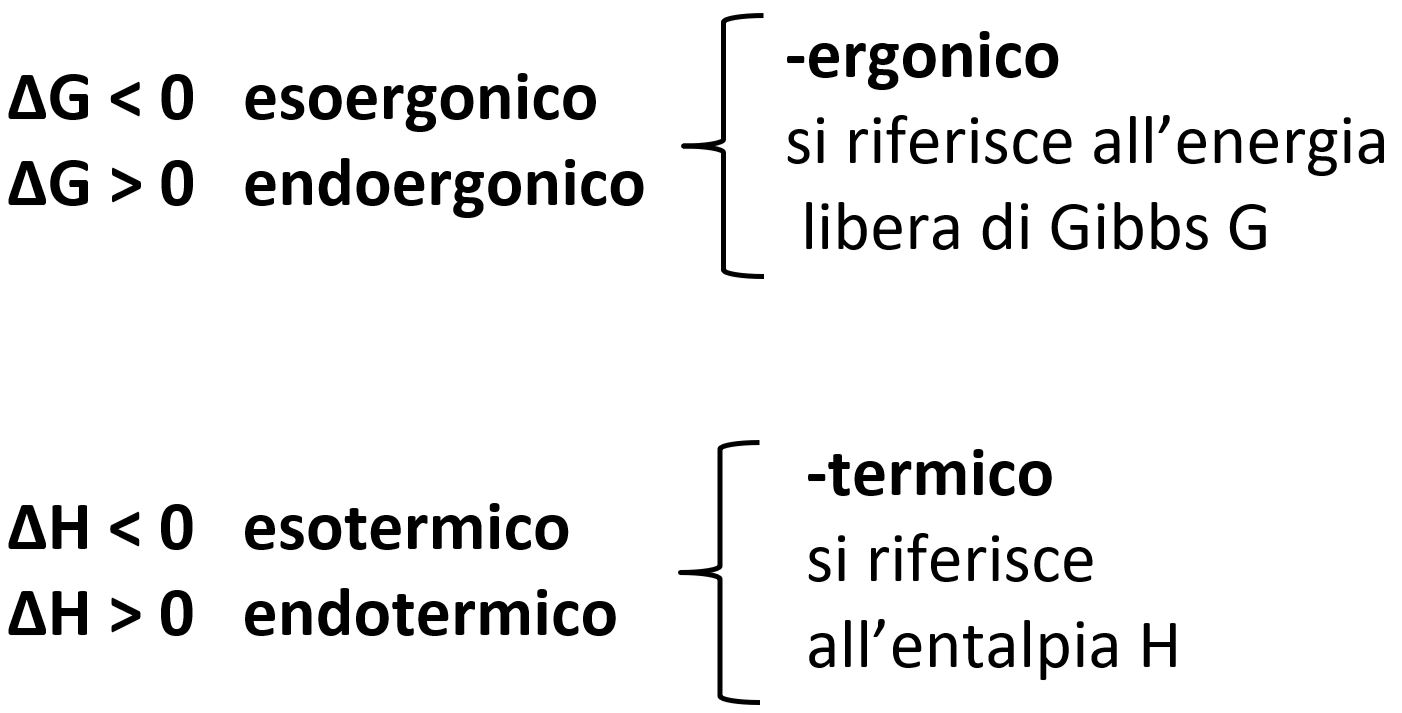
- Se il sistema perde energia libera, il suo valore di G diminuisce (ΔG<0) e la trasformazione è spontanea. Chiamiamo questa reazione eso-ergonica in quanto G viene ceduto dal sistema verso l’ambiente esterno ( –eso-)
- Se il sistema acquista energia libera, il suo valore di G aumenta (ΔG>0) e la trasformazione non è spontanea. Chiamiamo questa reazione endo-ergonica in quanto G viene acquistato dall’ambiente esterno sistema verso il sistema( –endo-).
|
TERMINOLOGIA Non confondiamo i termini esoergonico ed endoergonico con i termini esotermico ed endotermico che fanno riferimento all’entalpia H e al calore di reazione. |
|
A seconda dei valori positivi o negativi di ΔH e di T·ΔS abbiamo quattro possibili combinazioni.
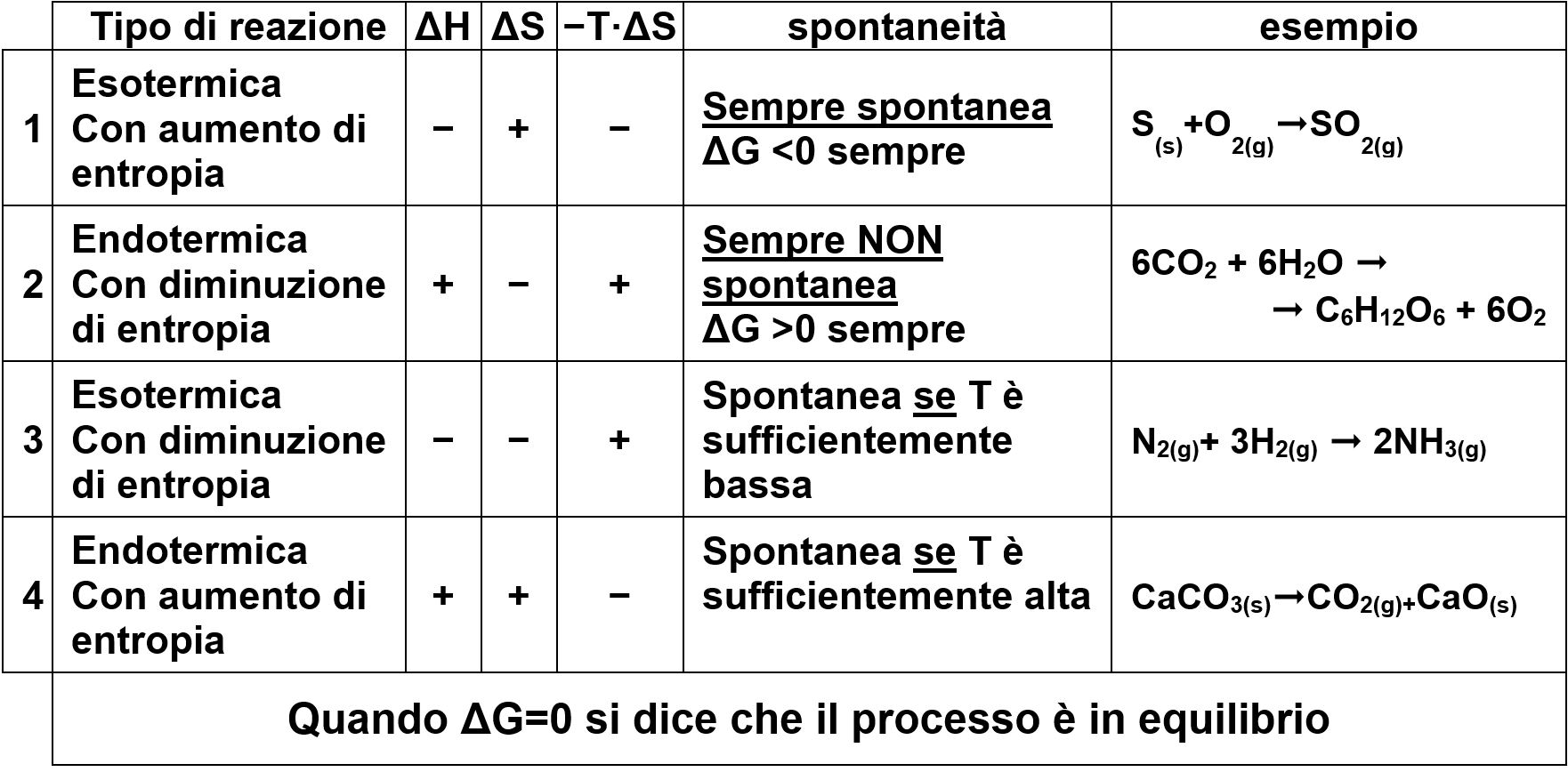
1 – Reazione esotermica con aumento di entropia – sempre spontanea
Consideriamo, come esempio, l’ossidazione del carbonio (carbone) per ottenere l’anidride carbonica:
C(s)+O2(g) ➞CO2(g)
Come tutte le reazioni di ossidazione, la reazione sviluppa calore. È cioè esotermica e ha ΔH<0 .
La struttura molecolare passa da due sostanze pure ordinate ad un composto che è più disordinato. L’entropia aumenta e abbiamo ΔS>0 e di conseguenza -T·ΔS<0.
La variazione di energia libera ΔG è sicuramente negativa sia per motivi entalpici che entropici.
2 – Reazione endotermica con diminuzione di entropia – sempre NON spontanea
Consideriamo, come esempio, l’anabolismo del glucosio, la reazione che avviene nella fotosintesi clorofilliana:
6CO2 + 6H2O → C6H12O6 + 6O2
Come tutte le reazioni delle via anaboliche (costruzione di biomolecole), la reazione assorbe calore che viene immagazzinato come energia chimica delle molecole costruite. È cioè endotermica e ha ΔH>0.
La struttura molecolare passa da due sostanze semplici CO2 e H2O ad un composto che è più ordinato, il glucosio C6H12O6. L’entropia diminuisce e abbiamo ΔS<0 e di conseguenza -T·ΔS>0.
La variazione di energia libera ΔG è sicuramente positiva sia per motivi entalpici che entropici.
Il processo di sintesi anabolica del glucosio risulta non spontaneo.
[La presenza della vita sul nostro pianeta è dovuta alle piante che, grazie alla fotosintesi clorofilliana, riescono a far avvenire questa reazione utilizzando energia esterna (la luce) ed andando ad influire sull’insieme del sistema + ambiente esterno con un aumento complessivo dell’entropia a spese dell’ambiente esterno. Riescono in tal modo a sintetizzare tutto il materiale organico che costituisce il presupposto della vita.]
3 – Reazione esotermica con diminuzione di entropia
Consideriamo, come esempio, la sintesi dell’ammoniaca:
N2(g)+ 3H2(g) ➞ 2NH3(g)
È una reazione esotermica con ΔH<0.
L’entropia della reazione diminuisce a causa della diminuzione del numero totale di moli gassose (aumento dell’ordine molecolare interno alle molecole). Abbiamo così ΔS<0 e di conseguenza -T·ΔS>0.
Questa reazione è favorita entalpicamente, ma è sfavorita entropicamente.
Dobbiamo ora stabilire quale delle due tendenze risulta dominante.
L’arbitro della questione è la temperatura T
Altri valori di temperatura aumentano il termine entropico -T·ΔS sfavorendo la reazione. Viceversa a più basse temperature il termine entropico -T·ΔS sarà piccolo rispetto al termine entalpico ΔH; quest’ultimo prevale e la sintesi dell’ammoniaca avviene.
In generale questo tipo di reazione è regolata dalla temperatura e avviene a temperature sufficientemente basse.
4 – Reazione endotermica con aumento di entropia
Consideriamo, come esempio, la decomposizione termica del carbonato di calcio [reazione che trasforma una roccia carbonatica in calce viva. Questa reazione avviene nei cementifici]: CaCO3(s)àCO2(g)+CaO(s)
Questa reazione necessita di molto calore. È endotermica con ΔH>0.
L’entropia della reazione aumenta a causa dell’aumento del disordine molecolare che abbiamo quando una molecola complessa si divide in più molecole. Abbiamo così ΔS>0 e di conseguenza -T·ΔS<0.
Questa reazione è sfavorita entalpicamente, ma è favorita entropicamente.
Dobbiamo ora stabilire quale delle due tendenze risulta dominante.
L’arbitro della questione è la temperatura T
Bassi valori di temperatura diminuiscono il termine entropico -T·ΔS sfavorendo la reazione. Viceversa a più alte temperature il termine entropico -T·ΔS sarà grande rispetto al termine entalpico ΔH; il termine entropico prevale e la decomposizione avviene.
In generale questo tipo di reazione è regolata dalla temperatura e avviene a temperature sufficientemente alte.
© il testo e le immagini sono di esclusiva proprietà dell’autore e sono sottoposti a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito
QUIZ sulle grandezze della termodinamica |
|||
|---|---|---|---|


