9.11 Neutralizzazione
La neutralizzazione avviene quando in una soluzione acquosa vengono immessi un acido e una base. Gli H+ e gli OH‒ si neutralizzano a vicenda e si forma acqua; gli ioni che rimangono formano un sale.
Valutiamo diverse situazioni combinando acidi e basi forti e/o deboli.
Immaginiamo di avere un ugual numero di moli di acido e di base.
Acido FORTE + base FORTE:
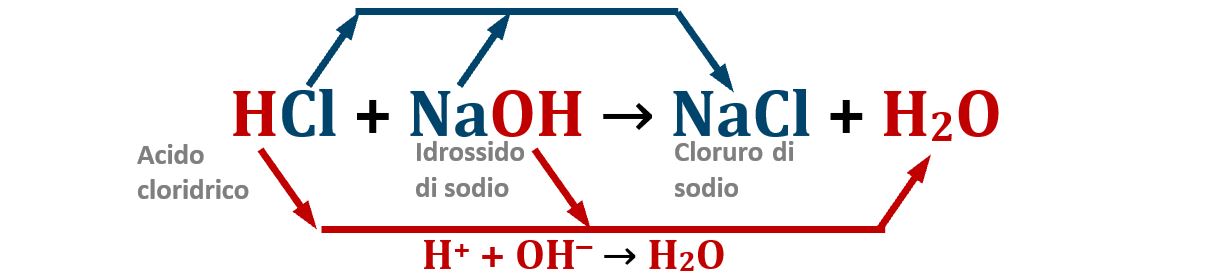
La neutralizzazione è completa; i due ioni cloruro Cl‒ e sodio Na+, ioni spettatori in quanto originati da situazioni “forti”, rimangono in soluzione e formano il sale cloruro di sodio (completamente disciolto in soluzione).
Poiché siamo partiti da un ugual numero di moli di acido e di base, la soluzione finale sarà perfettamente neutra perché tutti gli H+ si sono ricombinati con tutti gli OH‒.
Acido DEBOLE + base FORTE:
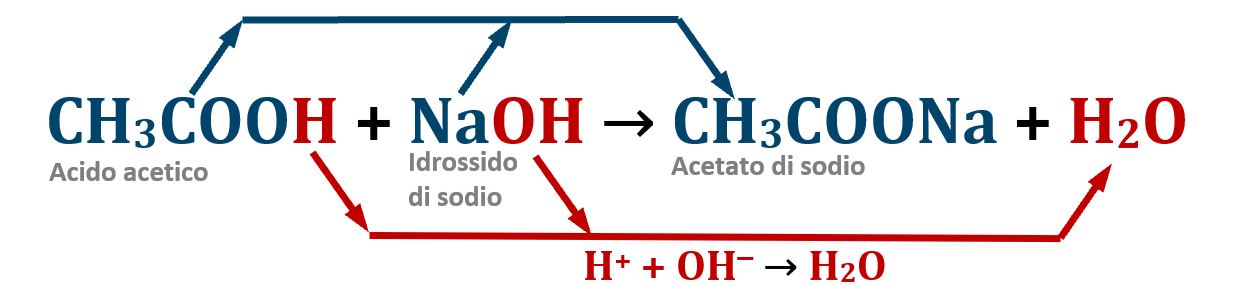
La neutralizzazione è completa; i due ioni acetato CH3COO‒ e sodio Na+, formano il sale acetato di sodio CH3COONa un sale detto Debole-Forte in quanto originato da un acido debole e da una base forte; è un sale che possiede un comportamento debolmente basico.
Acido FORTE + base DEBOLE:
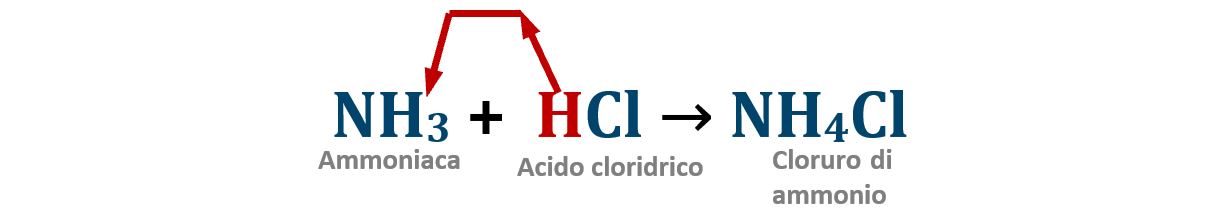
La neutralizzazione è completa; i due ioni ammonio NH4+ e cloruro Cl‒, formano il sale cloruro di ammonio NH4Cl, un sale detto Forte-Debole in quanto originato da un acido forte e da una base debole; è un sale che possiede un comportamento debolmente acido.
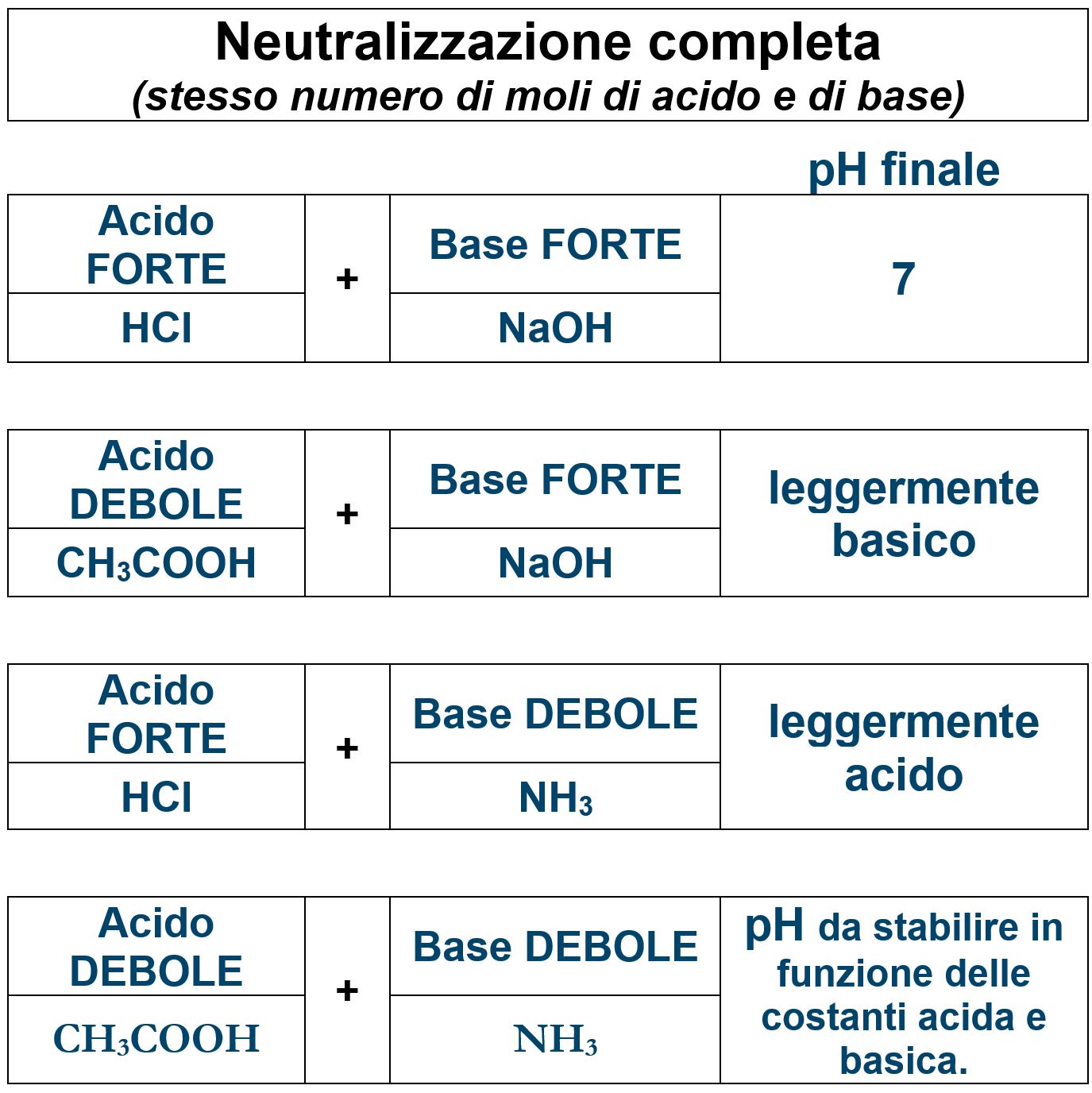
Nei quiz possiamo incontrare situazioni di neutralizzazione perfetta, come quella che abbiamo descritto qui sopra. In tal caso il pH della soluzione può essere neutro (pH=7) o leggermente acido o basico a seconda della natura dell’acido e della base che si neutralizzano.
Titolazioni
Per quanto riguarda la soluzione dei quiz il termine “titolazione” può essere considerato sinonimo di neutralizzazione.
Il temine deriva da una antico modo di analizzare la concentrazione incognita (detta “da titolare”) di una soluzione, ad esempio di un acido, aggiungendo un certo volume di una soluzione basica con concentrazione nota (“titolo” noto); il volume della seconda soluzione viene aggiunto via via finché non si raggiunge la neutralità (neutralizzazione).
© il testo e le immagini sono di esclusiva proprietà dell’autore e sono sottoposti a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito
9.1 Autoprotolisi
9.2 Soluzioni acide e basiche – pH
9.3 Definizione di acido e base
9.4 Acidi mono e poli-protici
9.5 Costante di equilibrio di acidi e basici
9.6 Acidi e basi forti e deboli
9.7 Rapporto tra Ka e Kb
9.8 Acidi e basi FORTI in soluzione
9.9 Diluizioni di acidi e basi forti in soluzione
9.10 Acidi e basi DEBOLI in soluzione
9.11 Neutralizzazione
9.12 Sali neutri, acidi e basici
9.13 Tamponi


