9.11 Neutralizzazione
QUIZ 01
Veterinaria 2020
In un matraccio contenente 400 mL di acqua distillata, vengono trasferiti 25 mL di una soluzione 0,4 M di NaOH e 75 mL di una soluzione 0,2 M di HCl. Quale tra i seguenti è il valore corretto del pH della soluzione risultante?
In una neutralizzazione perfetta le moli di H+ e le moli di OH‒ sono identiche e si compensano completamente trasformandosi in H2O e il pH finale sarà neutro. Quando invece c’è un eccesso di H+ oppure di OH‒, la neutralizzazione avverrà solo fino al completamento dell’utilizzazione del minore in concentrazione dei due ed il maggiore in concentrazione rimane ancora presente andando a spostare il pH rispetto all aneutralità come nel nostro caso.
Consideriamo le moli di H+ e le moli di OH‒ introdotte nel recipiente.
Moli di OH‒
25 mL, ovvero 0,025 litri di NaOH con molarità 0,4 corrispondono ad una quantità di moli che si possono calcolare:
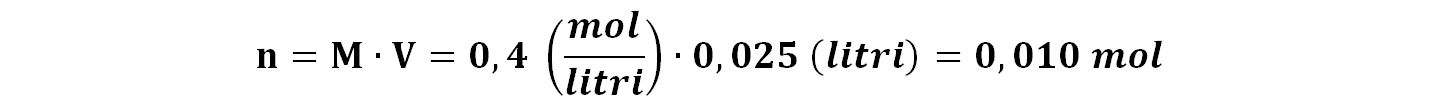
Queste sono le moli di NaOH, che è una base forte che in acqua dà idrolisi completa. Perciò sono anche le moli dello ione OH‒.
Moli di H+
75 mL, ovvero 0,075 litri di HCl con molarità 0,2 corrispondono ad una quantità di moli che si possono calcolare:
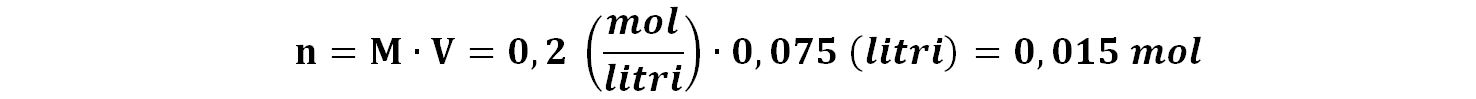
Queste sono le moli di HCl, che è un acido forte che in acqua dà idrolisi completa. Perciò sono anche le moli dello ione H+.
Ci accorgiamo che H+ (0,015 mol) è più abbondante di ione OH‒ (0,010mol). Perciò delle 0,015 moli di H+ se ne neutralizzano solo 0,010 moli e ne rimangono in soluzione 0,015-0,010=0,005 moli.
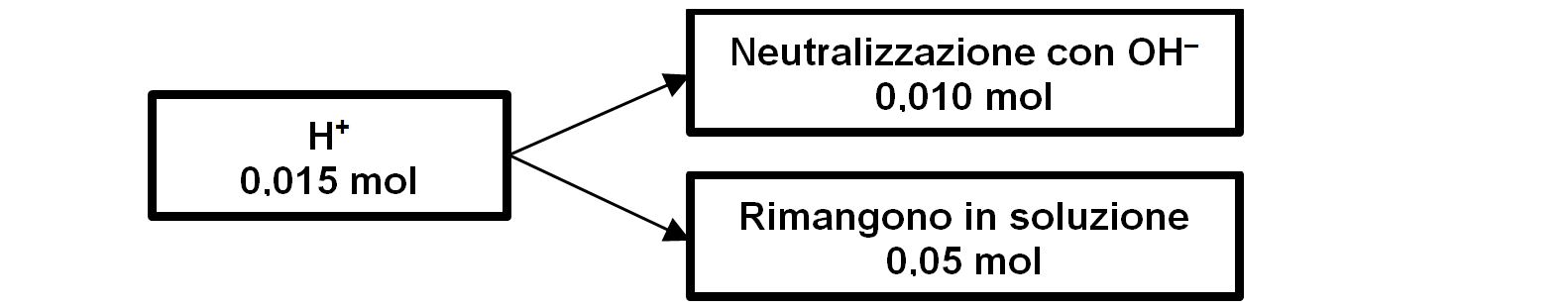
Per calcolare il pH dobbiamo conoscere la molarità (moli/litri) di H+ : le moli sono 0,005; per il volume dobbiamo considerare il volume iniziale di 400mL e l’apporto delle due soluzioni aggiunte. Avremo così 400+25+75=500mL=0,5 litri
La molarità risulta: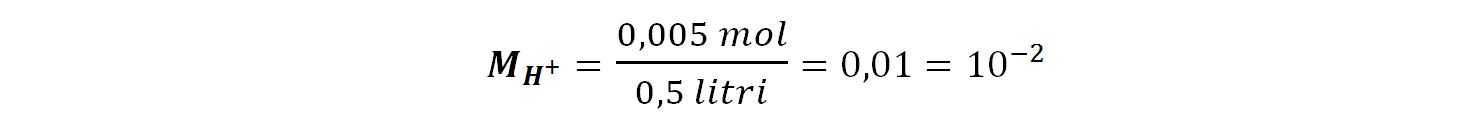
Il pH si calcola come cologaritmo della concentrazione molare degli ioni H+:
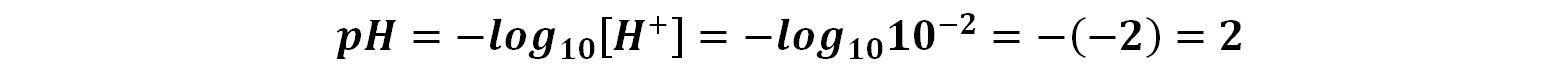
© il testo è di esclusiva proprietà dell’autore ed è sottoposto a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito


