10.2.9 POLIENI
Lungo una catena di atomi di carbonio può capitare di incontrare anche più di un solo doppio legame. Parliamo così di dieni se i doppi legami sono due, o più in generale di polieni.
DIENI
La formula generale dei dieni è CnH2n–2. Questa formula rispetto a quella degli alcani CnH2n+2 presenta una insaturazione di quattro atomi di idrogeno in meno (due in meno per ciascun doppio legame).
Un diene a volte nominato nei quiz è il butadiene C4H6
[ Il butadiene è un idrocarburo a volte citato nei quiz in quanto è utilizzato in chimica per diversi usi soprattutto per formare un polimero, il polibutadiene, che costituisce la materia gommosa degli pneumatici. Possedendo due doppi legami può formare polimeri con ramificazioni che conferiscono elasticità e solidità. Questo polimero ha sostituito il caucciù naturale.]
Al fine di capire le modalità usate per la nomenclatura, vediamo l’esa 1,3 diene, un idrocarburo con sei atomi di carbonio e due doppi legami che troviamo a partire dal carbonio 1 e dal carbonio 3.
10.2.10 CICLOALCANI, CICLOALCHENI E COCLOALCHINI
Una catena di atomi di carbonio può avere una struttura ciclica, ovvero ad anello.
CICLOALCANI
Nei cicloalcani il numero di atomi di idrogeno che si associano a quelli di carbonio seguono la regola 2n dove n è il numero di atomi di C. La formula generale sarà perciò CnH2n .
Nella formula generale dei cicloalcani CnH2n rispetto a quella degli alcani CnH2n+2 vediamo che ci sono due atomi di idrogeno in meno a causa del legame in più tra due carboni per la chiusura dell’anello.
La formula generale CnH2n è la stessa degli alcheni e questo è motivo di possibile confusione, soprattutto nei quiz dei test di ammissione.
| Cicloalcano | Formula di struttura | Formula semplificata |
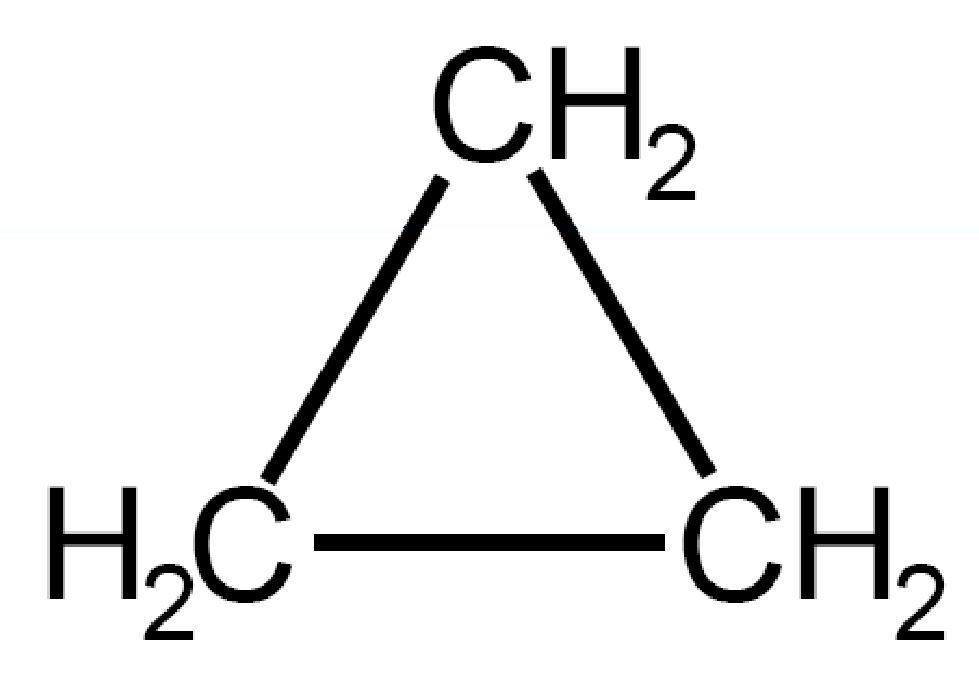
| Ciclopropano
C3H6 |
 |
 |
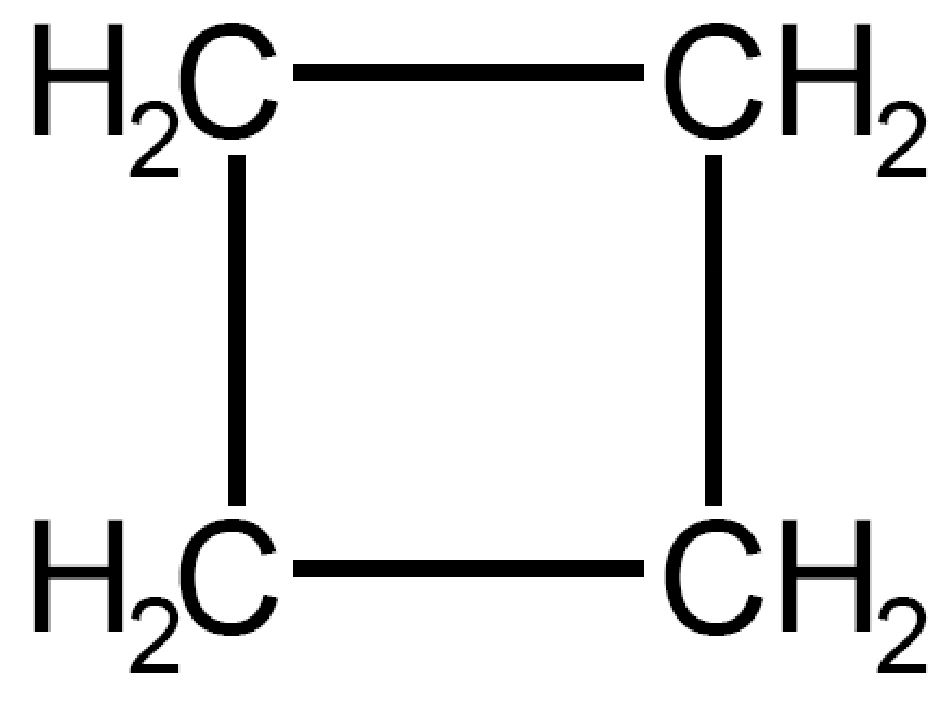
| Ciclobutano
C4H8 |
 |
 |
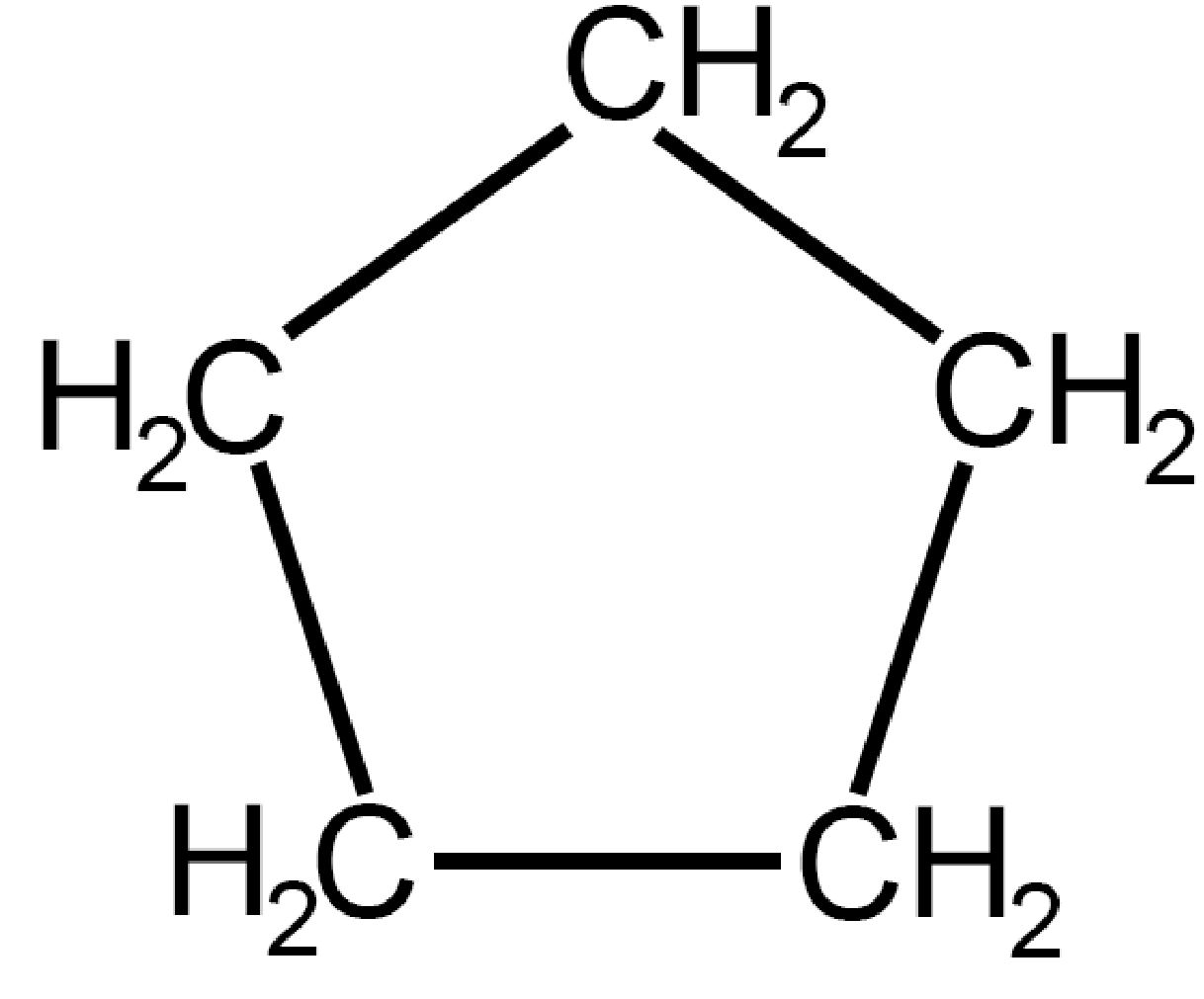
| Ciclopentano
C5H10 |
 |
 |
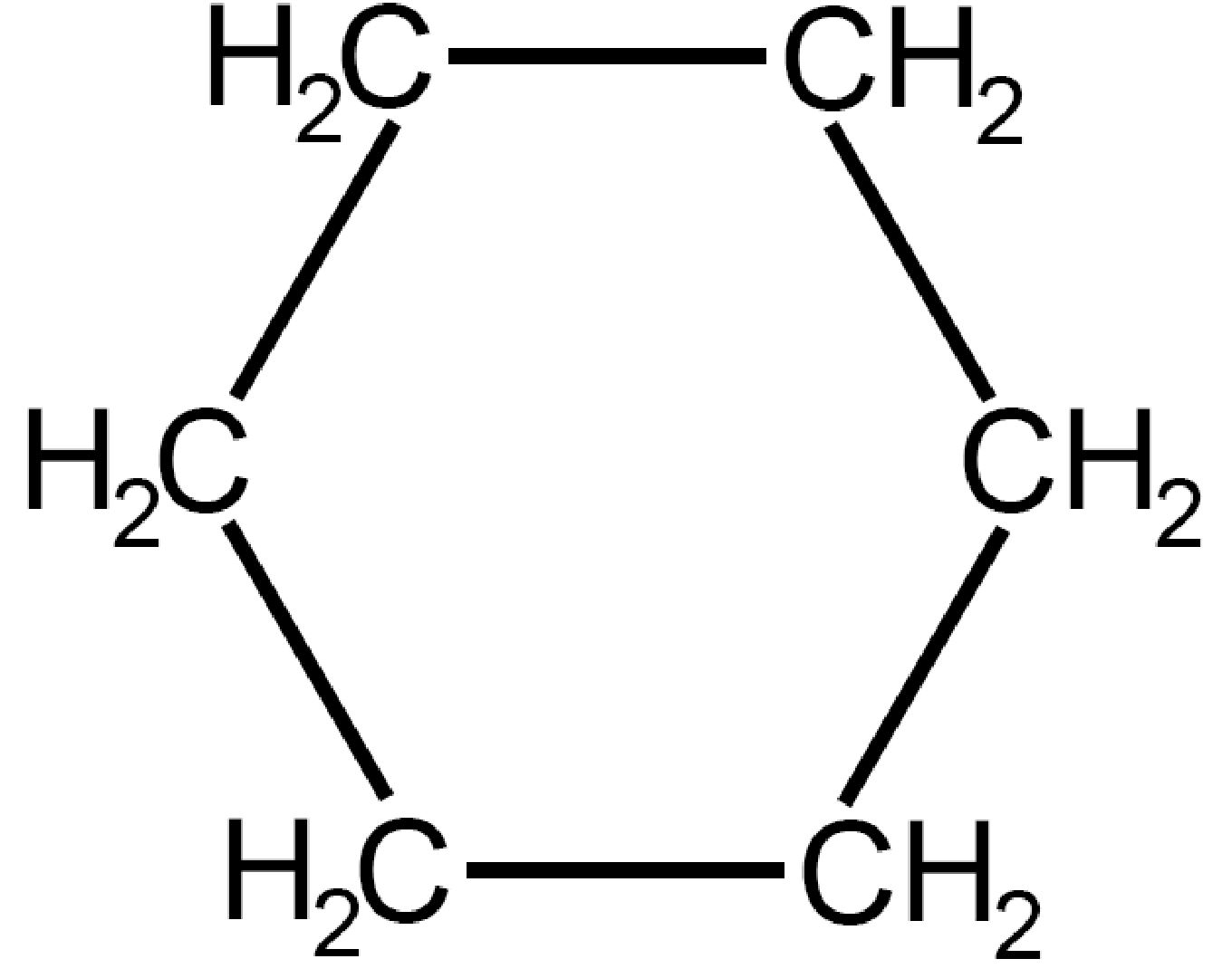
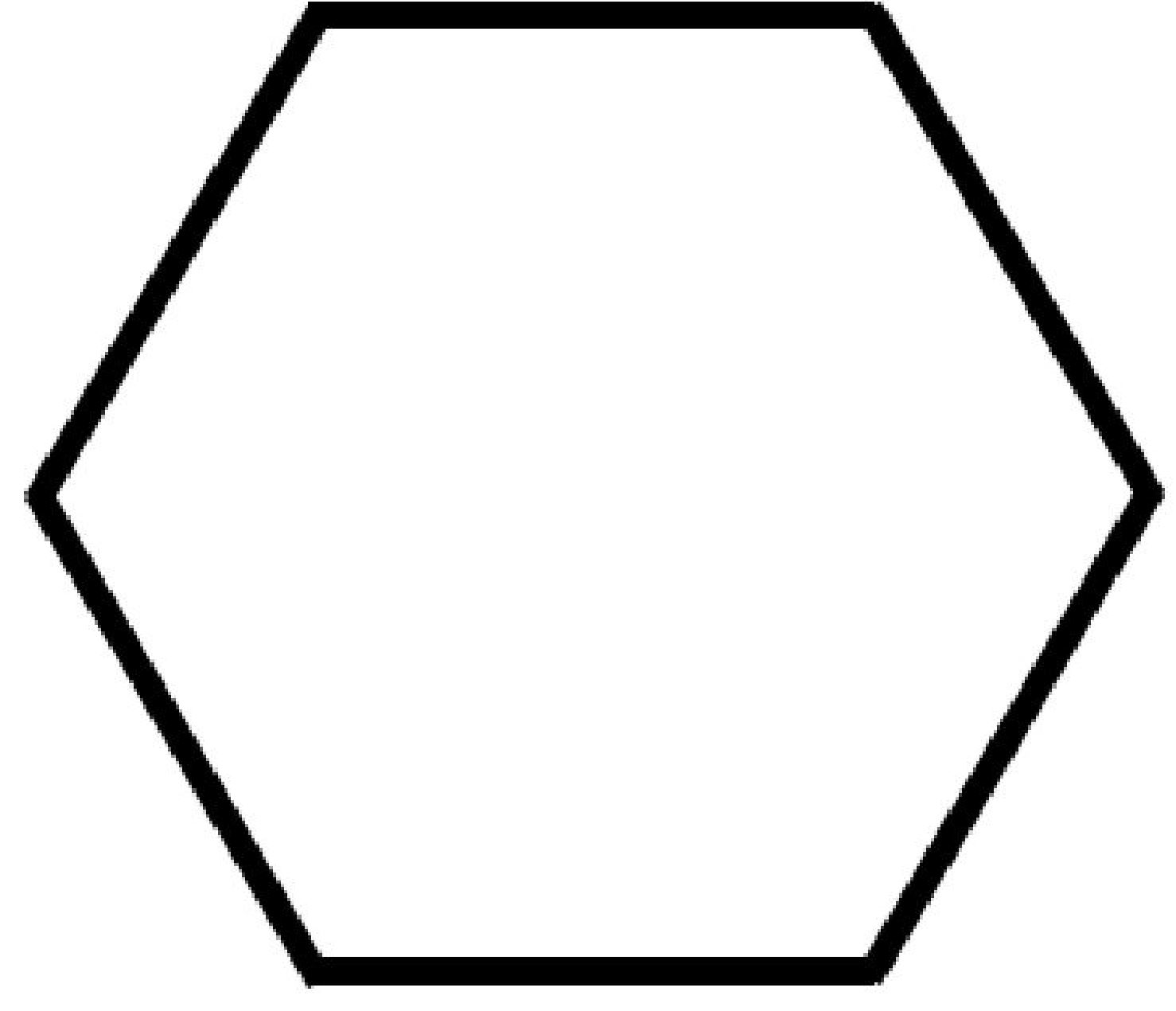
| Cicloesano
C6H12 |
 |
 |
Nei polimeri ciclici l’angolo di legame tra due carboni consecutivi può non rispettare l’angolo naturale di 109,5° dell’ibridazione sp3.
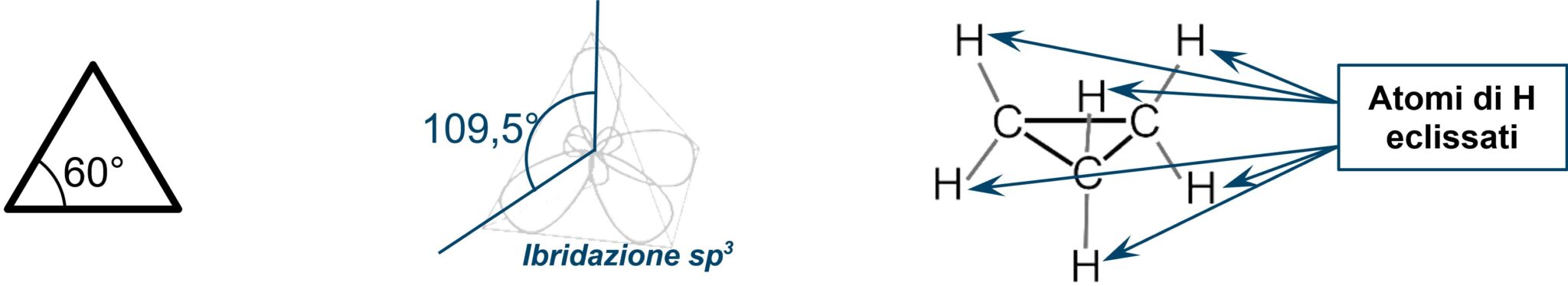
Nel ciclopropano l’angolo di legame risulta di 60°, molto diverso da 109,5°. Inoltre gli atomi di idrogeno si ritrovano a stare alla stessa altezza rispetto al piano dei tre atomi di carbonio (si dice che sono eclissati in quanto si nascondono uno con l’altro come nei fenomeni solari di eclisse).
A motivo della forzatura dell’angolo di legame e dell’eclissamento degli atomi di idrogeno l’idrocarburo è difficilmente presente in natura. La molecola possiede una tensione torsionale e una elevata reattività.
Nel ciclobutano, se rappresentiamo la molecola su un piano, l’angolo di legame risulterebbe di 90° e si verificherebbe, come nel ciclopropano il fenomeno dell’eclissamento degli atomi di idrogeno, diverso da 109,5°. La molecola assume però una conformazione spaziale piegata di circa 20° che forza ulteriormente l’angolo di legame, ma risolve il problema dell’eclissamento degli atomi di idrogeno. Per questo motivo il ciclobutano è meno reattivo del ciclopropano.
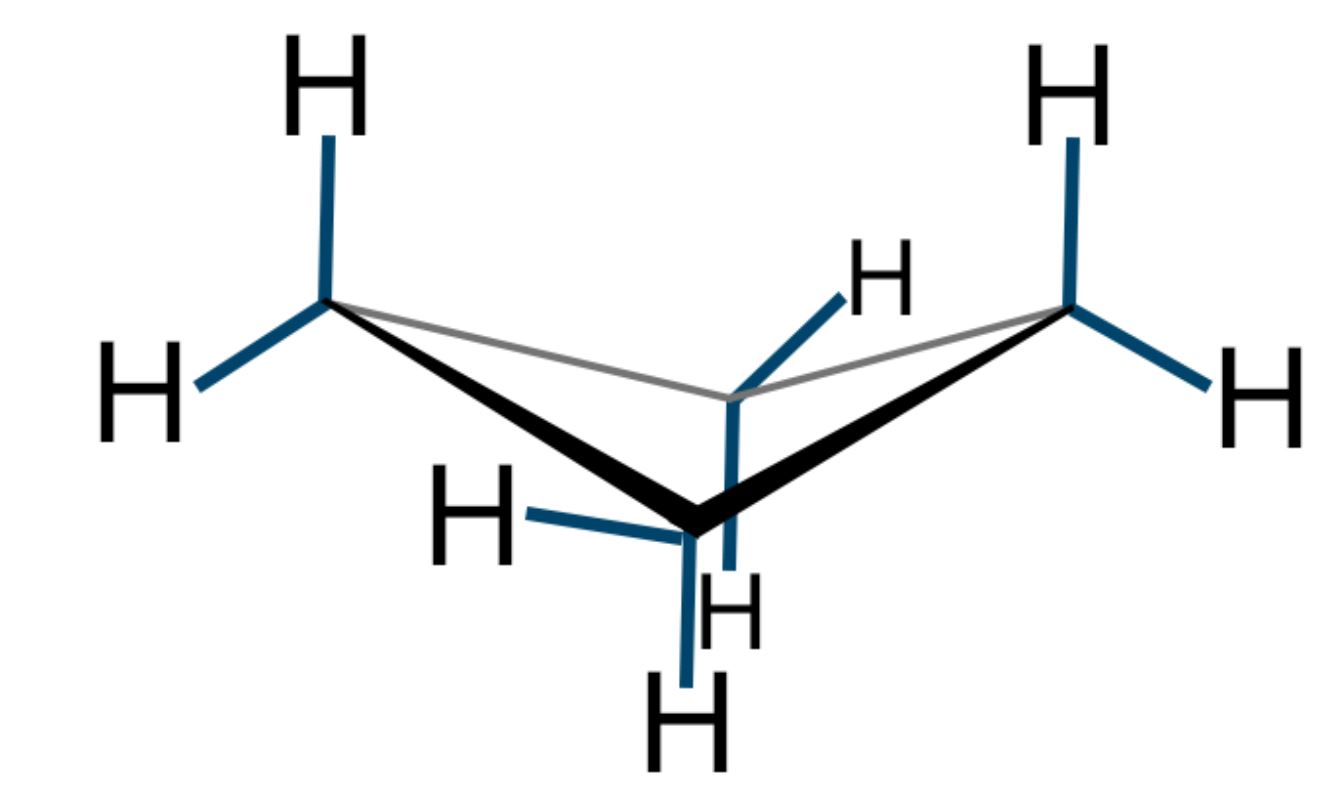 |
Conformazione tridimensionale del ciclobutano |
Anche nel ciclopentano avviene un piegamento dal piano molecolare in uno dei cinque atomi di carbonio per risolvere, in parte, il problema dell’eclissamento degli atomi di idrogeno.
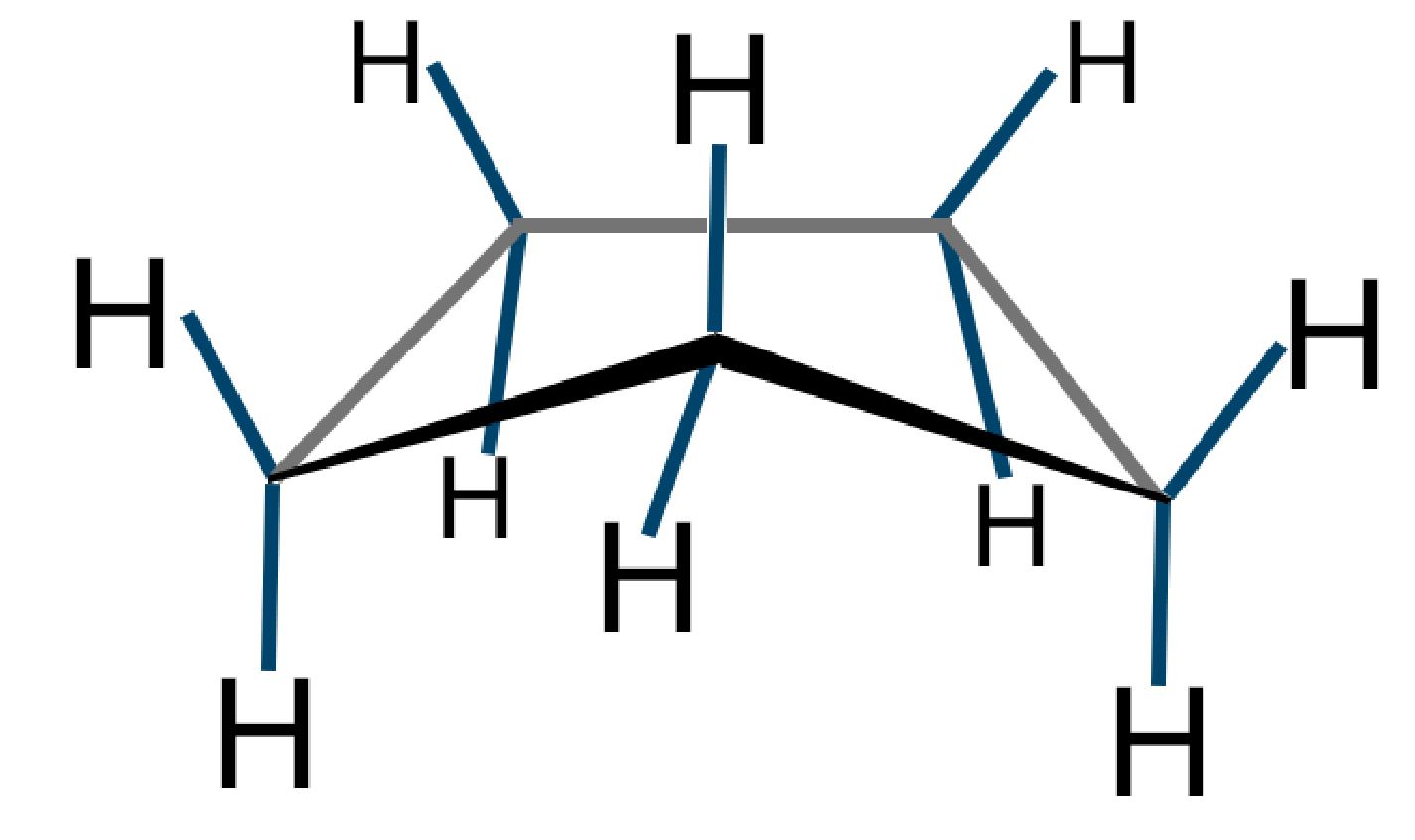 |
Conformazione tridimensionale del ciclopentano |
Il cicloesano risolve ottimamente i problemi di eclissamento degli atomi di idrogeno con una conformazione piegata che permette anche un angolo di legame proprio dell’ibridazione sp3.
Esistono due possibili conformazioni spaziali dette a “sedia” (chair) e a “barca” (boat). Si parla in questo caso di isomeria conformazionale.
| Formule di struttura del cicloesano | 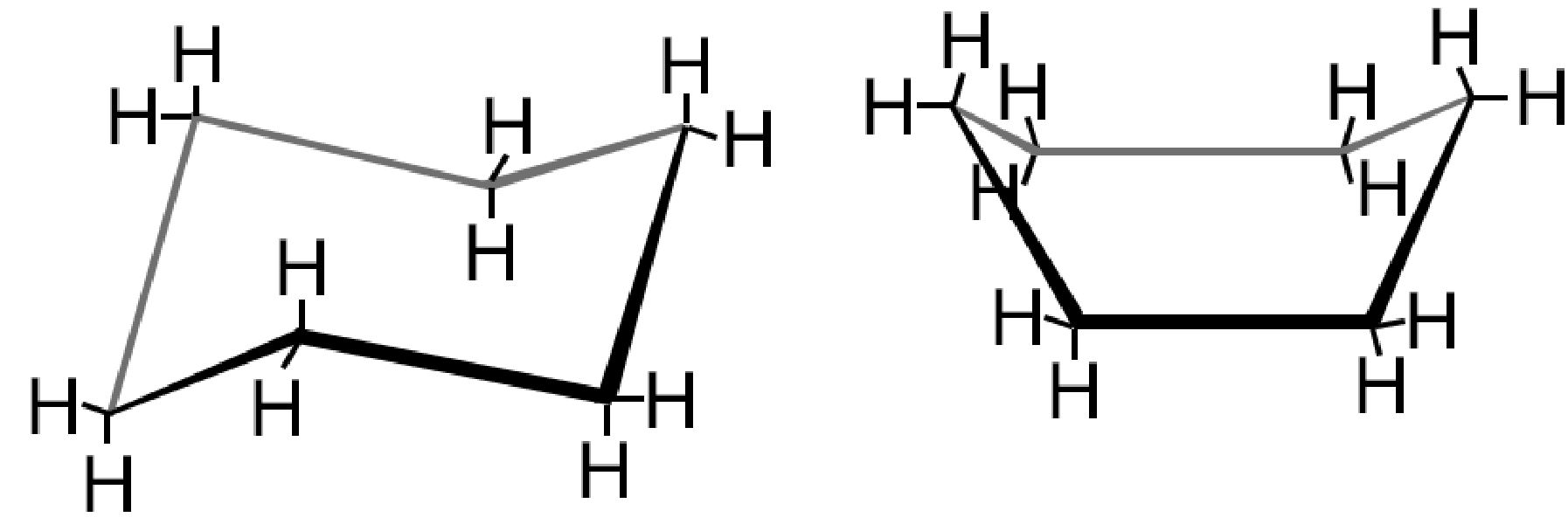 |
| Conformazione tridimensionale a sedia |  |
| Formule semplificate | 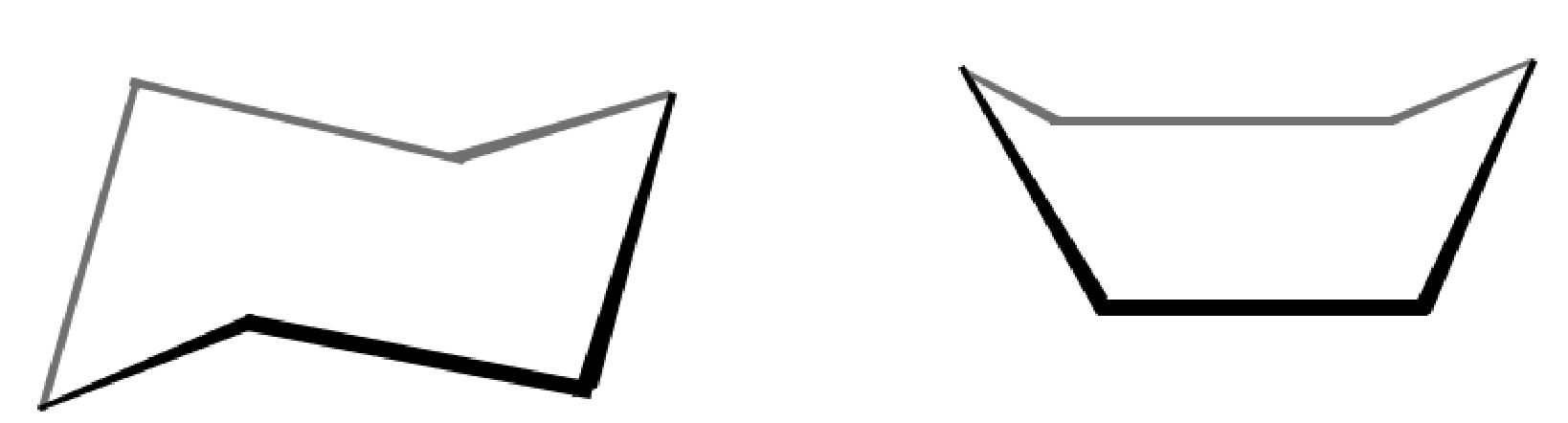 |
CICLOALCHENI
Nei cicloalcheni il numero di atomi di idrogeno che si associano a quelli di carbonio seguono la regola 2n−2 dove n è il numero di atomi di C. La formula generale sarà perciò CnH2n−2 .
Nella formula generale dei cicloalcheni CnH2n−2 rispetto a quella degli alcani CnH2n+2 vediamo che ci sono quattro atomi di idrogeno in meno: due a causa del legame in più tra due carboni per la chiusura dell’anello e altri due a causa del doppio legame.
La formula generale CnH2n−2 è la stessa degli alchini e dei dieni; questo è motivo di possibile confusione, soprattutto nei quiz dei test di ammissione.
| Cicloalchene | Formula di struttura | Formula semplificata |
| Ciclopropene
C3H4 |
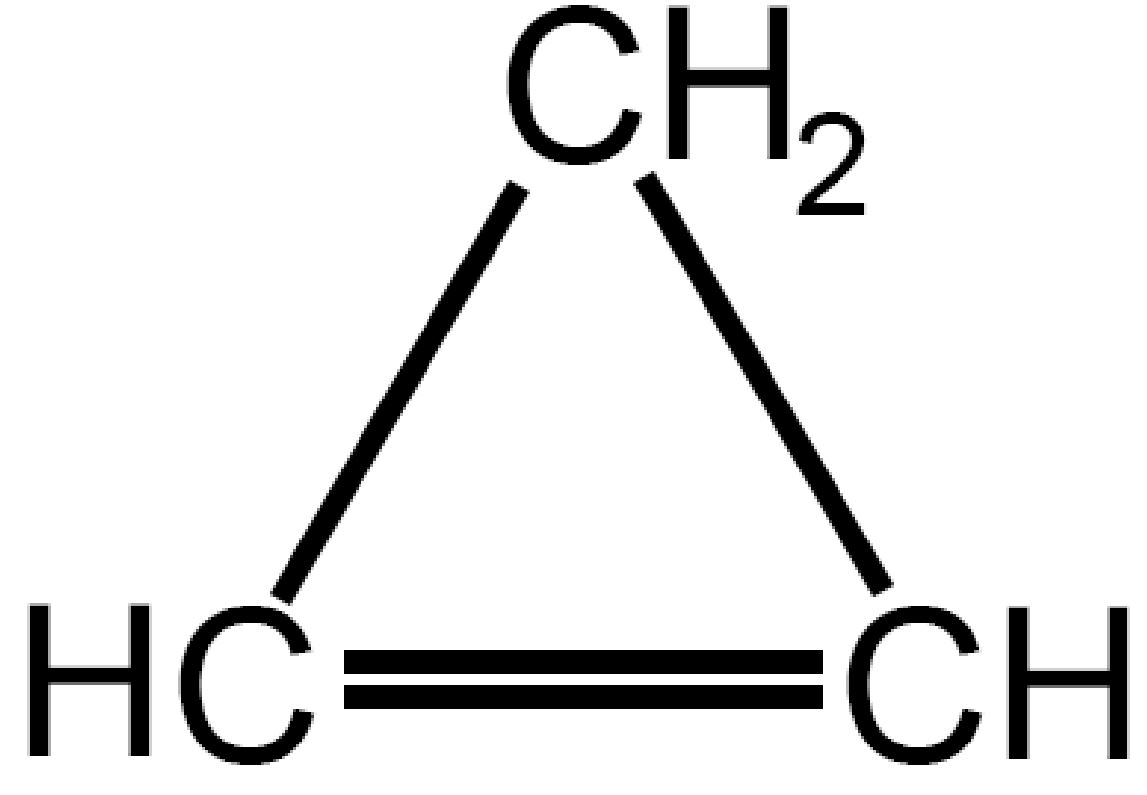 |
 |
| Ciclobutene
C4H6 |
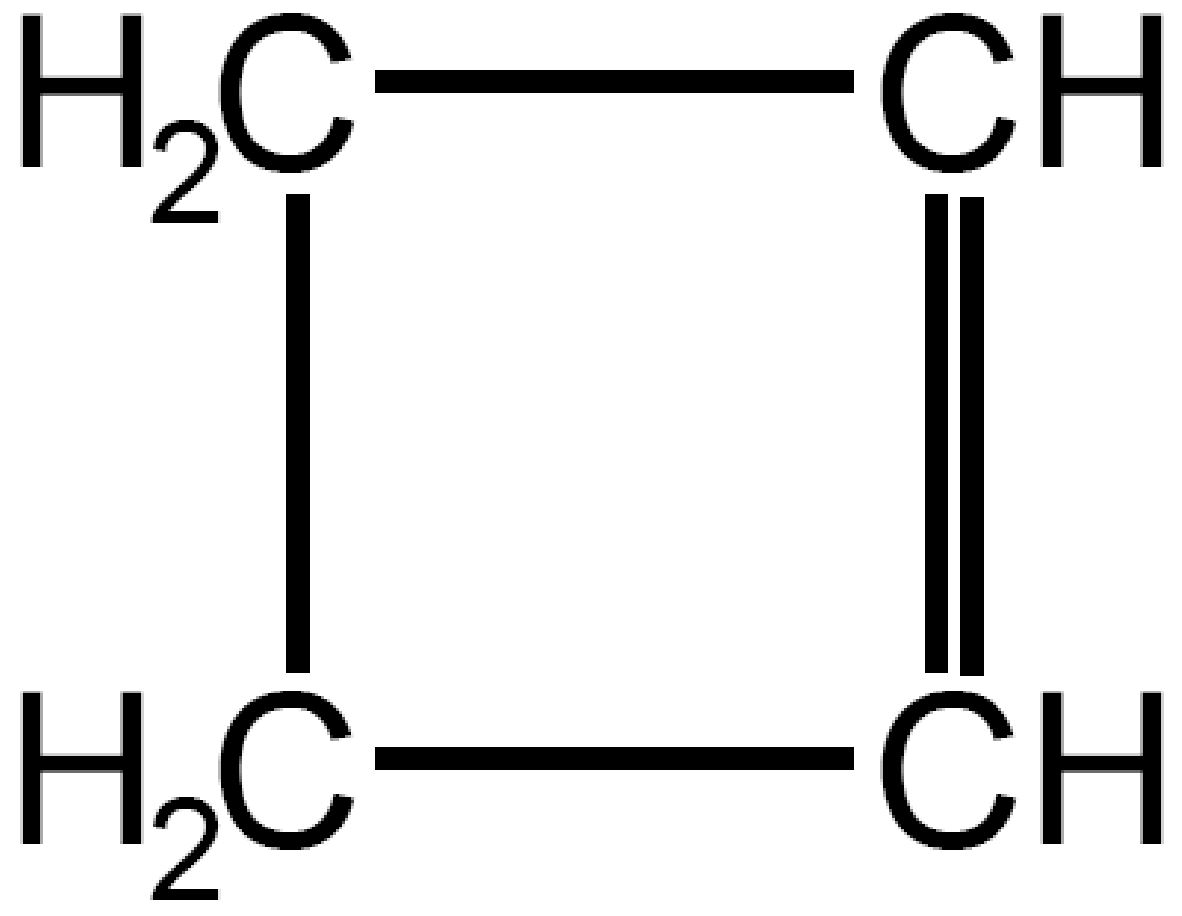 |
 |
| Ciclopentene
C5H8 |
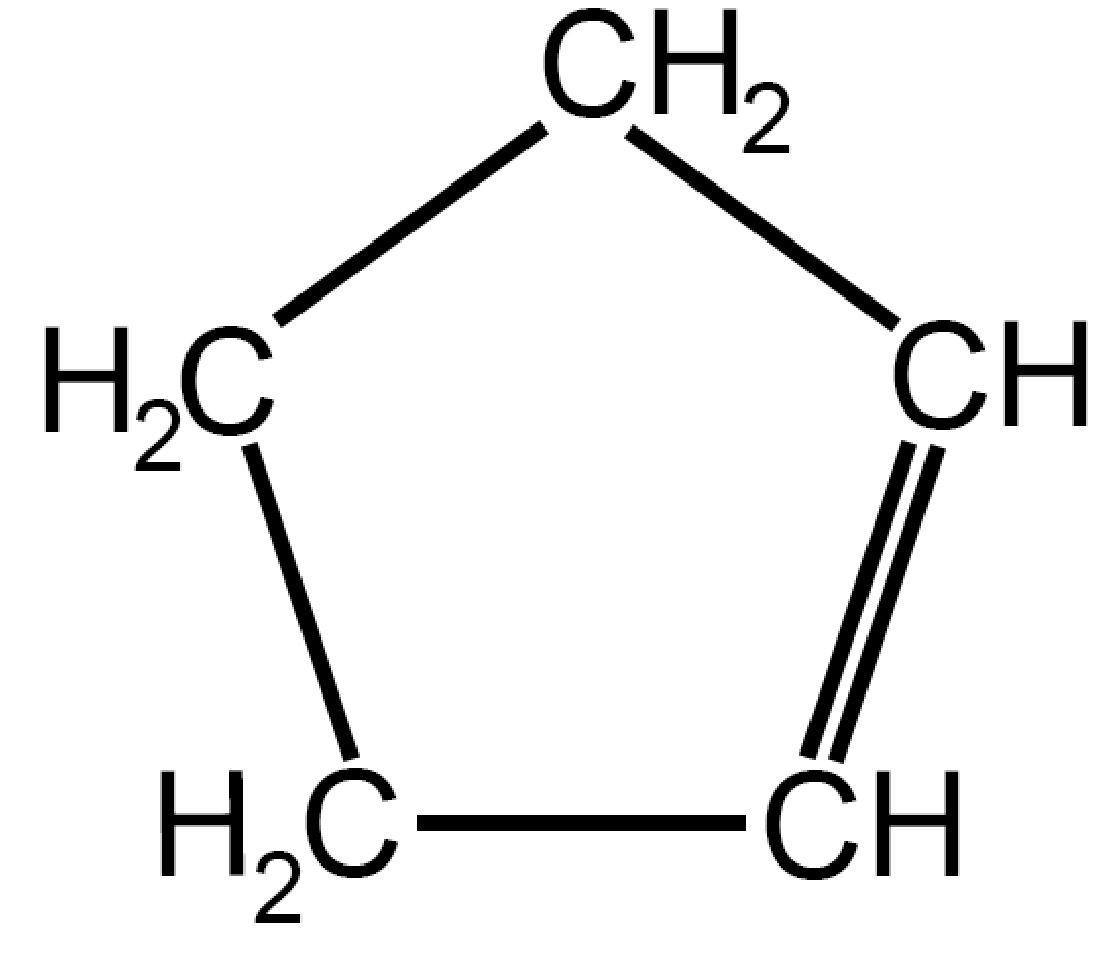 |
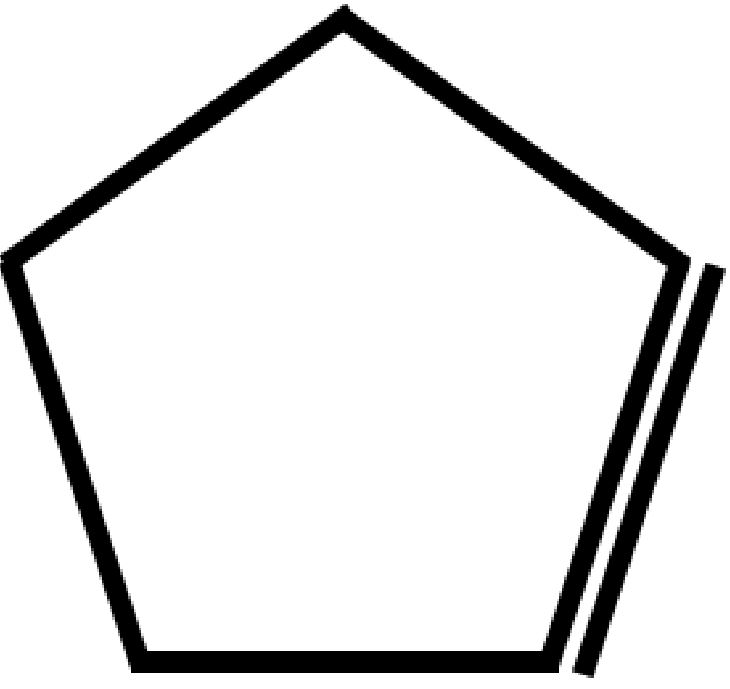 |
| Cicloesene
C6H10 |
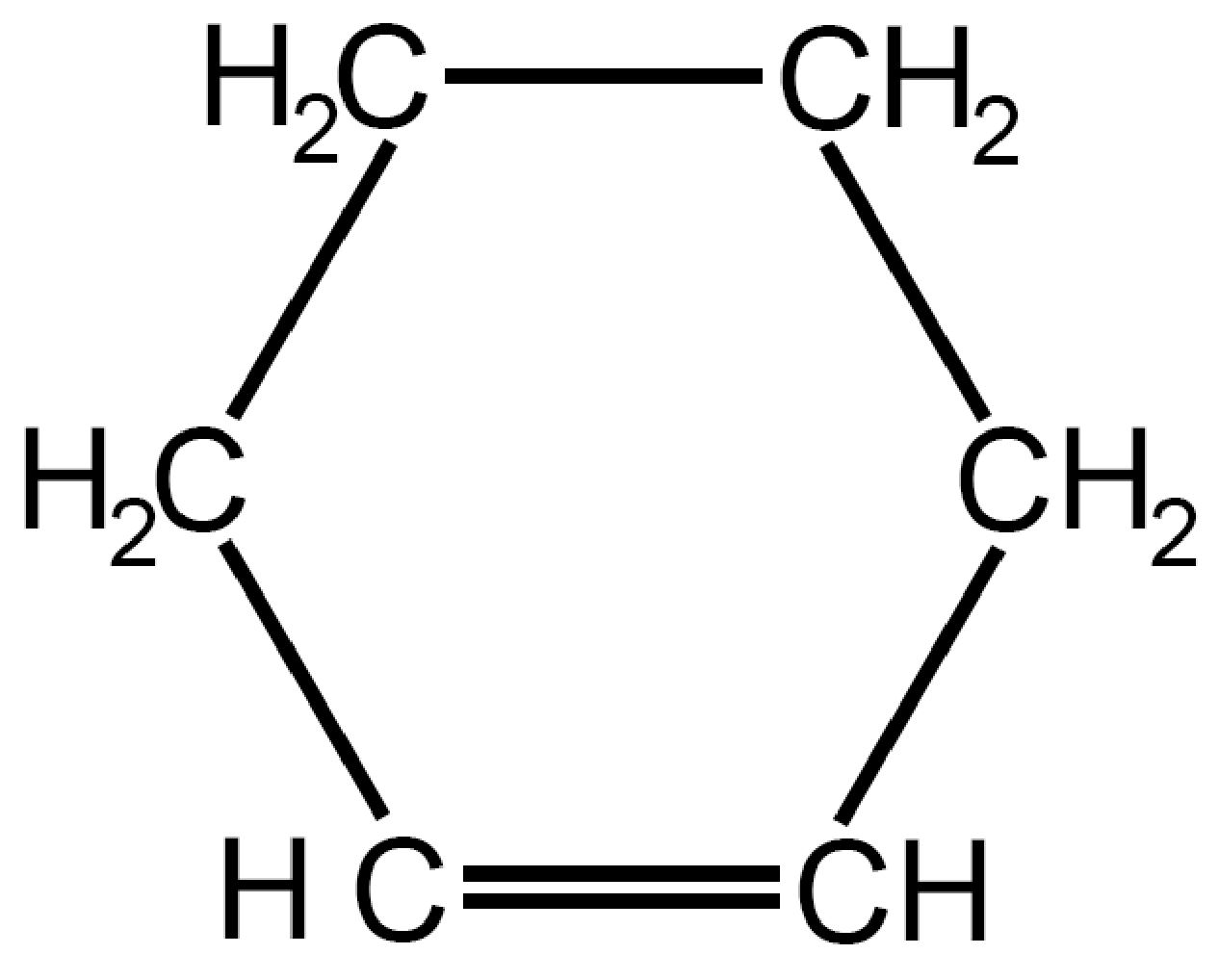 |
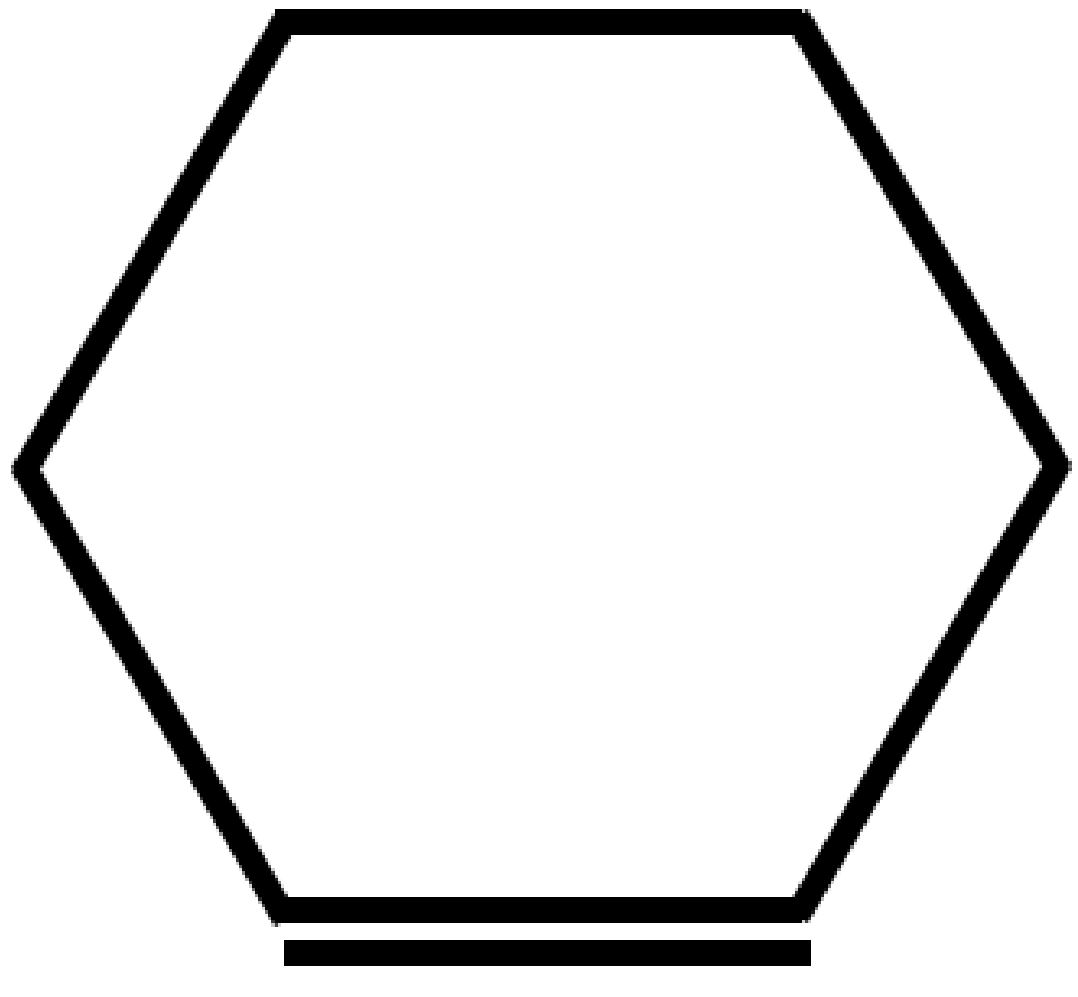 |
CICLOALCHINI
Nei cicloalchini sono presenti due atomi ibridati sp che permettono la formazione di un triplo legame che conferisce alla catena di atomi di carbonio una struttura lineare (angolo di legame a 180°), che coinvolge quattro atomi di carbonio −C−C≡C−C−. Questa linearità che coinvolge quattro atomi di carbonio crea una forte tensione di anello. Per questo motivo per riuscire ad avere una struttura ciclica sono necessari almeno otto atomi di carbonio. Il primo idrocarburo noto dei cicloalchini è il cicloottino.
| Cicloottino C8H12
Formula semplificata |
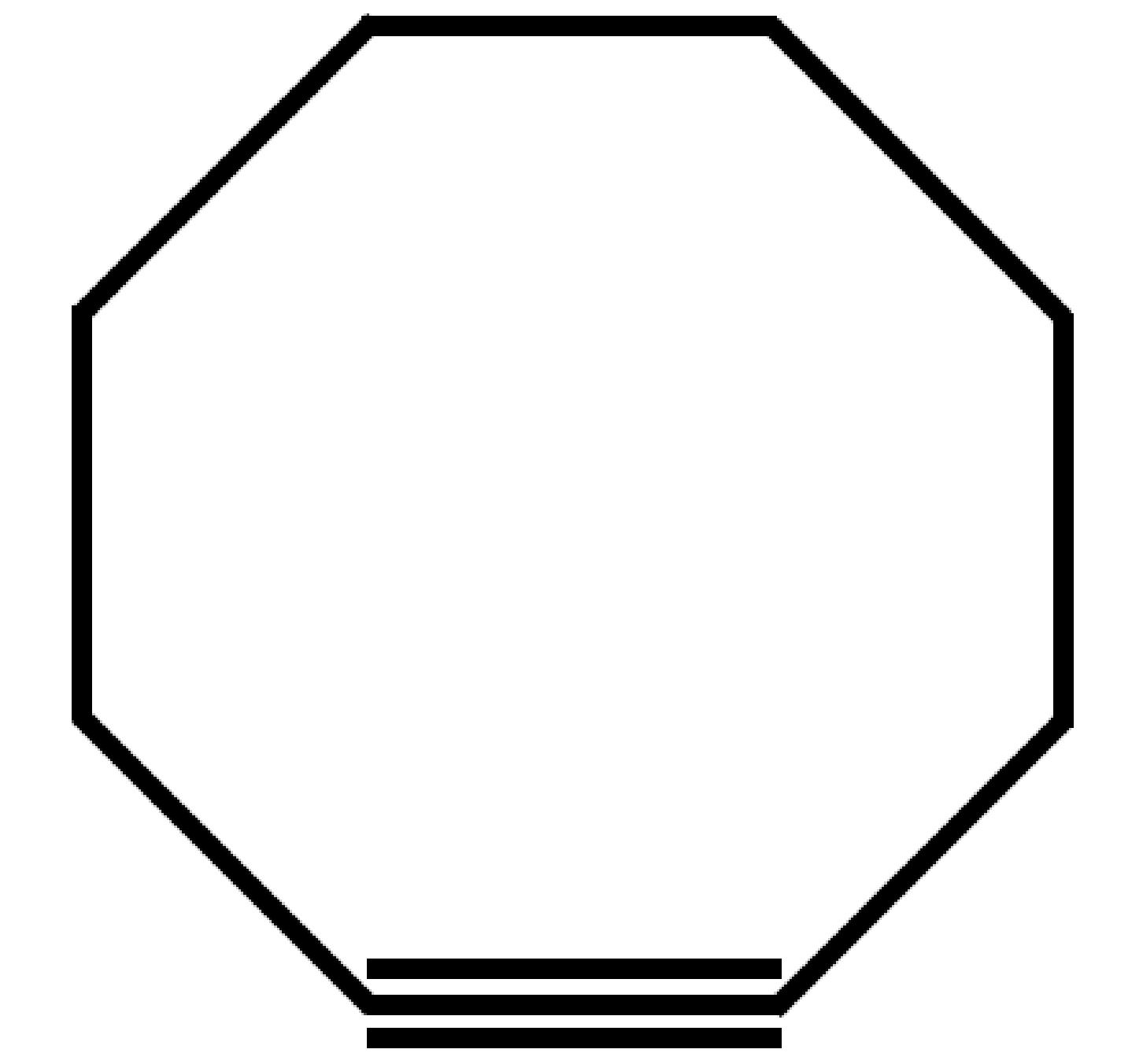 |
Nei cicloalchini il numero di atomi di idrogeno che si associano a quelli di carbonio seguono la regola 2n−4 dove n è il numero di atomi di C. La formula generale sarà perciò CnH2n−4 .
Nella formula generale dei cicloalcheni CnH2n−4 rispetto a quella degli alcani CnH2n+2 vediamo che ci sono sei atomi di idrogeno in meno: due a causa del legame in più tra due carboni per la chiusura dell’anello e altri quattro a causa del triplo legame.
10.2.11 COMPOSTI ETEROCICLICI SATURI
Un composto eterociclico è una molecola ciclica nella quale uno o più atomi dell’anello non sono atomi di carbonio ma diversi: azoto, ossigeno, zolfo e fosforo.
Vediamo, come esempio, i seguenti composti:
|
|
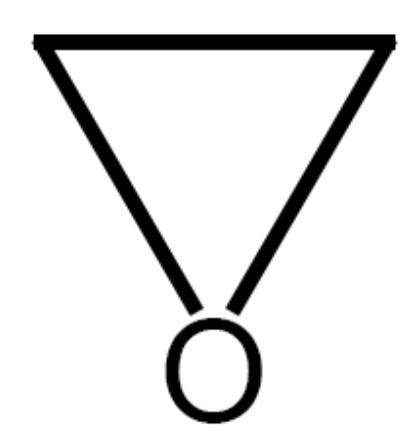 Ossociclopropano (ossirano, ossido di etilene) Ossociclopropano (ossirano, ossido di etilene) |
La nomenclatura di questi composti è complessa e non viene richiesta nei test di ammissione all’università.
© il testo è di esclusiva proprietà dell’autore ed è sottoposto a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito


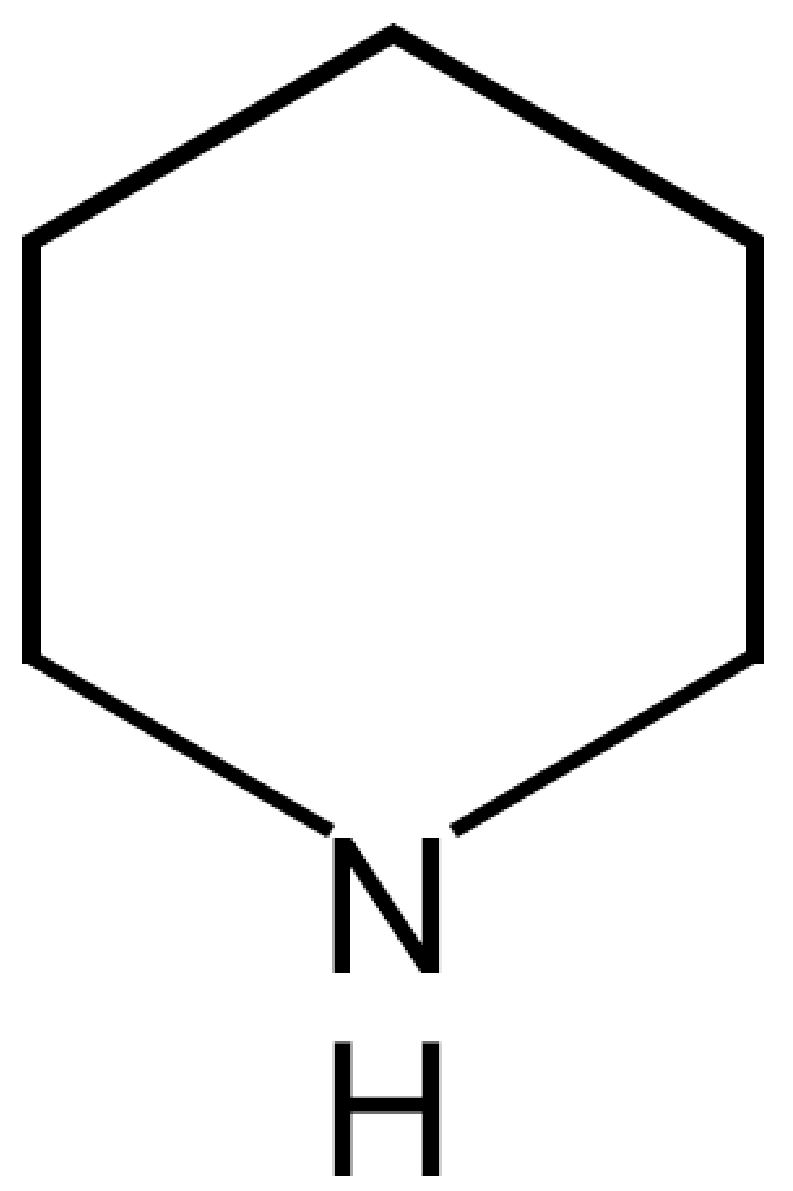 Azocicloesano (piperidina)
Azocicloesano (piperidina)