9.7 Rapporto tra Ka e Kb
Consideriamo un acido debole come l’acido acetico CH3COOH e la sua base coniugata CH3COO‒ (ione acetato).
Acido acetico CH3COOH
Il comportamento dell’acido acetico CH3COOH in acqua consiste nella deprotonazione con la formazione dello ione acetato CH3COO‒.
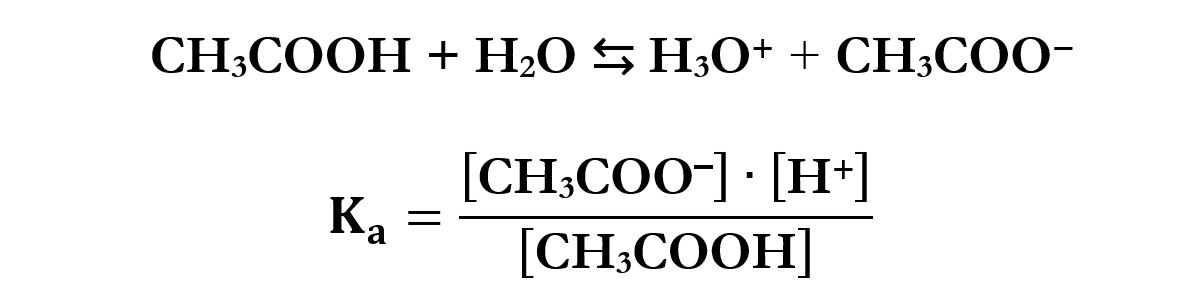
Ione acetato CH3COO‒
Il comportamento dello ione acetato CH3COO‒ in acqua consiste nell’acquisto di un H+ (tipico comportamento basico) con la formazione dell’ acido acetico non dissociato CH3COOH.
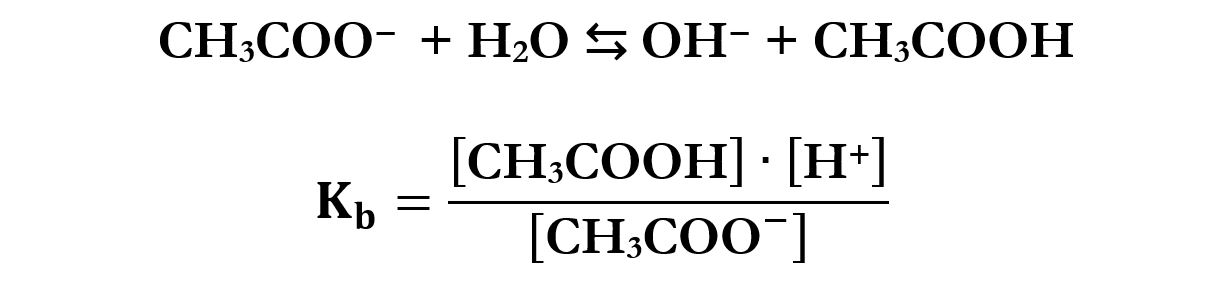
Vale la relazione:
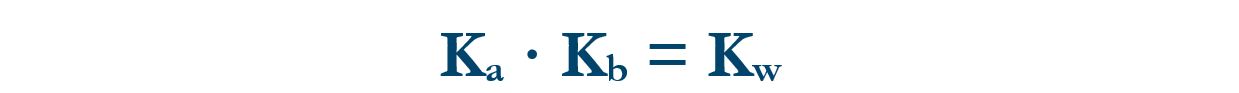
Dove Kw è la costante di autoprotolisi dell’acqua che vale 10‒14.
Di conseguenza valgono le relazioni:

© il testo e le immagini sono di esclusiva proprietà dell’autore e sono sottoposti a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito
9.1 Autoprotolisi
9.2 Soluzioni acide e basiche – pH
9.3 Definizione di acido e base
9.4 Acidi mono e poli-protici
9.5 Costante di equilibrio di acidi e basici
9.6 Acidi e basi forti e deboli
9.7 Rapporto tra Ka e Kb
9.8 Acidi e basi FORTI in soluzione
9.9 Diluizioni di acidi e basi forti in soluzione
9.10 Acidi e basi DEBOLI in soluzione
9.11 Neutralizzazione
9.12 Sali neutri, acidi e basici
9.13 Tamponi


