9.9 Diluizioni di acidi e basi forti in soluzione
La diluizione è il processo mediante il quale una soluzione concentrata viene resa meno concentrata.
La quantità di soluto rimane invariata ed aumenta il volume del solvente.
Quantità di soluto iniziale in moli : n1 = M1 · V1
Quantità di soluto finale in moli: n2 = M2 · V2
Poiché la formula per calcolare una diluizione è:
M1 · V1 = M2 · V2
dove M1 e M2 rappresentano le concentrazioni molari rispettive delle soluzioni iniziale e finale, e V1 and V2 rappresentano i loro volumi.
Quiz di calcolo
Nei Quiz le diluizioni di acidi e basi forti vengono considerate solo come diluizioni di fattore 10 100 1000.
Così quando le concentrazioni di [H+] o di [OH−] variano di un fattore 10, il pH varia di una unità.
Diluizione di soluzioni acide
Consideriamo ad esempio un litro di una soluzione con pH=4; la diluiamo di un fattore 10 aggiungendo 9 litri di acqua distillata, raggiungendo così un volume finale di 10 litri. Il valore pH=4 si sposta di una unità verso la neutralità (pH=7) passando da 4 a 5.

Similmente consideriamo ad esempio un litro di una soluzione con pH=4; la diluiamo questa volta di un fattore 100 aggiungendo 99 litri di acqua distillata, raggiungendo così un volume finale di 100 litri. Il valore pH=4 si sposta di due unità verso la neutralità (pH=7) passando da 4 a 6.

Similmente consideriamo ad esempio un litro di una soluzione con pH=4; la diluiamo questa volta di un fattore 1000 aggiungendo 999 litri di acqua distillata, raggiungendo così un volume finale di 1900 litri. Il valore pH=4 si sposta di tre unità verso la neutralità (pH=7) passando da 4 a 7.

Ora immaginiamo di diluire ancora di più, per esempio di 10’000 volte. In questo caso non possiamo applicare una regola come nei casi precedenti perché la soluzione con la diluzione x1000 ha già raggiunto la neutralità (pH=7); aggiungere altra acqua (neutra) alla soluzione ormai neutra non porta ad alcun altro cambiamento del pH.
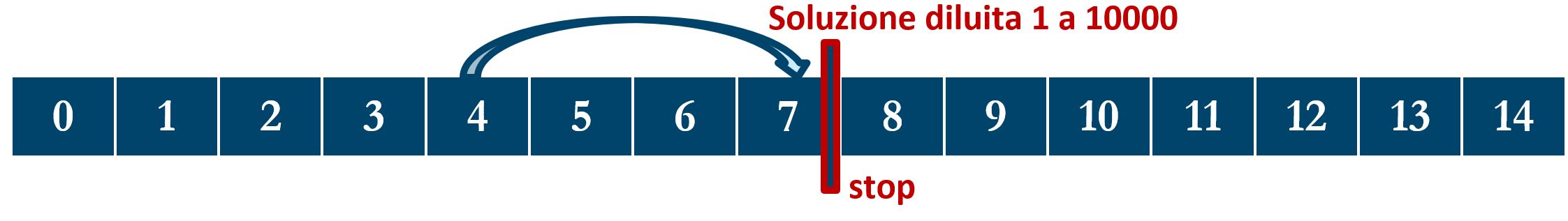
Possiamo così concludere una regola facilitativa di calcolo: Se in una soluzione con pH acido diluiamo la soluzione stessa di un fattore 10n, il valore del pH cresce di n unità, purché non superi il valore 7 di neutralità.
Diluizione di soluzioni basiche
Consideriamo ad esempio un litro di una soluzione con pH=10; la diluiamo di un fattore 10 aggiungendo 9 litri di acqua distillata, raggiungendo così un volume finale di 10 litri. Il valore pH=10 si sposta di una unità verso la neutralità (pH=7) passando da 10 a 9.

Similmente consideriamo ad esempio un litro di una soluzione con pH=10; la diluiamo questa volta di un fattore 100 aggiungendo 99 litri di acqua distillata, raggiungendo così un volume finale di 100 litri. Il valore pH=10 si sposta di due unità verso la neutralità (pH=7) passando da 10 a 8.

Similmente consideriamo ad esempio un litro di una soluzione con pH=10; la diluiamo questa volta di un fattore 1000 aggiungendo 999 litri di acqua distillata, raggiungendo così un volume finale di 1900 litri. Il valore pH=10 si sposta di tre unità verso la neutralità (pH=7) passando da 10 a 7.

Ora immaginiamo di diluire ancora di più, per esempio di 10’000 volte. In questo caso non possiamo applicare una regola come nei casi precedenti perché la soluzione con la diluzione x1000 ha già raggiunto la neutralità (pH=7); aggiungere altra acqua (neutra) alla soluzione ormai neutra non porta ad alcun altro cambiamento del pH.
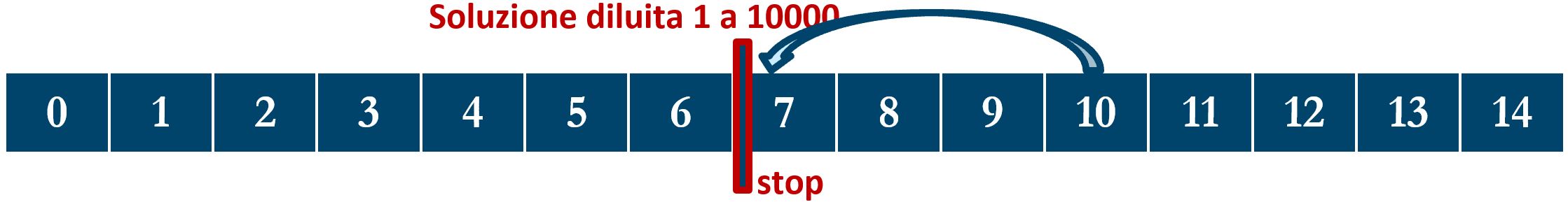
Possiamo così concludere una regola facilitativa di calcolo: Se in una soluzione con pH basico diluiamo la soluzione stessa di un fattore 10n, il valore del pH decresce di n unità, purché non scenda al di sotto del valore 7 di neutralità.
© il testo e le immagini sono di esclusiva proprietà dell’autore e sono sottoposti a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito
9.1 Autoprotolisi
9.2 Soluzioni acide e basiche – pH
9.3 Definizione di acido e base
9.4 Acidi mono e poli-protici
9.5 Costante di equilibrio di acidi e basici
9.6 Acidi e basi forti e deboli
9.7 Rapporto tra Ka e Kb
9.8 Acidi e basi FORTI in soluzione
9.9 Diluizioni di acidi e basi forti in soluzione
9.10 Acidi e basi DEBOLI in soluzione
9.11 Neutralizzazione
9.12 Sali neutri, acidi e basici
9.13 Tamponi


