4.4 Polarità delle molecole
Quando all’interno di una molecola sono presenti uno o più momenti di dipolo di legame dobbiamo considerare la loro somma vettoriale. Se la somma vettoriale è nulla, la molecola risulta apolare; altrimenti avremo molecole polari.
4.4.1 molecole polari
Esempi tipici di molecole polari li abbiamo con l’acqua e con l’ammoniaca.
| Polarità della molecola dell’acqua H2O | |
 |
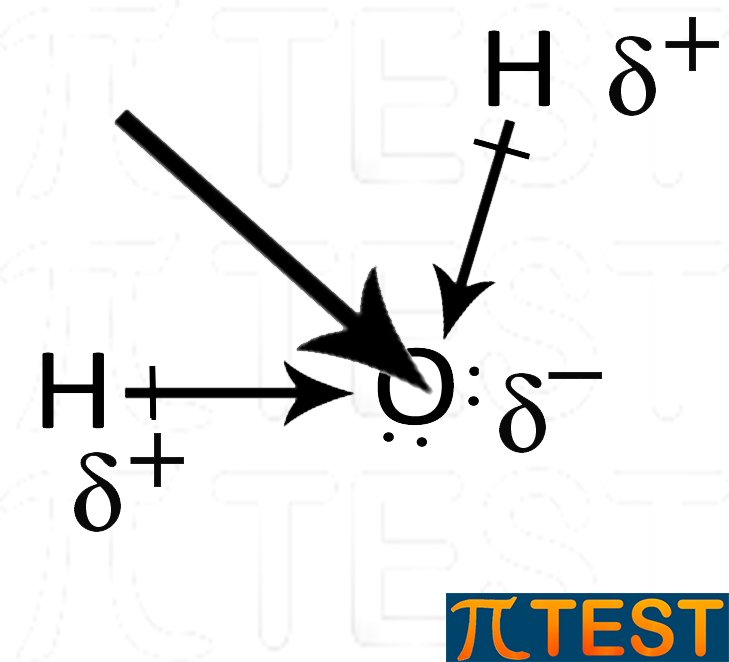 |
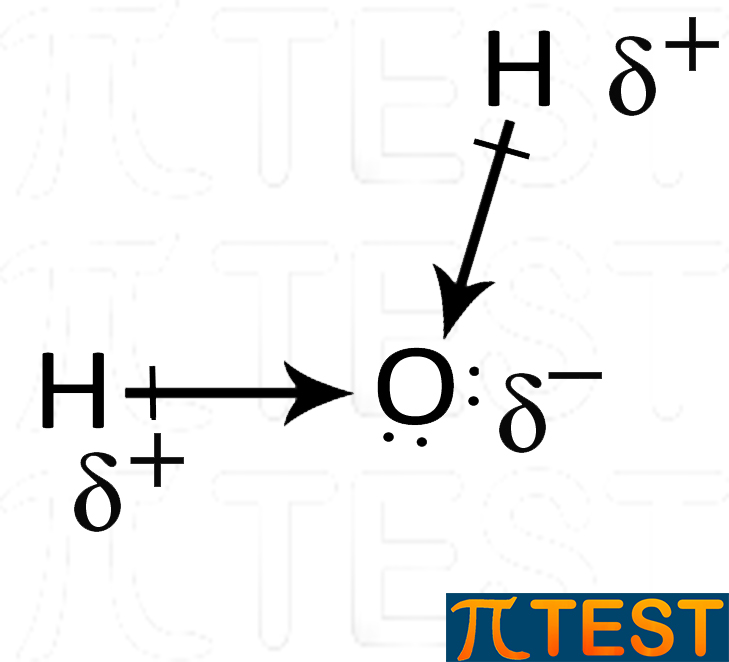
| La molecola dell’acqua presenta due legami covalenti polari. I due momenti di dipolo sono rappresentati dalle frecce. | I due momenti di dipolo si sommano vettorialmente rendendo la molecola complessivamente polare. La freccia grande rappresenta la somma vettoriale dei due momenti di dipolo. |
| Polarità della molecola dell’ammoniaca NH3 | |
 |
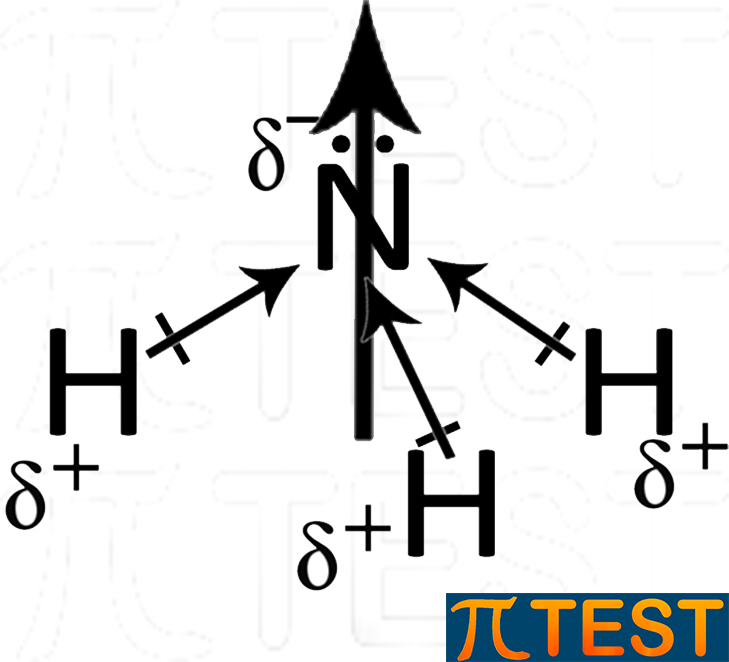 |
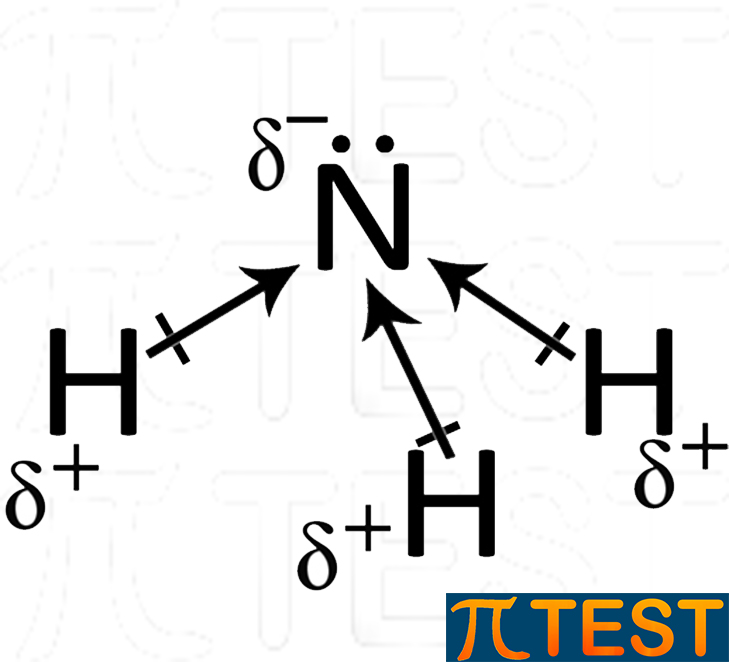
| La molecola dell’ammoniaca presenta tre legami covalenti polari distribuiti secondo la sua geometria piramidale tipica. I tre momenti di dipolo sono rappresentati dalle frecce. | I tre momenti di dipolo si sommano vettorialmente rendendo la molecola complessivamente polare. La freccia grande rappresenta la somma vettoriale dei tre momenti di dipolo. |
4.4.2 molecole apolari
Tutte le molecole di elementi puri (H2, N2, O2, ecc.) sono apolari in quanto i legami presenti sono tutti omopolari.
Esistono anche casi particolari nei quali all’interno della molecola sono presenti legami polari che però si annullano nella somma vettoriale. Esempi tipici sono l’anidride carbonica CO2, il metano CH4 e il tetraclorometano.
|
Anidride carbonica CO2 Nell’anidride carbonica i due atomi di ossigeno sono legati al carbonio con un doppio legame O=C=O e sono diametralmente opposti. I due momenti di dipolo risultano di conseguenza uguali ed opposti e si annullano. |
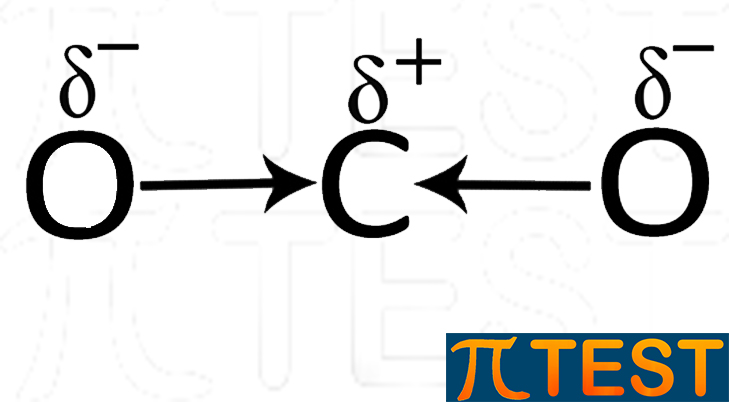 |
|
Metano CH4 Nel metano il carbonio è legato con legami semplici a quattro atomi di idrogeno secondo una geometria tetraedrica. Grazie alla simmetria spaziale di questa geometria i quattro momenti di dipolo si annullano. |
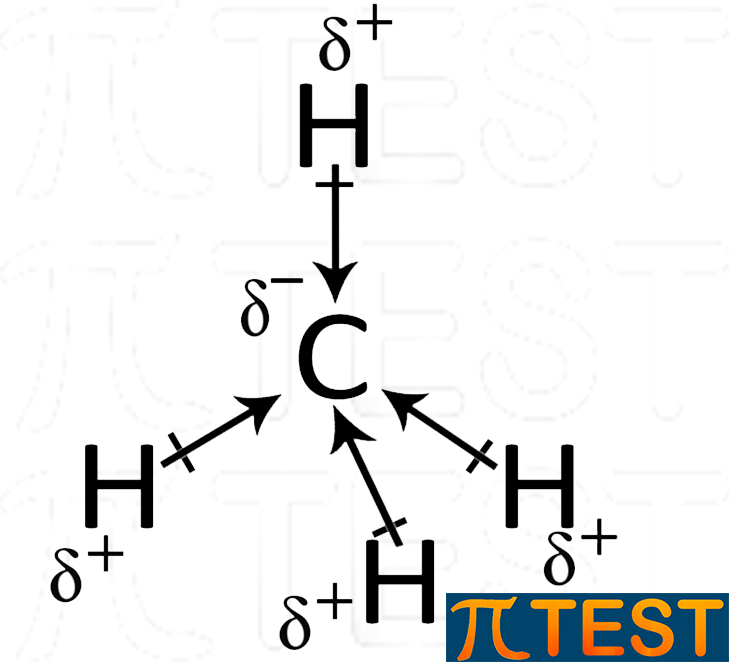 |
|
Tetraclorometano CCl4 Nel tetraclorometano si presenta lo stesso tipo di simmetria spaziale cha si trova nel metano. La differenza è solo nell’orientamento dei singoli dipoli. |
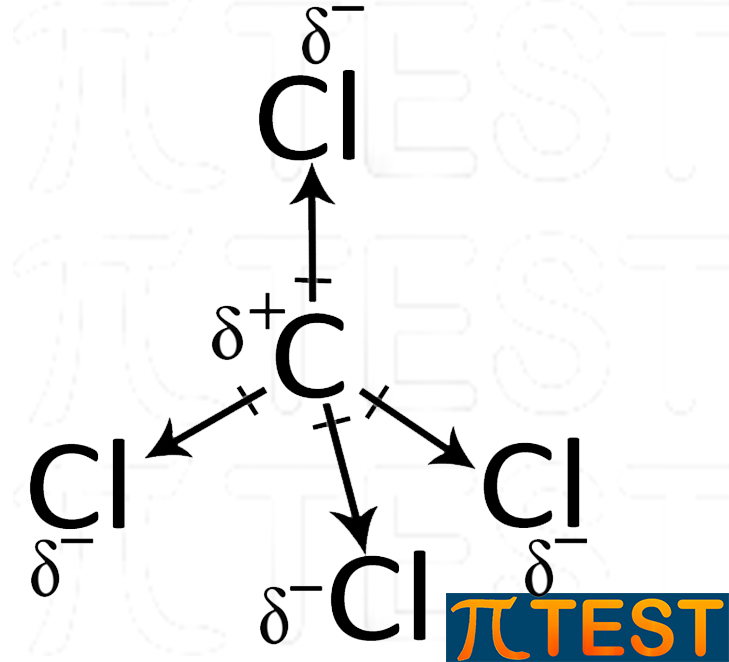 |
QUIZ Polarità delle molecole |
|||
|---|---|---|---|
© il testo è di esclusiva proprietà dell’autore ed è sottoposto a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito
4.5 Ibridazione degli orbitali


