7.4 Principio di Le Châtelier
Si tratta di un principio, ovvero di un sistema di ragionamenti, che ci permette di trarre conclusioni sugli effetti causati da perturbazioni apportate ad un sistema in equilibrio. Vale solo per sistemi in equilibrio.
Distinguiamo gli effetti dovuti:
- alla variazione della concentrazione di un reagente o di un prodotto operando dall’esterno
- alle variazioni di pressione e/o del volume mediante espansione o compressione del sistema
- alle variazioni di temperatura
7.4.1 Principio di Le Châtelier – variazioni delle concentrazioni
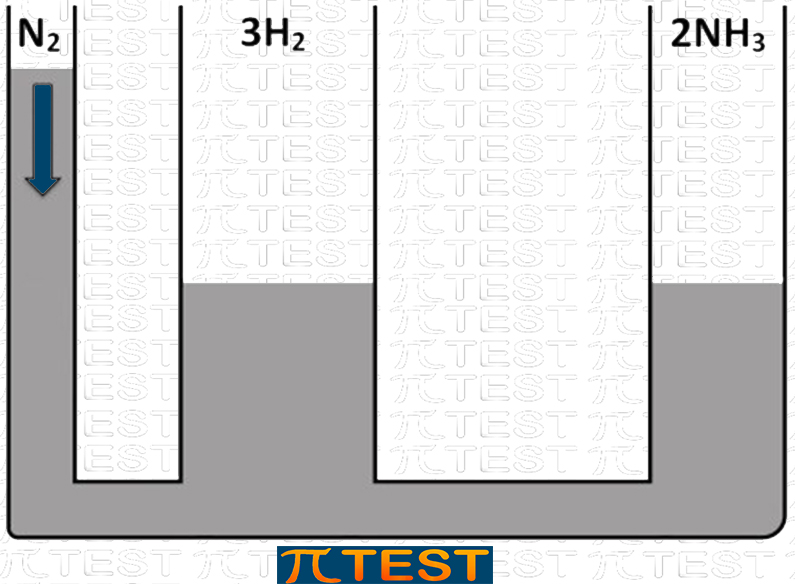
Immaginiamo una reazione come se fosse un travaso di un liquido in un sistema di vasi comunicanti.
Valutiamo l’effetto dell’aggiunta o della sottrazione di un reagente o di un prodotto. Vediamo di seguito diverse possibili azioni in riferimento alla reazione
N2(g) + 3H2(g) ⇆2NH3(g)
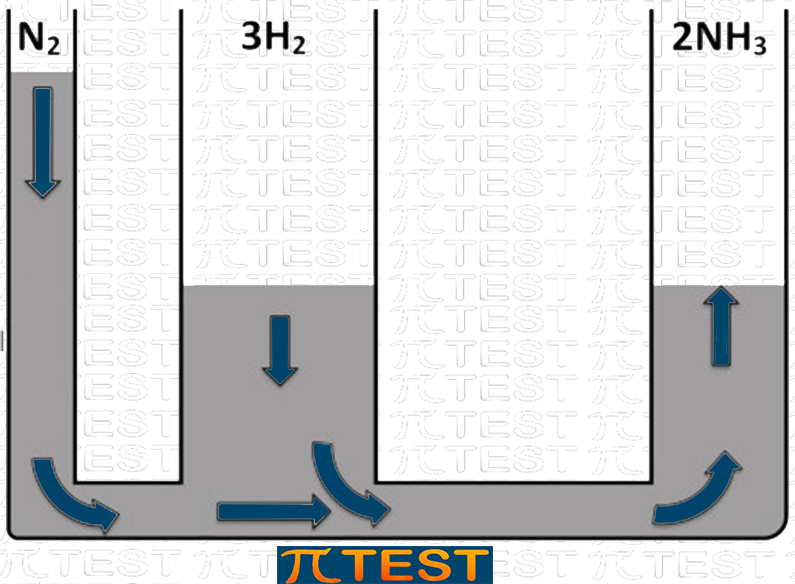
♦ Aggiungiamo il reagente N2
| Aggiungiamo il reagente N2 | L’equilibrio si sposta verso destra verso la formazione del prodotto NH3 consumando i reagenti N2 e H2 |
 |
 |
| N2(g) + 3H2(g) ➞ 2NH3(g) |
♦ Aggiungiamo il reagente H2
| Aggiungiamo il reagente H2 | L’equilibrio si sposta verso destra verso la formazione del prodotto NH3 consumando i reagenti N2 e H2 |
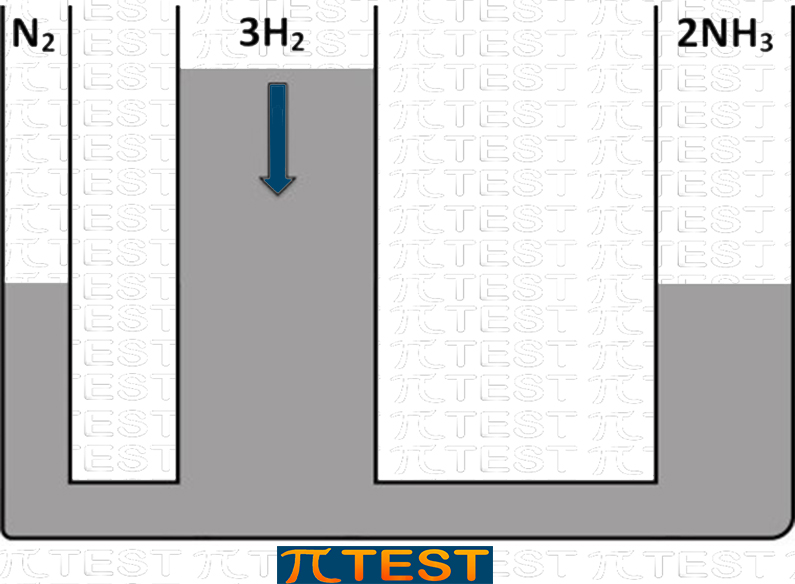 |
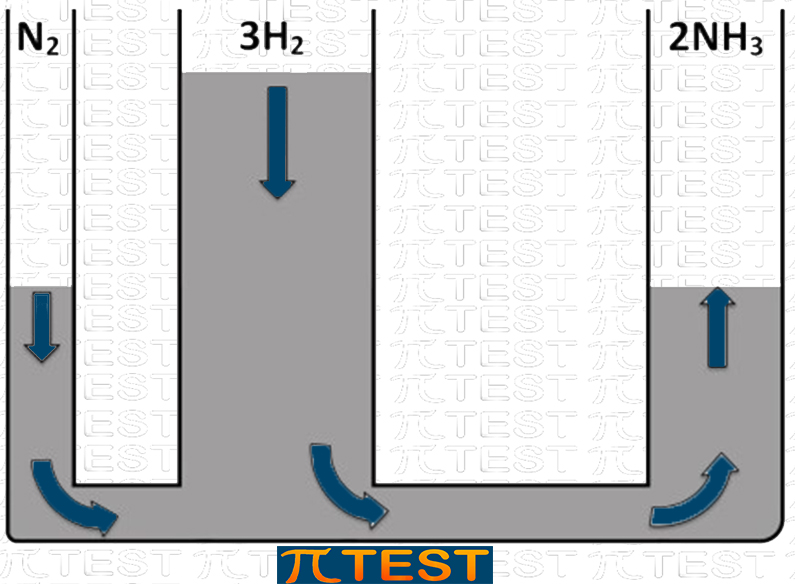 |
| N2(g) + 3H2(g) ➞ 2NH3(g) |
♦ Aggiungiamo il prodotto NH3
| Aggiungiamo il reagente H2 | L’equilibrio si sposta verso sinistra verso la formazione di N2 e H2 consumando NH3 |
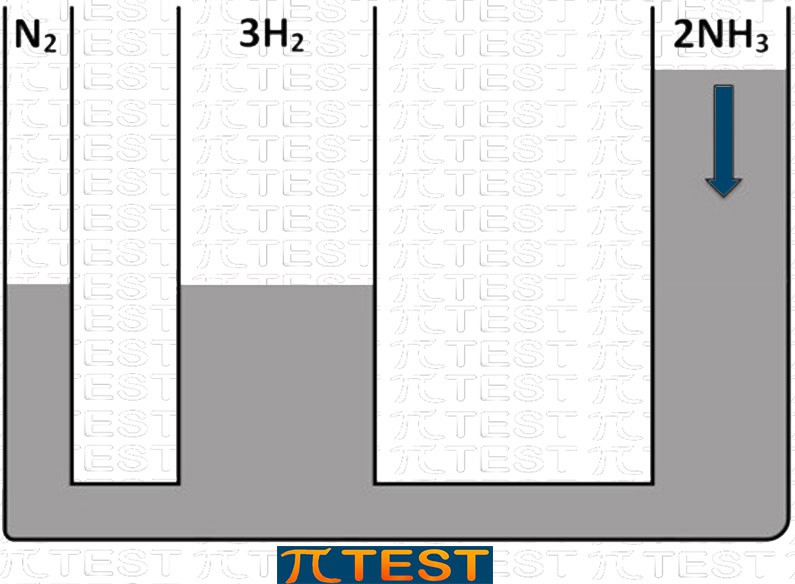 |
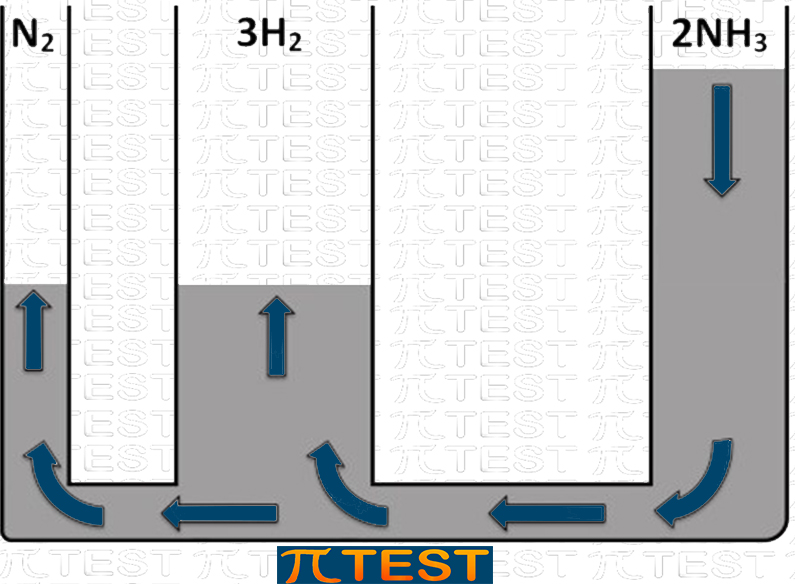 |
| N2(g) + 3H2(g) ⬅︎ 2NH3(g) |
♦ Togliamo il reagente N2
| Togliamo il reagente N2 | Aggiungiamo il reagente H2L’equilibrio si sposta verso sinistra verso la formazione di N2 e H2 consumando NH3 |
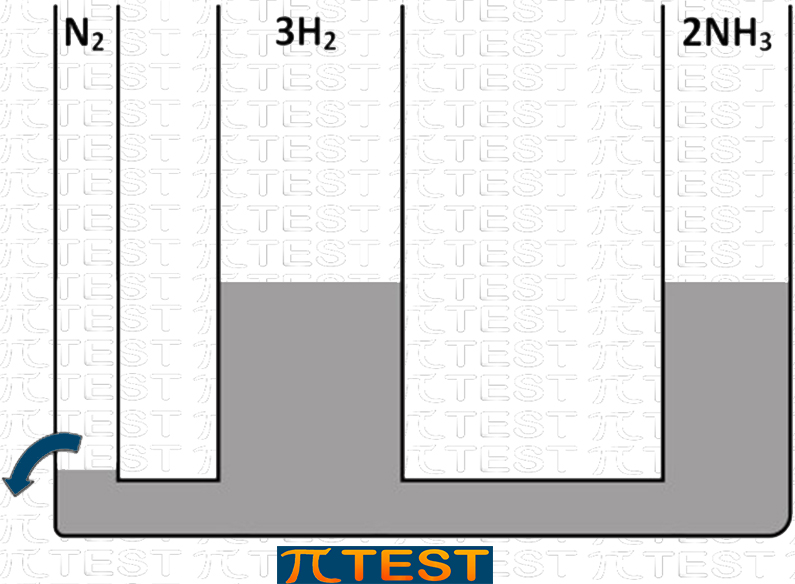 |
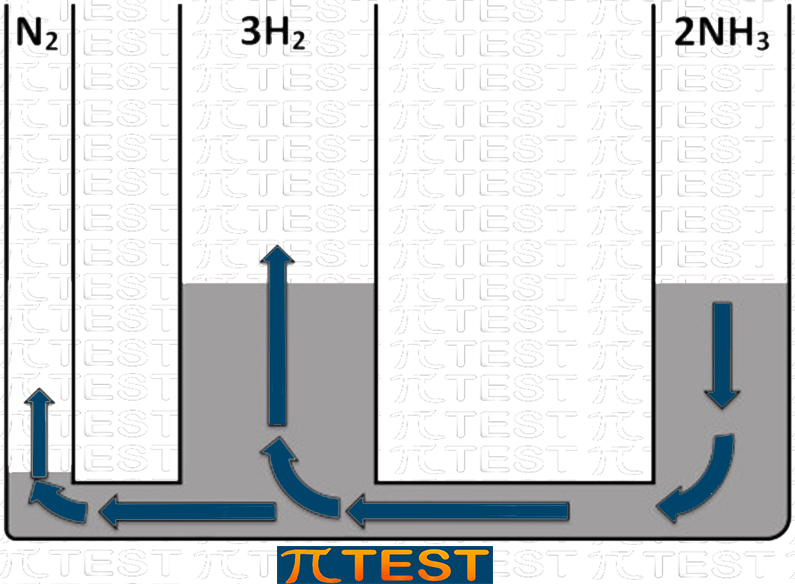 |
| N2(g) + 3H2(g) ⬅︎ 2NH3(g) |
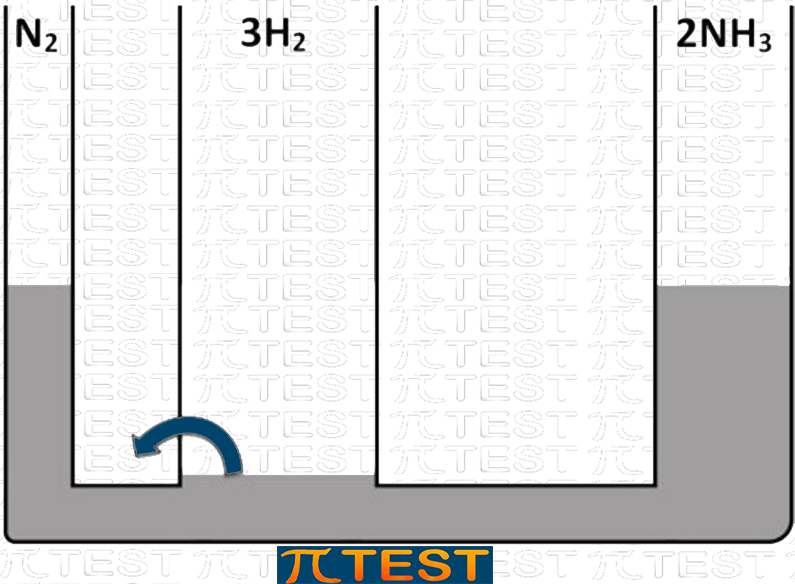
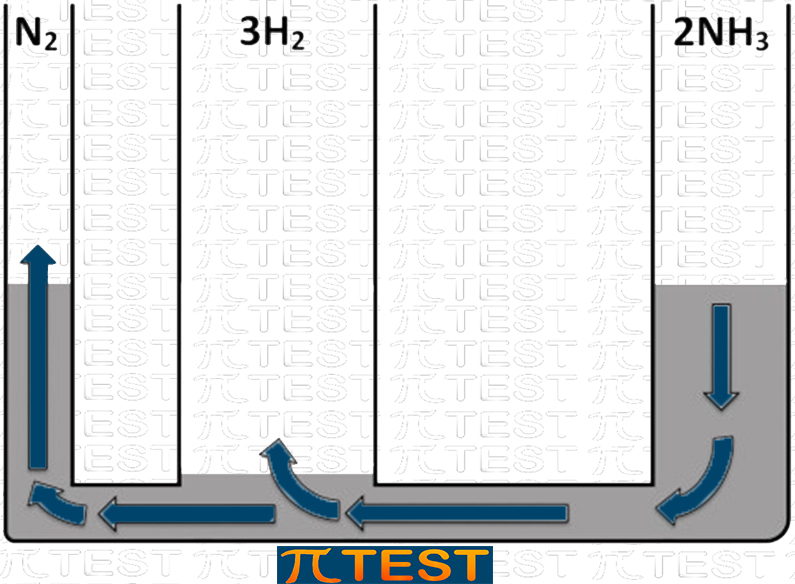
♦ Togliamo il reagente H2
| Togliamo il reagente H2 | Aggiungiamo il reagente H2L’equilibrio si sposta verso sinistra verso la formazione di N2 e H2 consumando NH3 |
 |
 |
| N2(g) + 3H2(g) ⬅︎ 2NH3(g) |
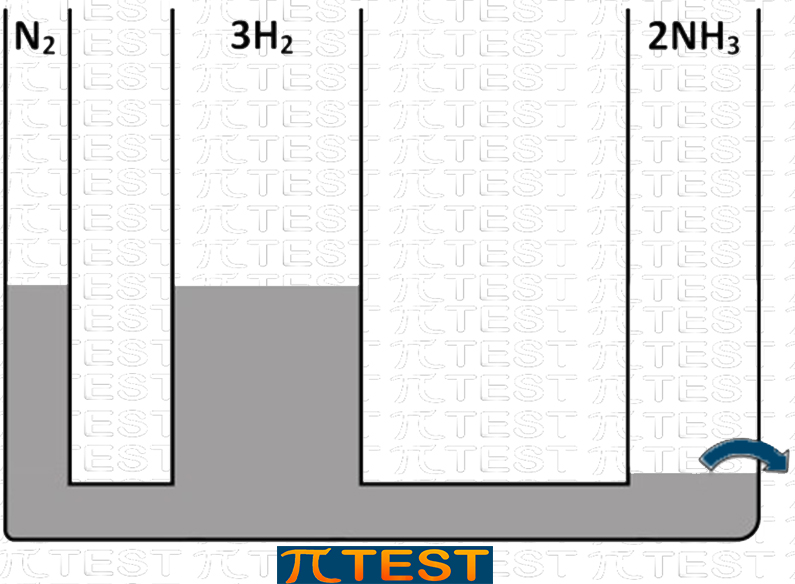
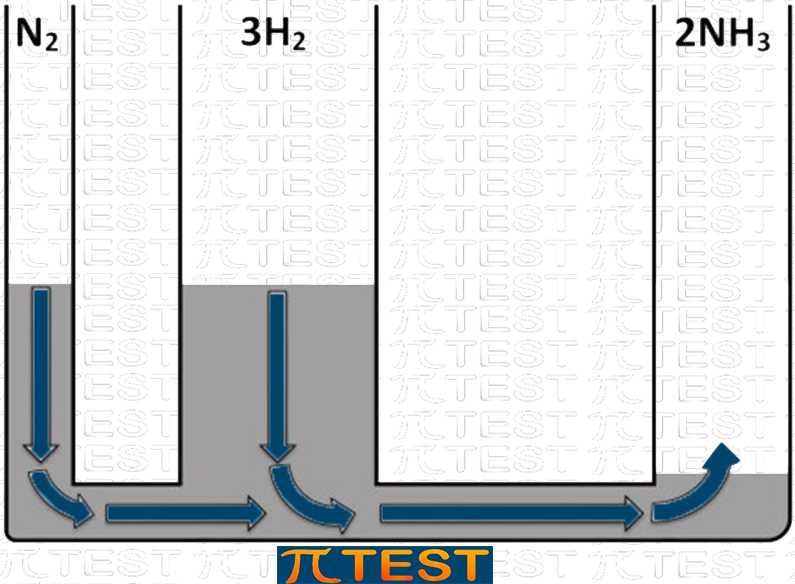
♦ Togliamo il prodotto NH3
| Togliamo il prodotto NH3 | L’equilibrio si sposta verso destra verso la formazione del prodotto NH3 consumando i reagenti N2 e H2 |
 |
 |
| N2(g) + 3H2(g) ➞ 2NH3(g) |
7.4.2 Principio di Le Châtelier – variazioni della pressione e/o del volume mediante espansione o compressione del sistema
Per valutare l’effetto di una espansione o di una compressione del sistema bisogna valutare le variazioni di moli gassose durante la reazione. Seguiamo alcuni esempi.
Esempio 1 – diminuzione di moli di specie gassose
N2(g) + 3H2(g) ⇆ 2NH3(g)
1 mole + 3 moli ⇆ 2 moli
A sinistra nei reagenti abbiamo 3 moli di H2 ed una mole di N2 , in tutto quattro moli . A destra tra i prodotti abbiamo due moli di NH3. Il numero complessivo di moli passa da 4 a 2. In pratica la reazione comporta una diminuzione di moli si specie gassose.
Poiché le moli gassose diminuiscono lungo la reazione, se comprimiamo il sistema è come se lo aiutiamo a procedere secondo la propria natura. Se invece provochiamo una espansione al sistema, sfavoriamo la reazione.
|
diminuzione di moli di specie gassose Comprimere la miscela sposta l’equilibrio a destra Espandere la miscela sposta l’equilibrio a sinistra |
Esempio 2 – aumento di moli di specie gassose
PCl5(g) ⇆ PCl3(g) + Cl2(g)
1 mole ⇆ 1 mole + 1 mole
A sinistra nei reagenti abbiamo 1 mole di PCl5. A destra tra i prodotti abbiamo una mole di PCl3 ed una mole di Cl2, in tutto due moli. Il numero complessivo di moli passa da 1 a 2. In pratica la reazione comporta un aumento di moli si specie gassose.
Poiché le moli gassose aumentano lungo la reazione, se comprimiamo il sistema è come se lo impediamo a procedere secondo la propria natura.
Poiché le moli gassose aumentano lungo la reazione, se comprimiamo il sistema è come se non volessimo che la reazione avviene. Se invece provochiamo una espansione al sistema, favoriamo la reazione perché stiamo lasciando più spazio ad una reazione che espande le fasi gassose.
|
aumento di moli di specie gassose Comprimere la miscela sposta l’equilibrio a sinistra Espandere la miscela sposta l’equilibrio a destra |
7.4.3 Principio di Le Châtelier – variazioni di temperatura
Per valutare l’effetto della temperatura teniamo conto del calore di reazione, cioè se una reazione è esotermica o endotermica. Consideriamo il calore di reazione come un componente della reazione.
Reazione esotermica: il calore è un prodotto della reazione.
αA + βB ⇆ γC + δD + calore
Reazione endotermica: il calore è un reagente della reazione.
αA + βB + calore
7. La termodinamica chimica
7.1 Il Sistema termodinamico
7.2 Le grandezze della termodinamica
7.3 L’equilibrio chimico
7.4 Il Principio di Le Châtelier
7.5 Cinetica Chimica – I Catalizzatori
7.6 Cinetica Chimica – Velocità di reazione
⇆ γC + δD
Consideriamo una temperatura alta del sistema come una forte presenza di calore che favorisce le reazioni endotermiche (consumano il calore assorbendolo) e sfavorisce le reazioni esotermiche (producono calore e trovandolo già presente e come se aggiungessimo alla reazione uno dei prodotti).
Viceversa consideriamo una temperatura bassa del sistema come una scarsa presenza di calore che favorisce le reazioni esotermiche e sfavorisce le reazioni endotermiche.
© il testo e le immagini sono di esclusiva proprietà dell’autore e sono sottoposti a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito
QUIZ sul Principio di Le Châtelier |
|||
|---|---|---|---|
7.5 Cinetica Chimica – catalizzatori


