6.1 Bilanciamento delle reazioni
Le reazioni chimiche sono trasformazioni della materia che comportano la rottura di legami chimici e la formazione di nuovi.
Nella combustione del metano una molecola di metano CH4 reagisce con l’ossigeno per restituire CO2 e H2O. In questa reazione si libera energia termica.
I legami esistenti tra il carbonio e l’idrogeno all’interno della molecola di metano CH4 si rompono e si rompe anche il legame esistente tra due atomi di ossigeno in O2. Gli atomi in gioco si legano poi diversamente andando a formare acqua H2O ed anidride carbonica CO2.
Per il principio di conservazione della materia di Lavoisier in una reazione chimica la somma delle masse dei reagenti è uguale alla somma delle masse dei prodotti. Per questo motivo nello scrivere una reazione chimica dobbiamo introdurre i coefficienti stechiometrici che sono numeri opportuni con i quali è possibile mantenere per ciascuna specie l’uguaglianza tra il numero di atomi presenti nei reagenti e nei prodotti.
Nella reazione di combustione del metano avremo:
CH4 + 2 O2 ➞ CO2 + 2 H2O
Ossigeno O2 ed acqua H2O hanno coefficiente stechiometrico 2; il metano CH4 e l’anidride carbonica CO2 hanno coefficiente stechiometrico 1, valore che non viene scritto.
Metano ed ossigeno sono detti reagenti; anidride carbonica ed acqua sono detti prodotti.
Quando una reazione chimica viene scritta con i coefficienti stechiometrici si dice che è bilanciata.
Quando leggiamo una reazione chimica bilanciata possiamo interpretare i coefficienti stechiometrici riferiti a molecole oppure a moli di molecole. Possiamo così interpretare la reazione in questi due modi:
“una molecola di metano reagisce con due molecole di ossigeno per produrre una molecola di anidride carbonica e due molecole d’acqua”
“una mole di metano reagisce con due moli di ossigeno per produrre una mole di anidride carbonica e due moli d’acqua”
I coefficienti stechiometrici possono essere interpretati come rapporti tra moli delle sostanze che intervengono nella reazione:
CH4 + 2 O2 ➞ CO2 + 2 H2O
1 : 2 ➞ 1 : 2
Interpretiamo queste proporzioni dicendo che tra i reagenti le moli di ossigeno sono il doppio rispetto a quelle di metano. Con analogo ragionamento tra i prodotti possiamo dire che le moli di acqua sono il doppio rispetto a quelle di anidride carbonica. Possiamo utilizzare le proporzioni dicendo anche che per ogni mole di metano che reagisce ne occorrono due di ossigeno e se ne producono una di anidride carbonica e due di acqua.
Facciamo attenzione al fatto che i coefficienti non si riferiscono mai alle masse. Quando il quiz fornisce le masse dobbiamo trasformarle in moli utilizzando il peso molecolare:
| grandezza | Unità di misura | |
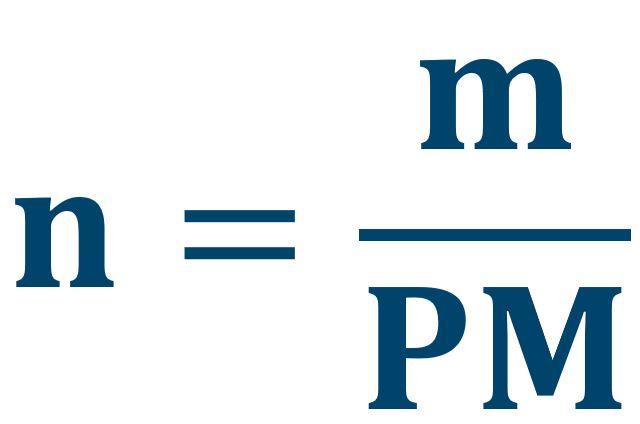 |
m = massa | g (grami) |
| n = numero di moli | mol (moli) | |
| PM = peso molecolare | g/mol |
In alcuni quiz invece delle moli si fa riferimento al litri di gas in condizioni standard (1 atm e 0°C). Per il principio di Avogadro 1 mole di gas in condizioni standard corrisponde a 22,4 litri. In alcuni quiz è necessario effettuare una semplice equivalenza tra moli e litri. In altri quiz tutti i reagenti e tutti i prodotto sono in fase gassosa e tutti i dati forniti e richiesti sono espressi in litri; in tal caso si opera con i coefficienti stechiometrici sui litri come si farebbe con le moli.
REGOLE DI BILANCIAMENTO
Esistono regole operative per bilanciare le reazioni chimiche, a volte chiamate anche equazioni chimiche proprio per il fatto che si effettuano calcoli per individuare i coefficienti stechiometrici.
Nei quiz non viene mai richiesto di saper effettuare i bilanciamenti, ma vengono proposti possibili bilanciamenti nelle risposte. come nei quiz che trovi in fondo a questa pagina.
Le uniche reazioni che bisogna saper bilanciare per affrontare i quiz dei test di ammissione sono le reazione di combustione degli idrocarburi.
QUIZ su Il bilanciamento delle reazioni |
|||
|---|---|---|---|
© il testo è di esclusiva proprietà dell’autore ed è sottoposto a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito


