9.13 Tamponi
Esistono soluzioni particolari che hanno la caratteristica di mantenere costante il pH anche se intervengono aggiunte di un acido o di una base.
Il sangue è un esempio di soluzione tamponata. Il pH del sangue umano è 7,4.
L’aggiunta di 0,010 moli per litro di acido o base forte porta ad una variazione di solo 0,1 unita.
In confronto, se la stessa quantità di acido viene aggiunta ad acqua pura, il pH, da 7,00, diventa 2,00.
Per realizzare una soluzione tampone è necessaria la presenza simultanea in quantità approssimativamente uguali:
- di un acido debole e della sua base coniugata;
oppure
- di una base debole e del suo acido coniugato
in quantità approssimativamente uguali.
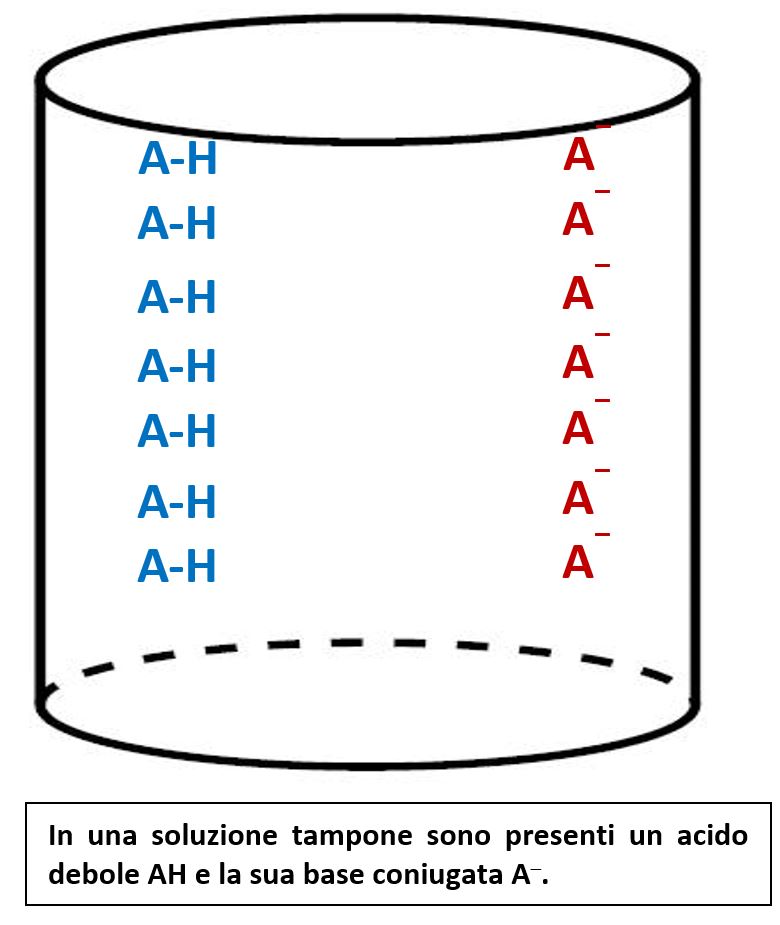
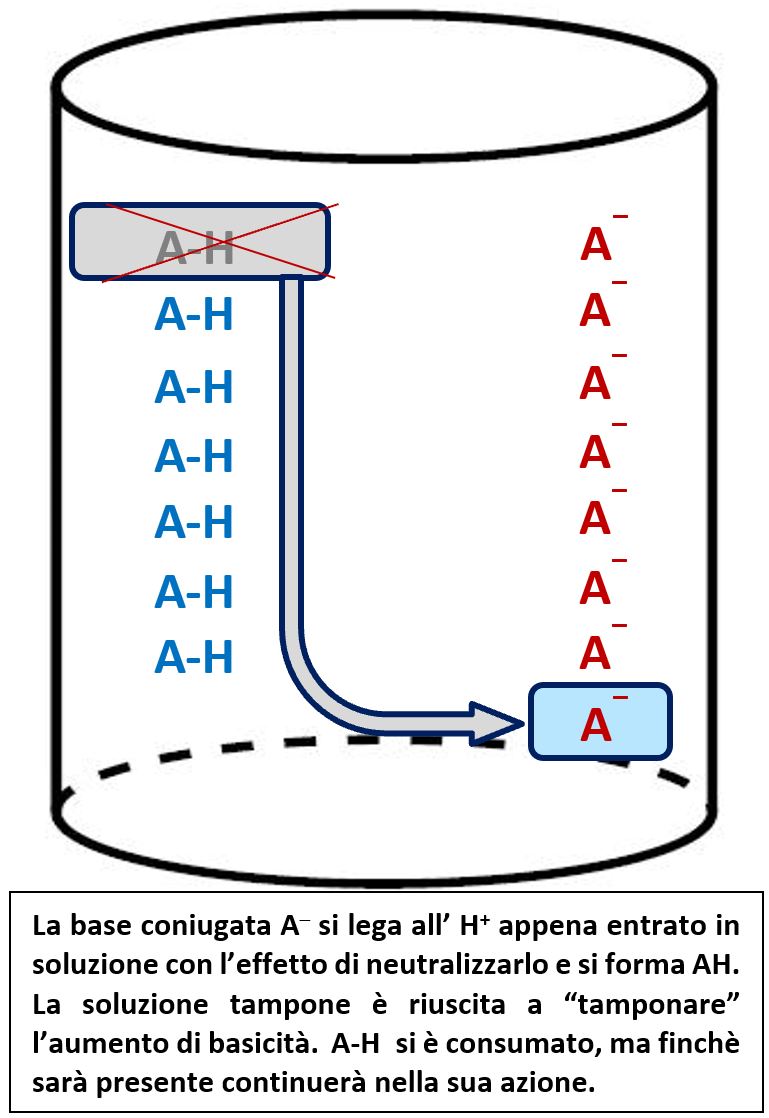
Per comprendere il funzionamento del sistema tampone immaginiamo di avere in soluzione una identica quantità (stesso numero di moli) di acido acetico CH3COOH e di acetato di sodio CH3COONa. A causa della natura “forte” di Na, l’acetato di sodio in soluzione è completamente dissociato nel catione forte Na+ e nell’anione CH3COO─ che è la base coniugata dell’acido acetico. Rappresentiamo l’acido debole (CH3COOH) in forma generica di acido come AH e la base coniugata (CH3COO─) come A─. In figura vediamo la situazione. In questa situazione l’acido non dà luogo a idrolisi acida, cioè non rilascia H+. Allo stesso tempo la base non si comporta da base accettando H+. Potremmo dire che entrambi sono fermi e si bloccano a vicenda.
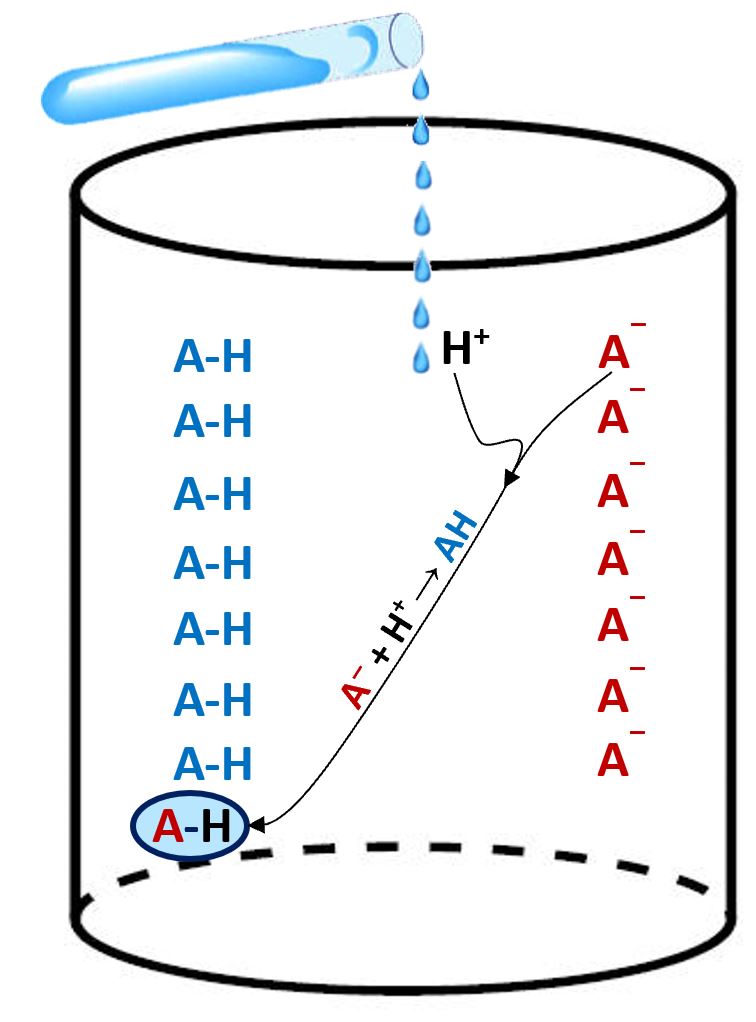
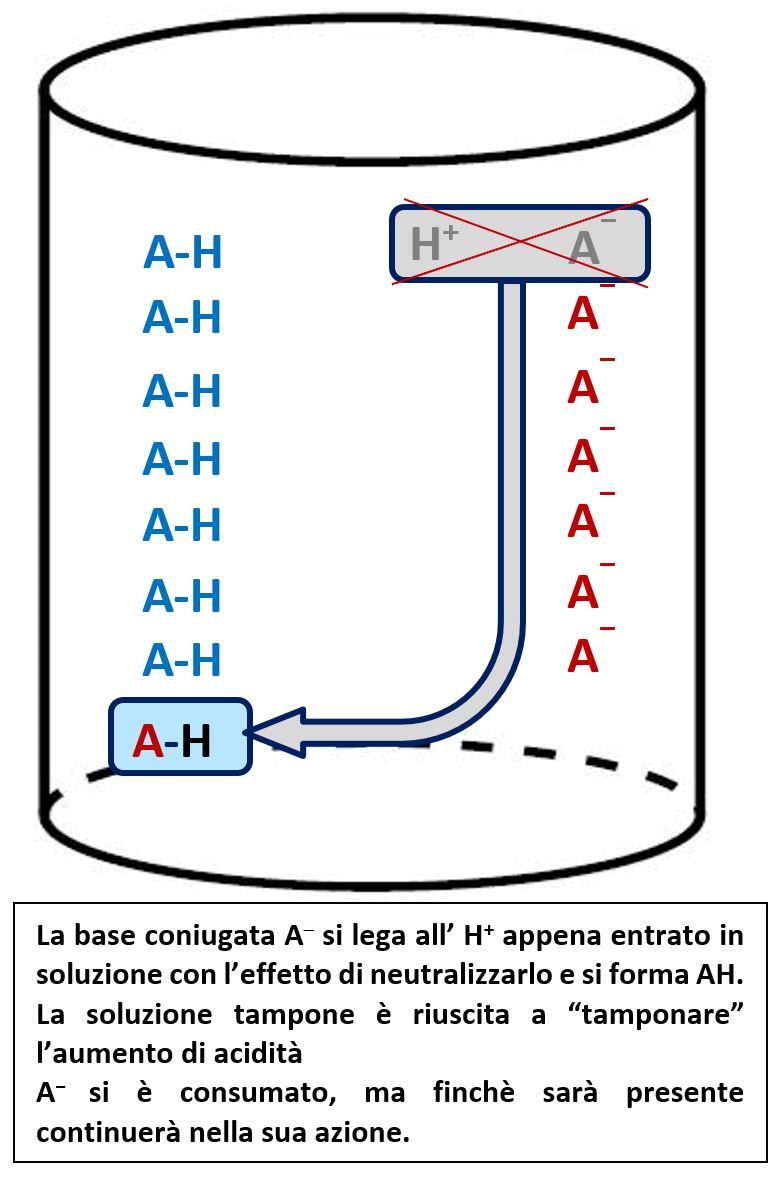
Immaginiamo che dall’esterno avviene un tentativo di turbamento del pH con l’introduzione di un acido che rilascia in soluzione ioni H+. Questi vengono catturati dalla base A─ che si trasforma in acido AH. Il risultato è quello del veder scomparire gli H+ aggiunti; il pH non varia. In assenza del sistema tampone l’aggiunta di H+ avrebbe variato il valore del pH.
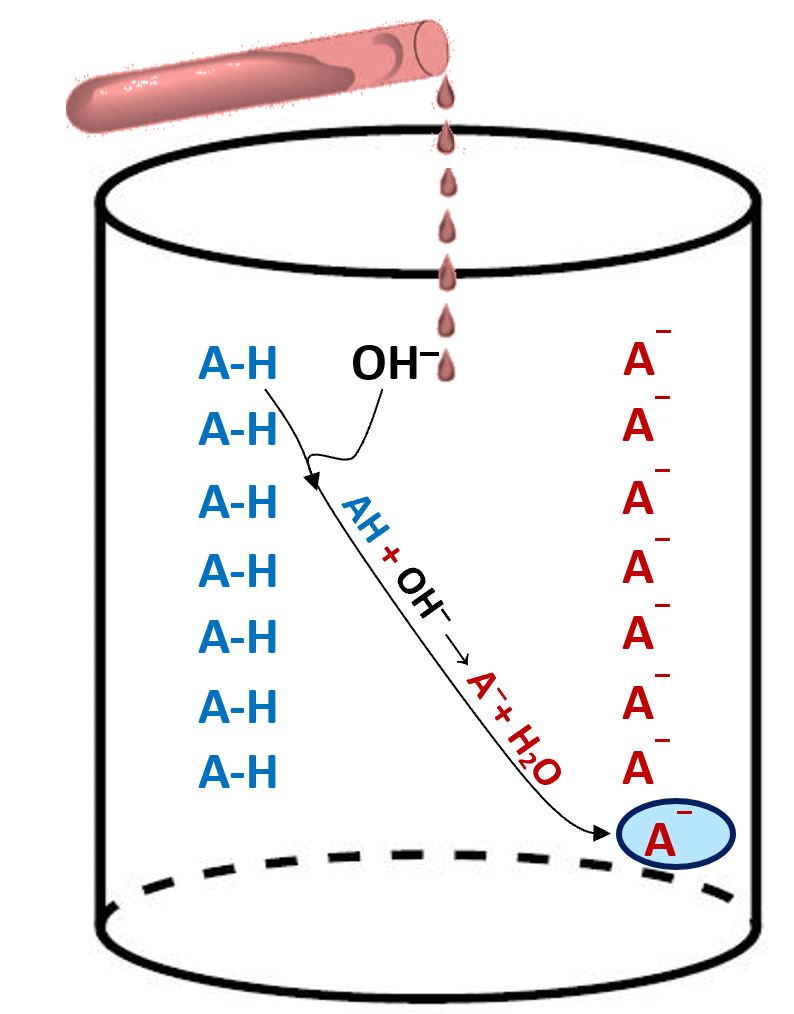
Immaginiamo ora invece che dall’esterno avviene un tentativo di turbamento del pH con l’introduzione di una base che rilascia in soluzione ioni OH‒. Questi vengono catturati dall’ acido AH che si trasforma nella base coniugata A‒. Il risultato è quello del veder scomparire gli OH‒ aggiunti; il pH non varia. In assenza del sistema tampone l’aggiunta di OH‒ avrebbe variato il valore del pH.
Tamponi – Realizzazione
Per avere una soluzione tampone ci sono due metodi:
1) Aggiungere ad un volume di acqua un acido debole ed il suo sale in quantità molare simile
[oppure una base debole ed il suo sale in quantità molare simile]
Esempio:
in 1 L di acqua mettere 1 mole di CH3COOH ed una mole di CH3COONa
2) Aggiungere ad un volume di acqua un acido debole e neutralizzarne una metà con una base forte
[oppure una base debole e neutralizzarne una metà con un acido forte]
Esempio:
in 1 L di acqua mettere 1 mole di CH3COOH e 0,5 moli di NaOH.
Le 0,5 moli di NaOH neutralizzano 0,5 moli di acido acetico trasformandole in acetato di sodio.
Alla fine avremo 0,5 moli di acido acetico e 0,5 moli di acetato.
Tamponi – pH
Una soluzione tampone garantisce un valore di pH:
Per i tamponi costituiti da un acido debole con la sua base coniugata abbiamo:
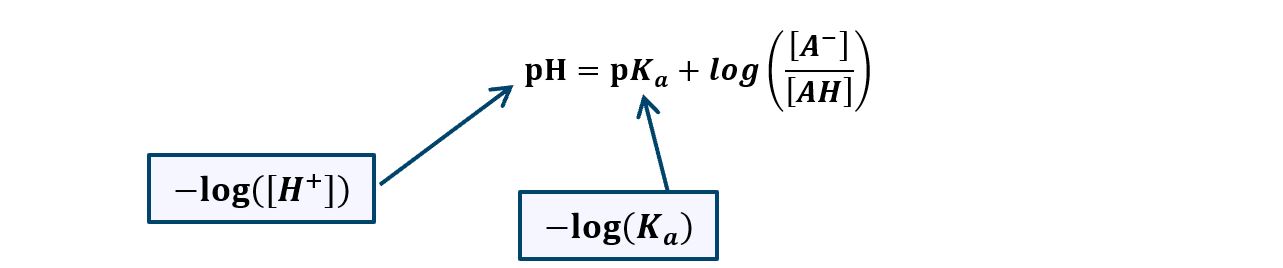
Per i tamponi costituiti da una base debole con il sua acido coniugato abbiamo:
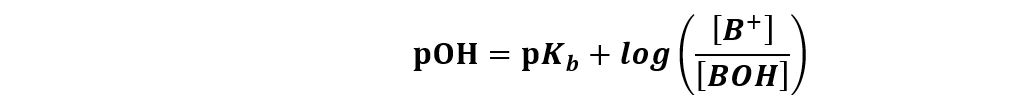
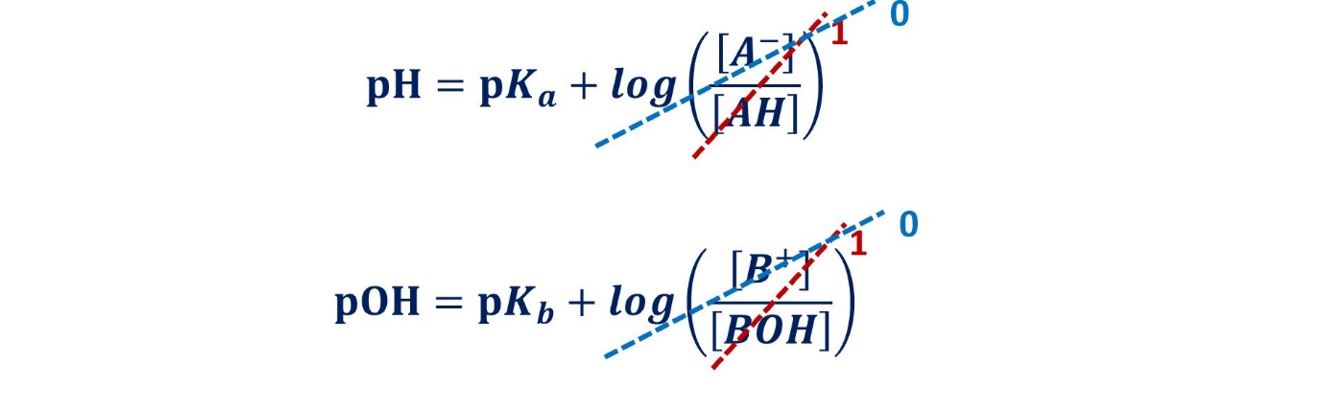
Se la concentrazione dell’acido debole è uguale alla concentrazione della sua base coniugata il rapporto [A‒]/[AH] è uguale a 1 ed il logaritmo del rapporto risulta 0. Infatti log(1)=0.
Stessa cosa per i tamponi realizzati con una base debole ed il suo acido coniugato. Se la concentrazione della base debole è uguale alla concentrazione del suo acido coniugato il rapporto [B+]/[BOH] è uguale a 1 ed il logaritmo del rapporto risulta 0.
Tamponi – Diluizioni
Il pH garantito e il potere tamponante di una soluzione tampone non si alterano se la soluzione viene diluita. Gli equilibri tamponanti rimangono validi e nella relazione che permette di calcolare il pH del tampone una diluizione comporta un fattore moltiplicativo identico nel numeratore e nel denominatore (elisione algebrica) dell’argomento del logaritmo.
Tamponi – sangue
Il sangue umano possiede un pH compreso tra 7,35 e 7,45. Questo valore viene garantito da un tampone che si crea tra l’acido carbonico e lo ione bicarbonato.
L’anidride carbonica prodotta nella respirazione cellulare si discioglie nel sangue grazie alla formazione di acido carbonico (infatti una anidride reagisce con l’acqua per formare un ossiacido):
CO2 + H2O ⇄ H2CO3
L’acido carbonico così prodotto è un acido debole che dà luogo ad una parziale idrolisi acida generando lo ione bicarbonato HCO3‒ (o idrogeno carbonato secondo la nomenclatura IUPAC)
H2CO3 ⇄ HCO3‒ + H+
Complessivamente l’equilibrio presente nel sangue è il seguente:
CO2 + H2O ⇄ H2CO3 ⇄ HCO3‒ + H+
La presenza sia dell’acido carbonico H2CO3 che dello ione bicarbonato HCO3‒ formano un sistema tampone che garantisce la costanza del pH del sangue. Possono avvenire però delle variazioni (non desiderate) che consistono nello spostamento dell’equilibrio verso destra con abbassamento del pH (acidemia) o verso sinistra con innalzamento del pH (alcalemia).
Quando abbiamo un abbassamento del pH, cioè di uno spostamento verso una maggior acidità, ovvero di una maggior quantità di H+ nel sangue, l’equilibrio si sposta così verso destra. Questo avviene quando si ha un eccesso di CO2 nel sangue (difficoltà polmonare a smaltire la CO2) che spinge verso destra le reazioni di equilibrio comportando un aumento di acido carbonico H2CO3 e poi di conseguenza di H+.
© il testo e le immagini sono di esclusiva proprietà dell’autore e sono sottoposti a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito
9.1 Autoprotolisi
9.2 Soluzioni acide e basiche – pH
9.3 Definizione di acido e base
9.4 Acidi mono e poli-protici
9.5 Costante di equilibrio di acidi e basici
9.6 Acidi e basi forti e deboli
9.7 Rapporto tra Ka e Kb
9.8 Acidi e basi FORTI in soluzione
9.9 Diluizioni di acidi e basi forti in soluzione
9.10 Acidi e basi DEBOLI in soluzione
9.11 Neutralizzazione
9.12 Sali neutri, acidi e basici
9.13 Tamponi


