4.3 Il legame covalente
Quando la differenza di elettronegatività tra i due atomi coinvolti nella formazione di un legame è inferiore al valore 1,7, si forma un legame covalente.
4.3.1 rappresentazioni di Lewis
Quando due atomi interagiscono mettendo in compartecipazione un elettrone ciascuno abbiamo un legame covalente. I due orbitali di origine che contenevano un elettrone ciascuno si fondono in un nuovo orbitale che chiameremo orbitale molecolare nel quale troviamo i due elettroni che provengono dai due orbitali originari.
Per un primo approccio consideriamo le rappresentazioni di Lewis con alcuni esempi.
| Due atomi di idrogeno H interagiscono mettendo in compartecipazione un elettrone ciascuno. | 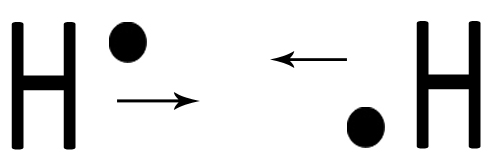 |
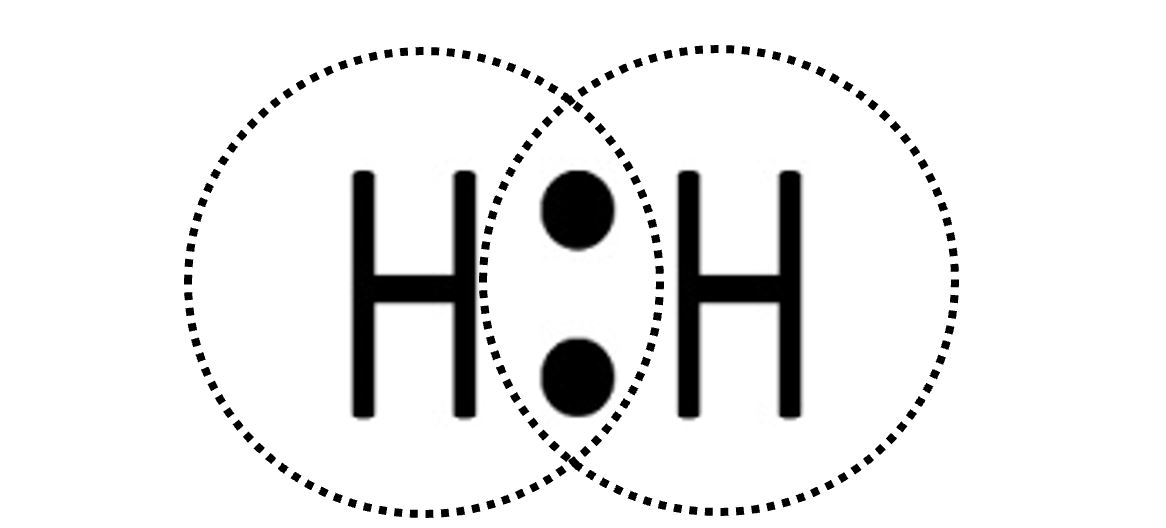
| I due elettroni ora si trovano in un nuovo orbitale che appartiene ad entrambi. Non è un orbitale atomico, come quelli che abbiamo studiato nelle configurazioni elettroniche, ma un nuovo tipo di orbitale che chiamiamo orbitale molecolare. | 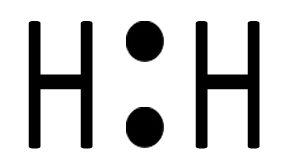 |
| Ciascun atomo di idrogeno ora possiede due elettroni e avrà perciò il duetto completo (nel primo livello si parla di duetto e non di ottetto). La situazione è stabile perché ciascuno dei due ha raggiunto il completamento del guscio di valenza. Si tratta di H2, l’idrogeno molecolare , che può essere rappresentato con la formula di struttura H‒H. |
 |
| Un atomo di idrogeno H ed uno di fluoro F interagiscono mettendo in compartecipazione un elettrone ciascuno. | 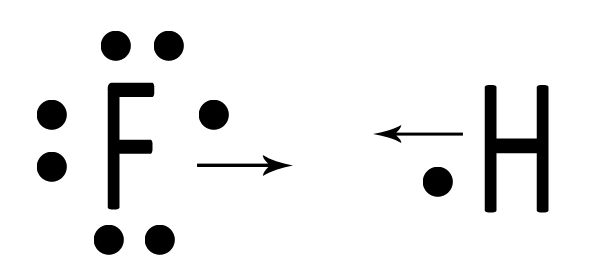 |
| I due elettroni ora si trovano in un nuovo orbitale molecolare che appartiene ad entrambi. | 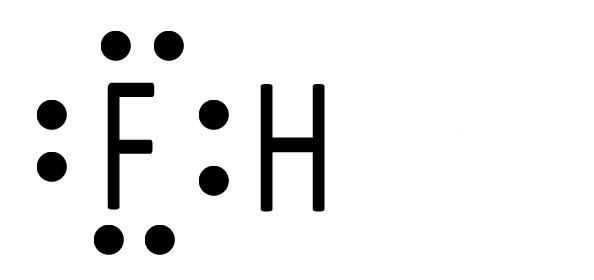 |
| Ciascun atomo di idrogeno ora possiede due elettroni. Il fluoro avrà perciò l’ottetto completo e l’idrogeno il duetto. La situazione è stabile perché ciascuno dei due ha raggiunto il completamento del guscio di valenza. Si tratta di HF, l’acido fluoridrico, che può essere rappresentato con la formula di struttura H‒F. |
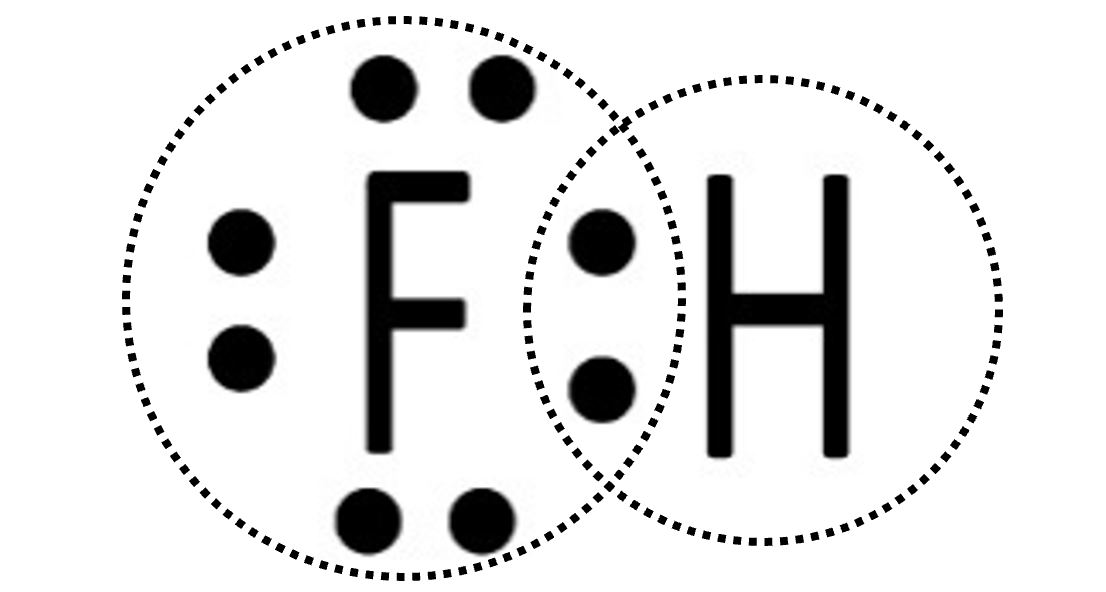 |
| Due atomi di cloro Cl interagiscono mettendo in compartecipazione un elettrone ciascuno. | 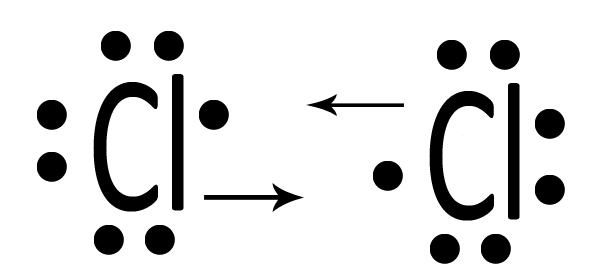 |
| I due elettroni ora si trovano in un nuovo orbitale molecolare che appartiene ad entrambi. | 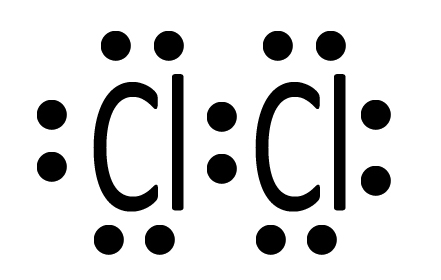 |
| Ciascun atomo di cloro ora possiede otto elettroni ed avrà perciò l’ottetto completo. La situazione è stabile perché ciascuno dei due ha raggiunto il completamento del guscio di valenza. Si tratta di Cl2, il cloro gassoso. Con un doppietto condiviso il cloro possiede un legame singolo che può essere rappresentato con la formula di struttura Cl─Cl. |
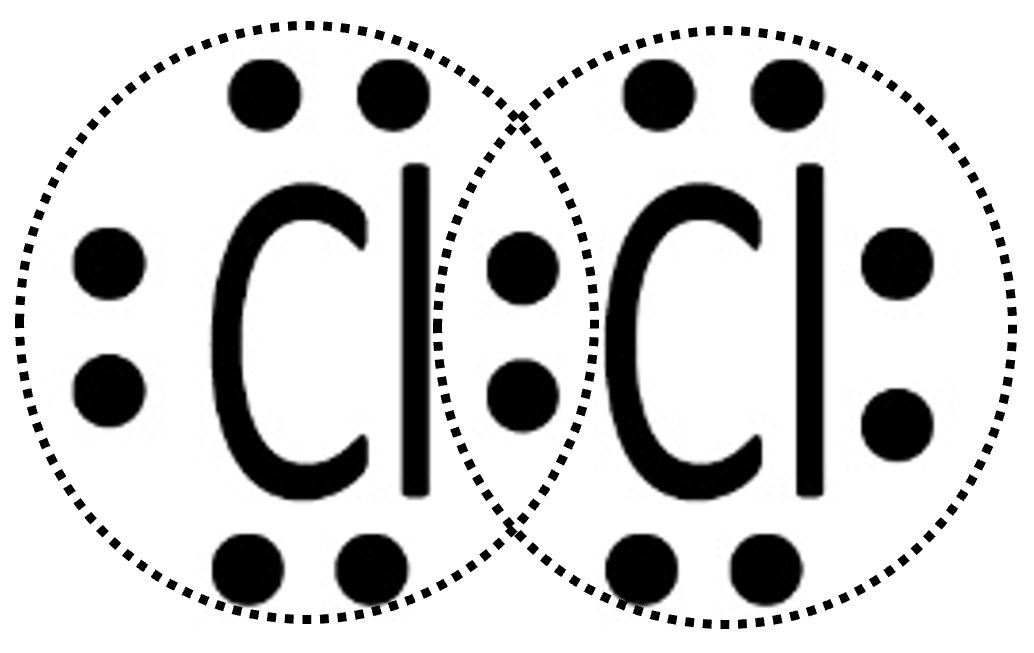 |
Nei tre esempi precedenti i due elettroni messi in compartecipazione sono chiamati anche “doppietto condiviso” e sono indicativi della presenza di un legame molecolare covalente.
A volte abbiamo anche la possibilità di mettere in compartecipazione due elettroni per ciascun atomo come nel seguente esempio.
| Due atomi di ossigeno O interagiscono mettendo in compartecipazione due elettroni ciascuno. | 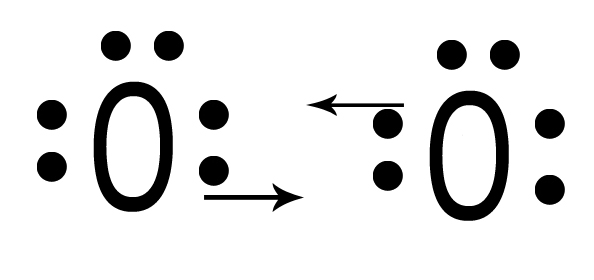 |
| I quattro elettroni ora si trovano in DUE nuovi orbitali molecolari che appartengono ad entrambi. | 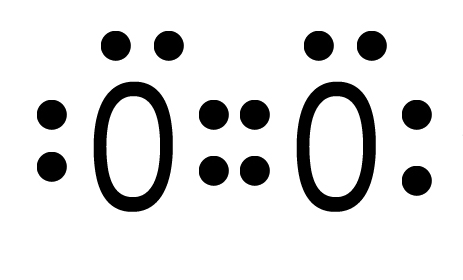 |
| Ciascun atomo di ossigeno ora possiede otto elettroni ed avrà perciò l’ottetto completo. La situazione è stabile perché ciascuno dei due ha raggiunto il completamento del guscio di valenza. Si tratta di O2, l’ossigeno gassoso. Con due doppietti condivisi l’ossigeno possiede un doppio legame che può essere rappresentato con la formula di struttura O=O. |
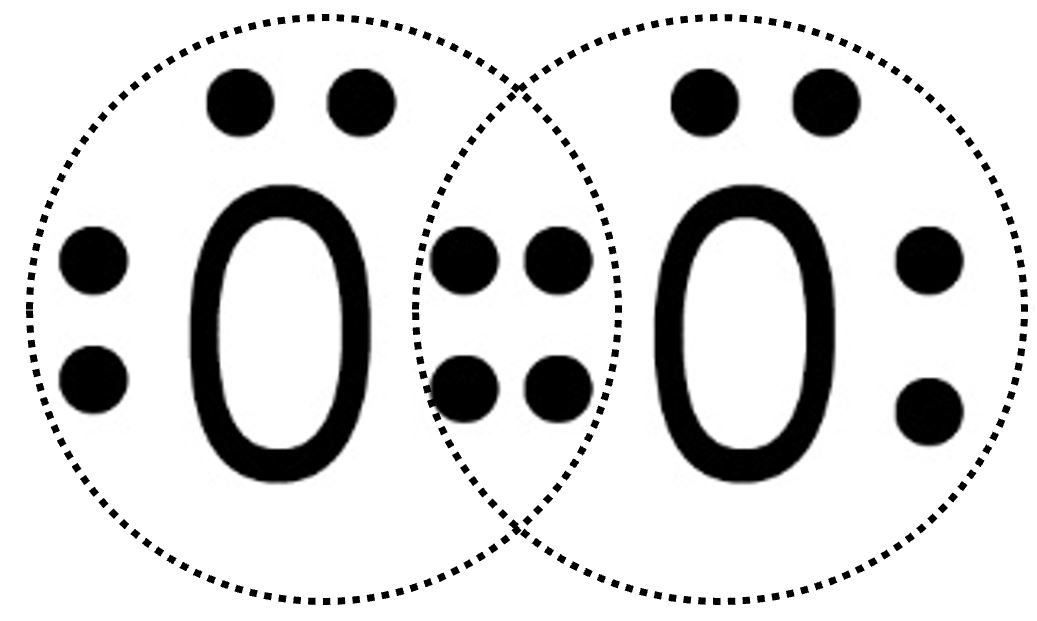 |
Abbiamo in questo caso DUE doppietti condivisi che sono indicativi della presenza di un doppio legame covalente.
Esiste anche la possibilità di mettere in compartecipazione tre elettroni per ciascun atomo come nell’esempio dell’azoto molecolare N2.
| Due atomi di azoto N interagiscono mettendo in compartecipazione tre elettroni ciascuno. | 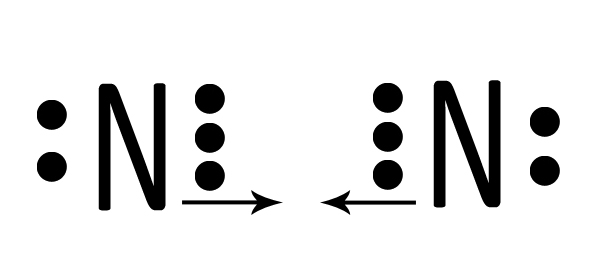 |
| I sei elettroni ora si trovano in tre nuovi orbitali che appartengono ad entrambi. |  |
| Ciascun atomo di azoto ora possiede otto elettroni ed avrà perciò l’ottetto completo. La situazione è stabile perché ciascuno dei due ha raggiunto il completamento del guscio di valenza. Si tratta di N2, l’azoto gassoso. Con tre doppietti condivisi l’azoto possiede un triplo legame che può essere rappresentato con la formula di struttura N≡N. |
 |
Abbiamo in questo caso TRE doppietti condivisi che sono indicativi della presenza di un triplo legame covalente.
4.3.2 Doppietti condivisi e doppietti liberi
Nelle rappresentazioni di Lewis delle molecole che presentano legami covalenti possiamo considerare gli elettroni a due a due perché per ogni orbitale atomico o molecolare sono sempre presenti due elettroni.
Chiamiamo le coppie di elettroni doppietti liberi e doppietti condivisi. I doppietti liberi rappresentano orbitali occupati da due elettroni appartenenti ad un singolo atomo; i doppietti condivisi rappresentano gli orbitali molecolari, e quindi i legami covalenti.
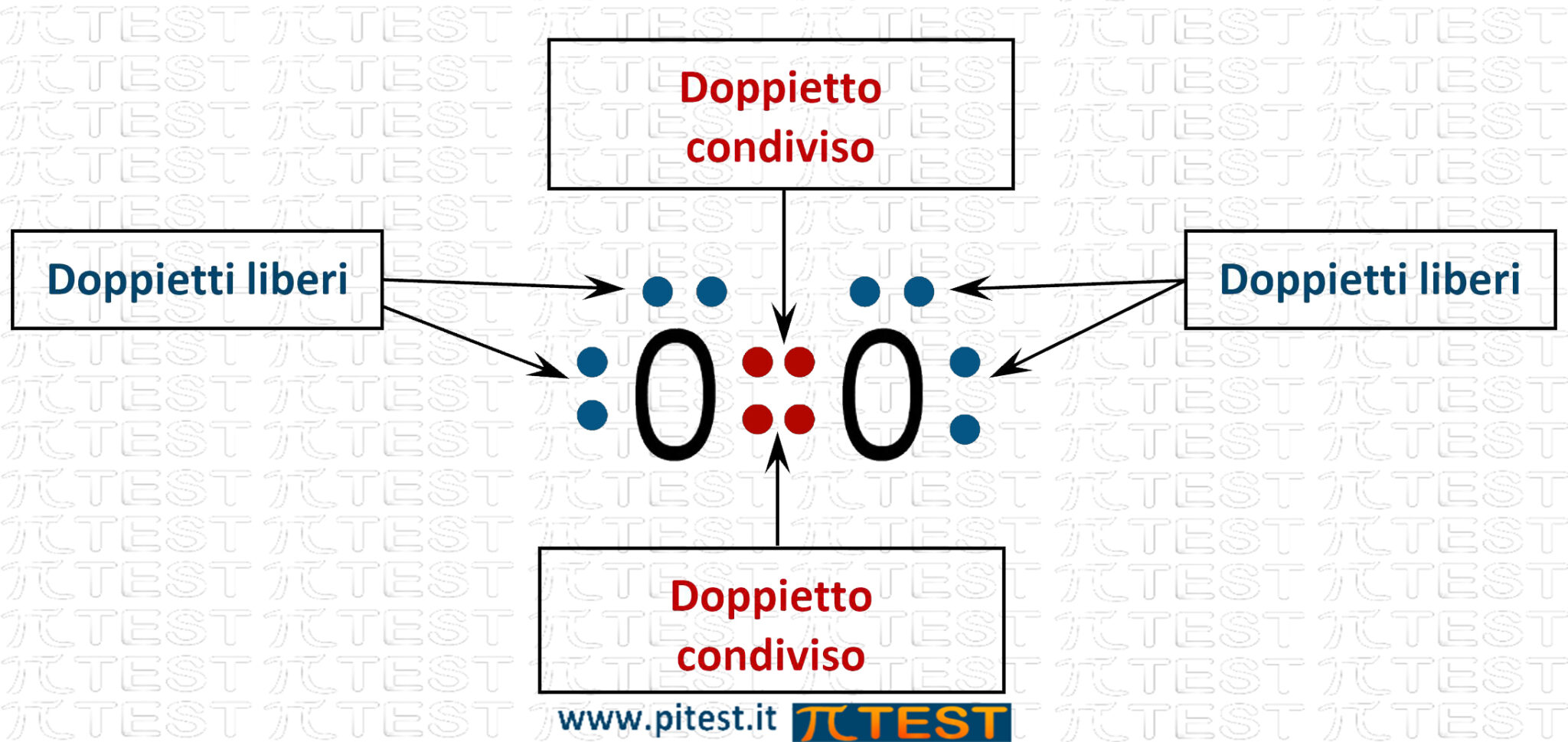
L’ossigeno O2 possiede in tutto due doppietti condivisi e 4 doppietti liberi.
4.3.3 La forma degli orbitali molecolari
I due elettroni dei doppietti condivisi (elettroni di legame) occupano un orbitale molecolare.
Un orbitale molecolare è una regione di spazio nella quale è probabile che si trovino i due elettroni (definizione di orbitale) la cui forma deriva dalla fusione dei due orbitali atomici nei quali si trova ciascuno dei due elettroni del doppietto condiviso.
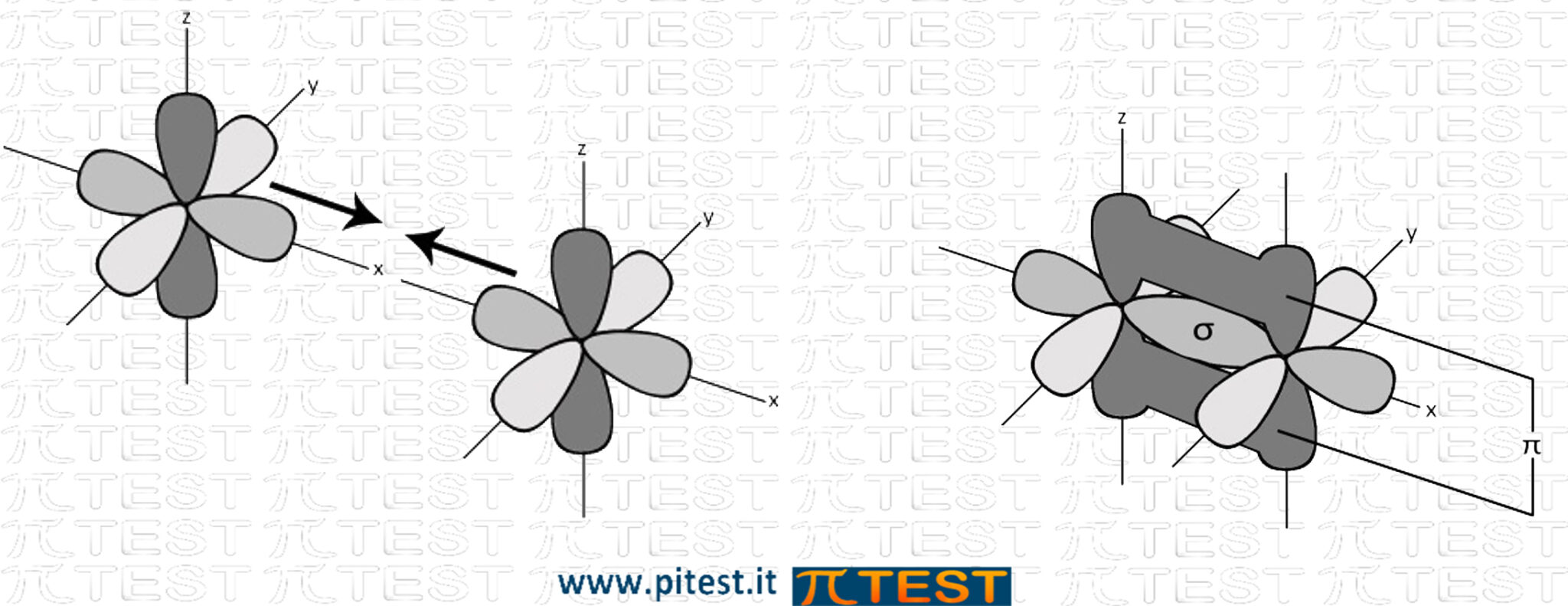
Orbitali σ
Il primo legame molecolare che si forma è sempre un legame che deriva dall’unione testa-testa tra due orbitali atomici. Può derivare dalla fusione di sue orbitali s, da un s ed uno p oppure da due p. Viene chiamato orbitale σ (sigma).
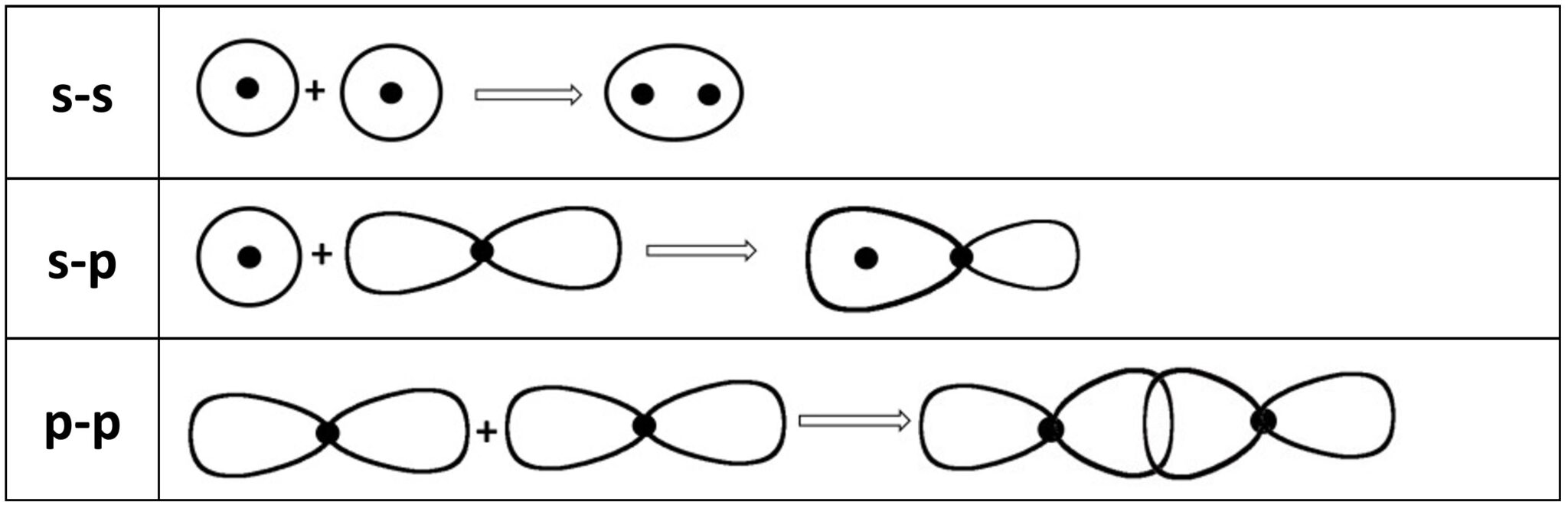 Un orbitale σ si ottiene anche dalla fusione di orbitali ibridi sp3, sp2 e sp (che studieremo nei prossimi paragrafi di questo capitolo) tra di loro o con orbitali s e p.
Un orbitale σ si ottiene anche dalla fusione di orbitali ibridi sp3, sp2 e sp (che studieremo nei prossimi paragrafi di questo capitolo) tra di loro o con orbitali s e p.
Orbitali π (pi greco)
Dopo aver formato un primo orbitale molecolare σ, se i due atomi possiedono entrambi un altro elettrone spaiato in orbitali di tipo p, si può formare un secondo legame dalla fusione dei due orbitali p. Viene chiamato orbitale π (pi-greco).
Gli orbitali p hanno una forma bilobata e sono collocati nello spazio in modo da avere due distinte zone uguali e opposte nelle quali può trovarsi l’elettrone (simile al segno di infinito). Nel fondersi si conservano le due parti e l’orbitale andrà ad occupare due zone di spazio contrapposte.
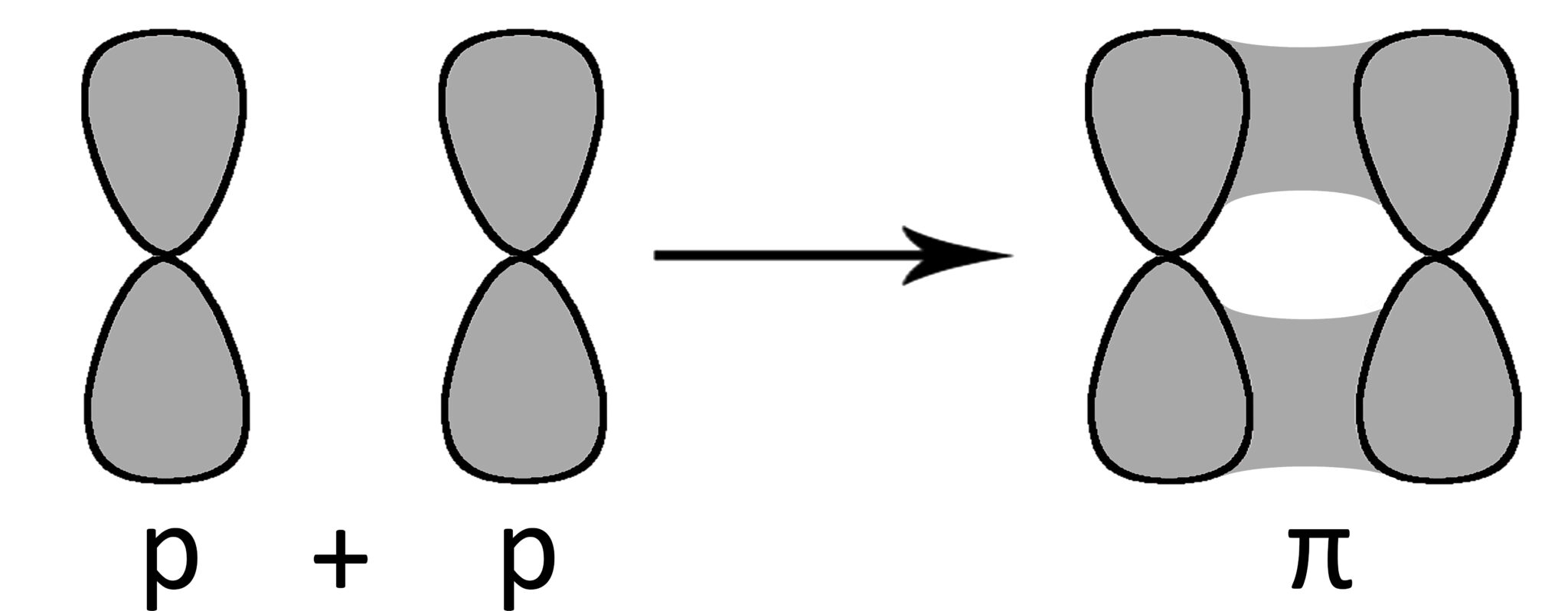
4.3.4 Legami singoli, doppi e tripli
Quando due atomi formano un solo legame, sarà sempre un formato da un orbitale σ.
Se invece formeranno un doppio legame , sarà formato da un orbitale ed un π.
Possiamo avere anche un triplo legame formato da un orbitale σ e due π.
Al crescere del numero di legami si parla anche di “ordine di legame”.
| Ordine di legame | Legame singolo |
| Orbitali coinvolti | un orbitale σ |
Esempio: HF (acido fluoridrico)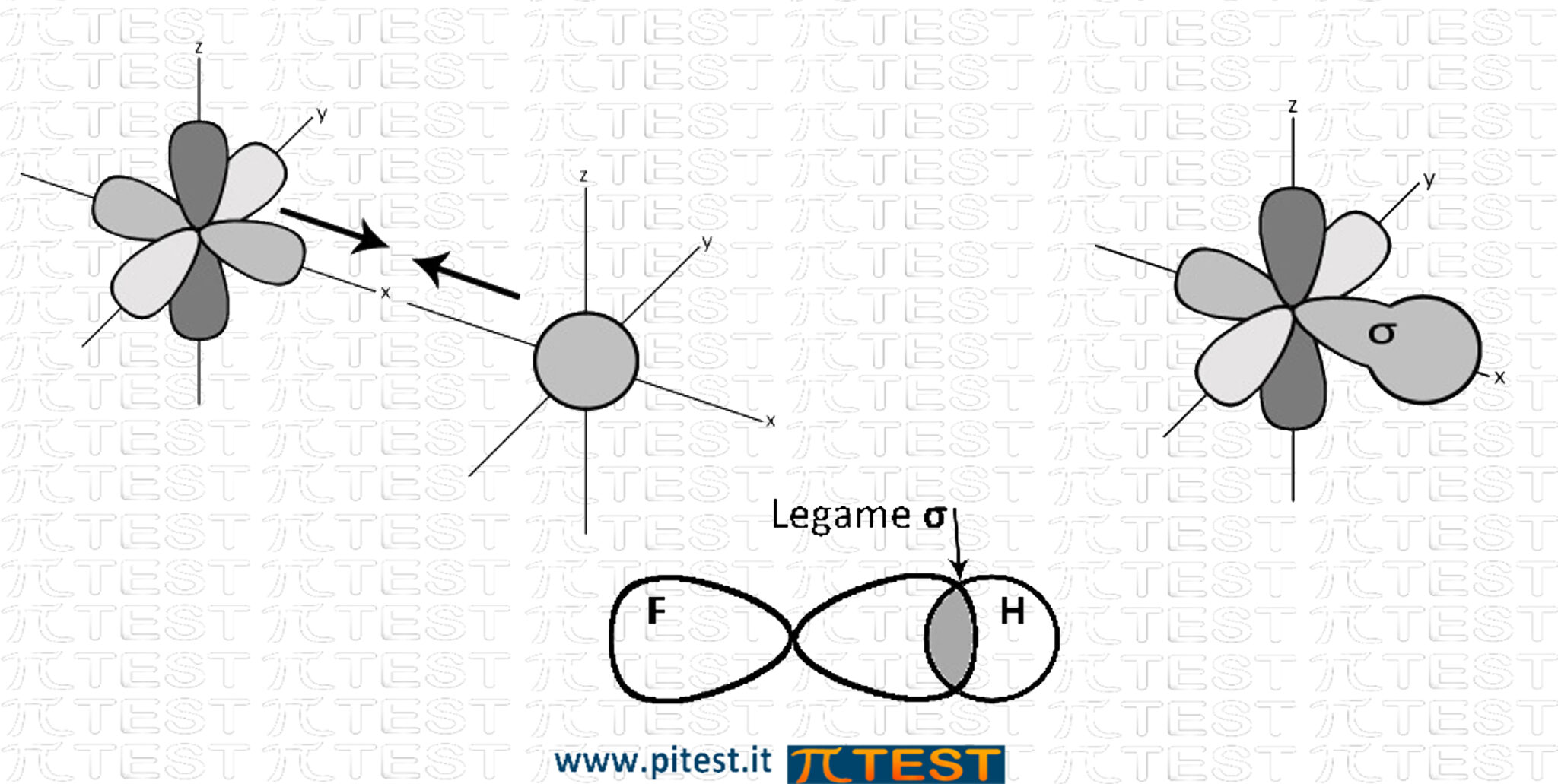 |
|
| Ordine di legame | Legame doppio |
| Orbitali coinvolti | un orbitale σ e un π |
| Esempio: O2 O=O (Ossigeno gassoso)
|
|
| Ordine di legame | Legame triplo |
| Orbitali coinvolti | un orbitale σ e due π |
Esempio: N2 N≡N (Azoto gassoso)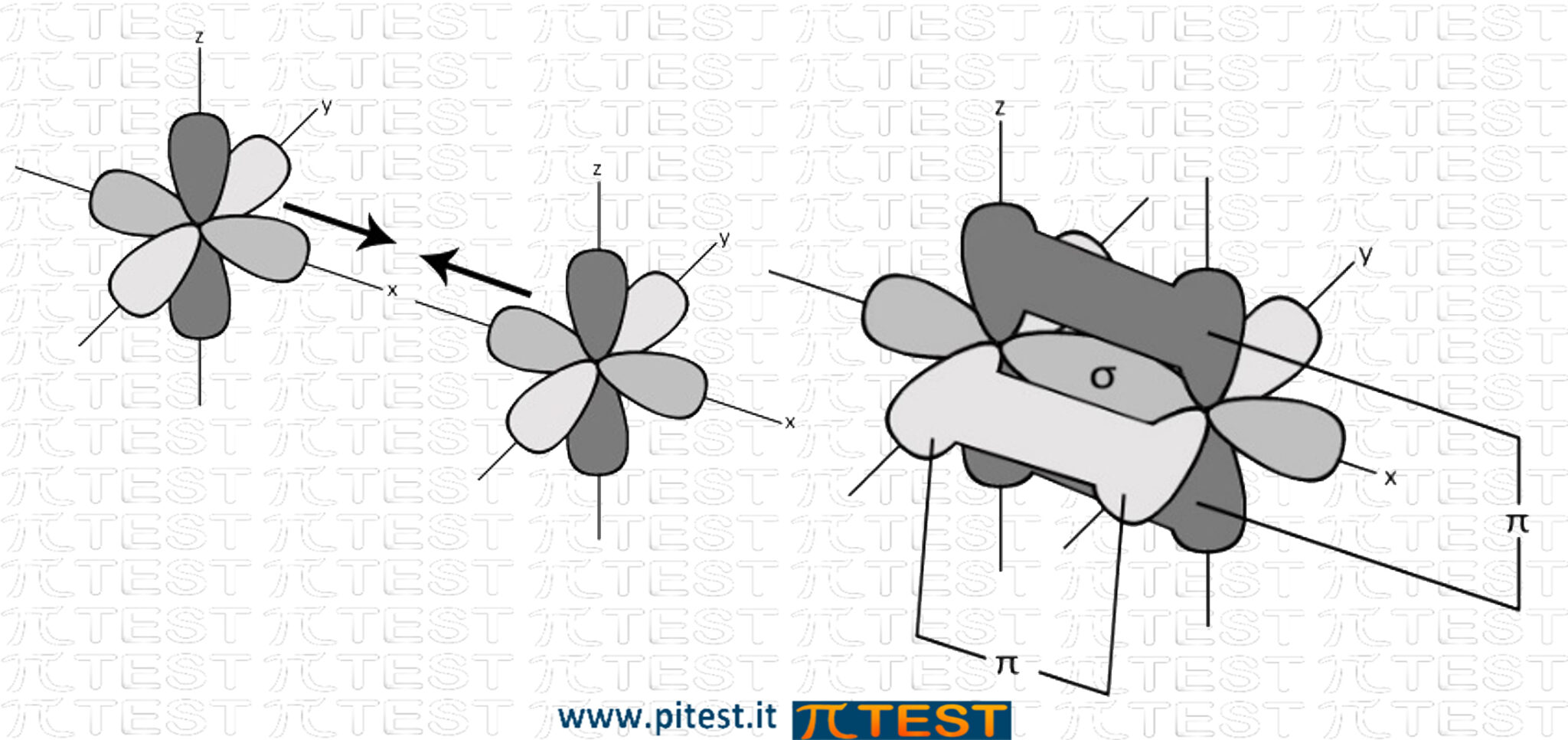 |
|
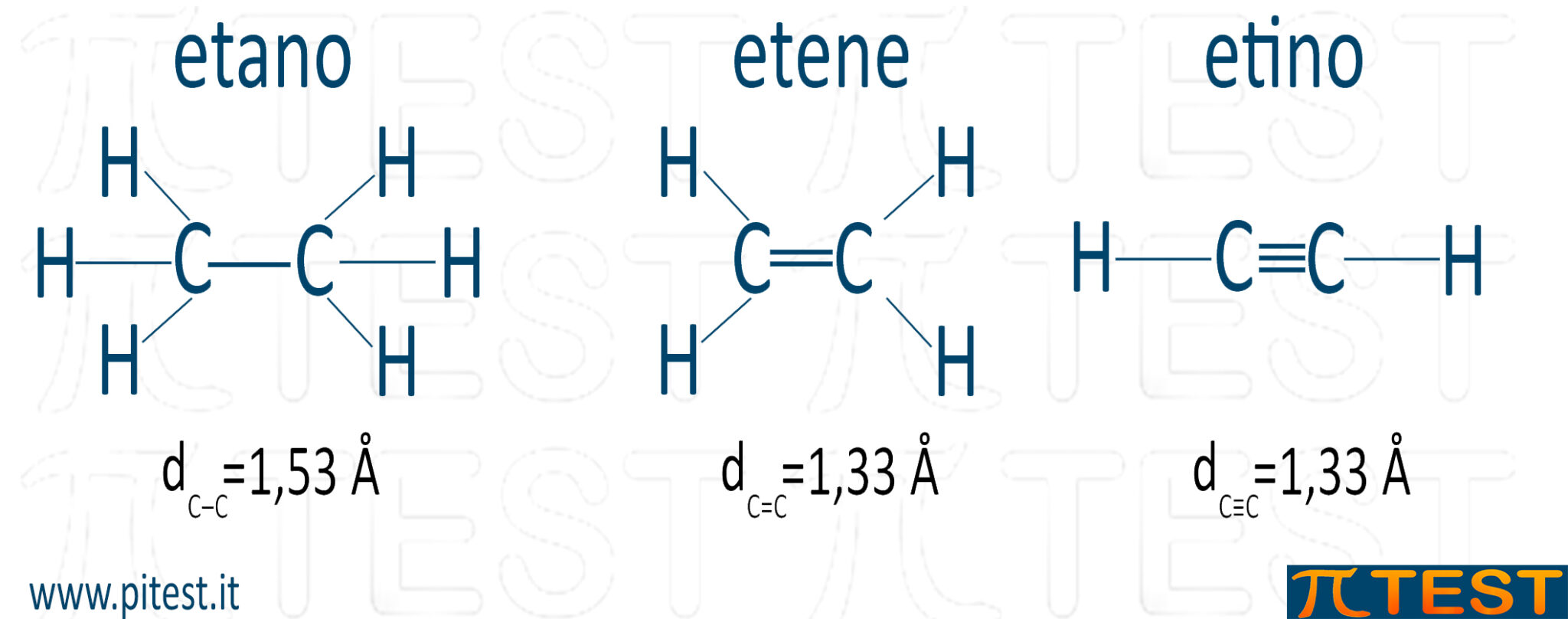
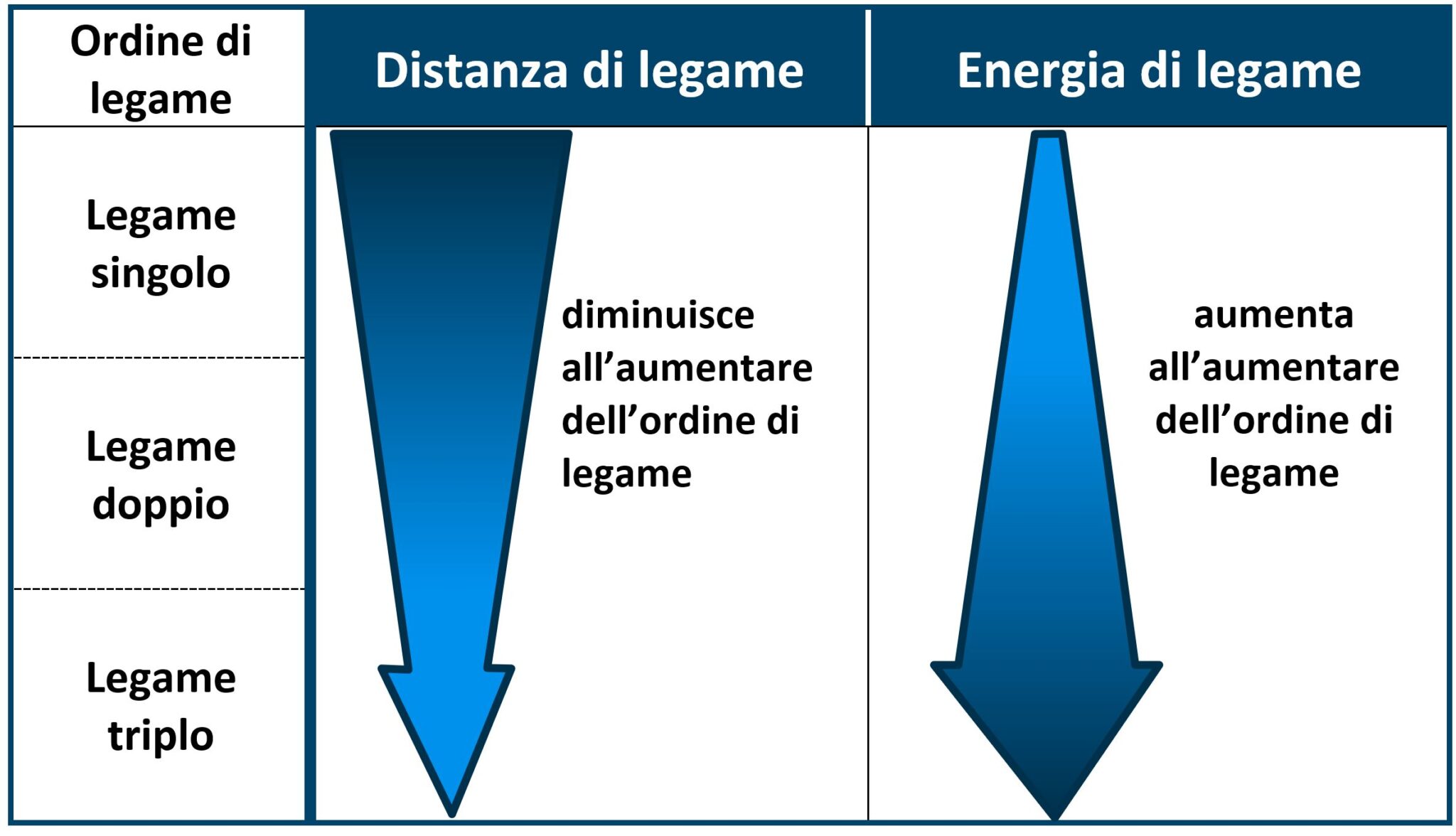
4.3.5 Distanza di legame
Due atomi coinvolti in un legame possiedono una certa distanza tra di loro che si misura in ångström (1Å=10-10m = 0,1nm = 100 pm).
Legami doppi e tripli tra la stessa coppia di atomi sono più corti dei legami singoli.
4.3.6 Energia di legame
È l’energia necessaria per rompere il legame stesso. Due atomi tenuti legati da un legame triplo risultano ben connessi uno all’altro e l’energia per rompere questo legame è superiore a quella necessaria per rompere un legame doppio che comunque è maggiore dell’energia necessaria per rompere un legame singolo. Possiamo dire che l’energia di legame aumenta all’aumentare dell’ordine di legame.
 4.3.7 Legame covalente dativo o di coordinazione
4.3.7 Legame covalente dativo o di coordinazione
In particolari condizioni può formarsi un legame covalente con un orbitale molecolare nel quale i due elettroni vengono dati da uno solo dei due atomi in gioco.
| Un tipico esempio lo abbiamo con l’ammoniaca NH3 che nella rappresentazione di Lewis mostra un doppietto libero sull’atomo di azoto. Questo doppietto può formare un legame covalente con uno ione idrogeno H+. Si forma così lo ione ammonio NH4+. | 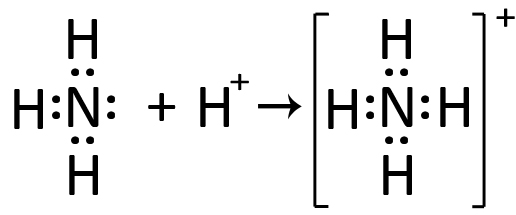 |
| L’acqua H2O presenta due doppietti liberi. Uno di questi, similmente al caso precedente può legarsi ad uno ione idrogeno H+. Si forma così lo ione idronio H3O+ (detto “ossonio” nella nomenclatura IUPAC). | 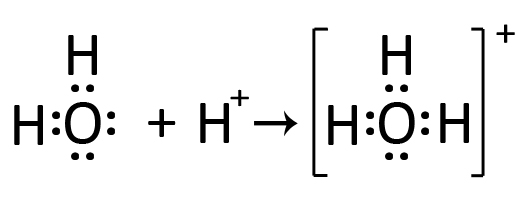 |
| Nell’acido nitrico HNO3 troviamo un ossigeno legato all’azoto con legame dativo. Partiamo dall’acido nitroso HNO2 che rappresentiamo ponendo i “puntini” di Lewis solo sul doppietto libero dell’azoto. Possiamo vedere come nell’acido nitrico il terzo ossigeno si lega all’azoto con legame dativo.
|
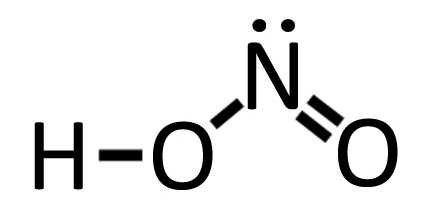 Acido nitroso HNO2 Acido nitroso HNO2 |
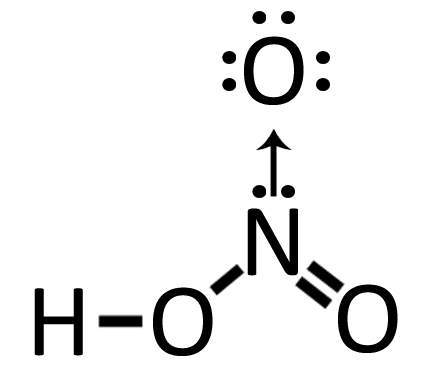
Acido nitrico HNO3 |
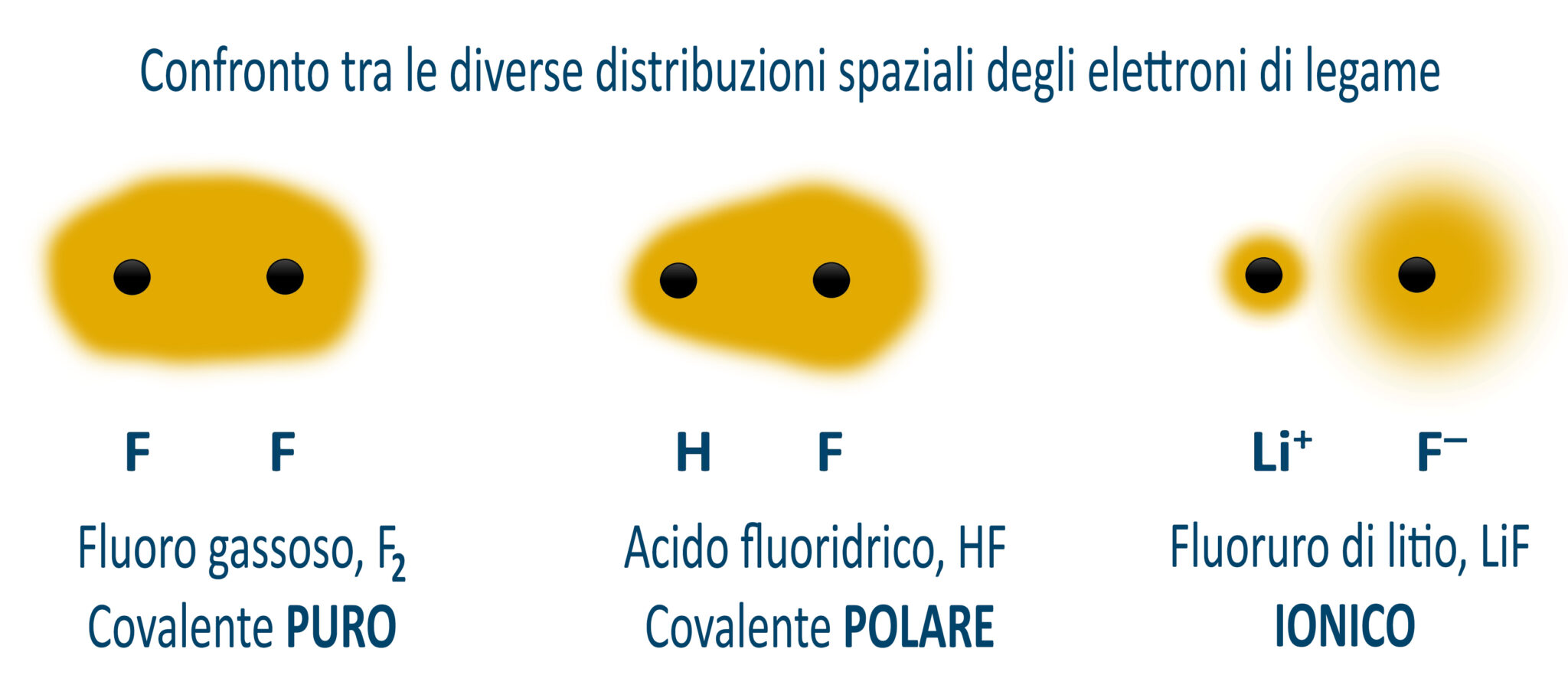
4.3.8 Legame covalente puro e polare
Gli elettroni dei gusci esterni di due atomi coinvolti in un legame covalente sono distribuiti in uno spazio che avvolge i due atomi. Quando i due atomi sono identici come ad esempio in O2, N2, H2, allora diciamo che il legame covalente è puro o omopolare. Quando invece i due atomi sono diversi ed hanno quindi una differente elettronegatività, allora il guscio elettronico è spostato verso l’atomo più elettronegativo ed avremo un legame covalente polare. Nel legame polare abbiamo la presenza di due poli, uno negativo in corrispondenza dell’atomo più elettronegativo, e l’altro positivo. Nasce così un “dipolo elettrico” che nelle rappresentazioni è indicato da una freccia che va dall’atomo positivo verso quello negativo. Il dipolo elettrico si comporta come una grandezza vettoriale.
Spesso di usa la lettera delta minuscola δ per indicare i due poli: δ+ e δ–.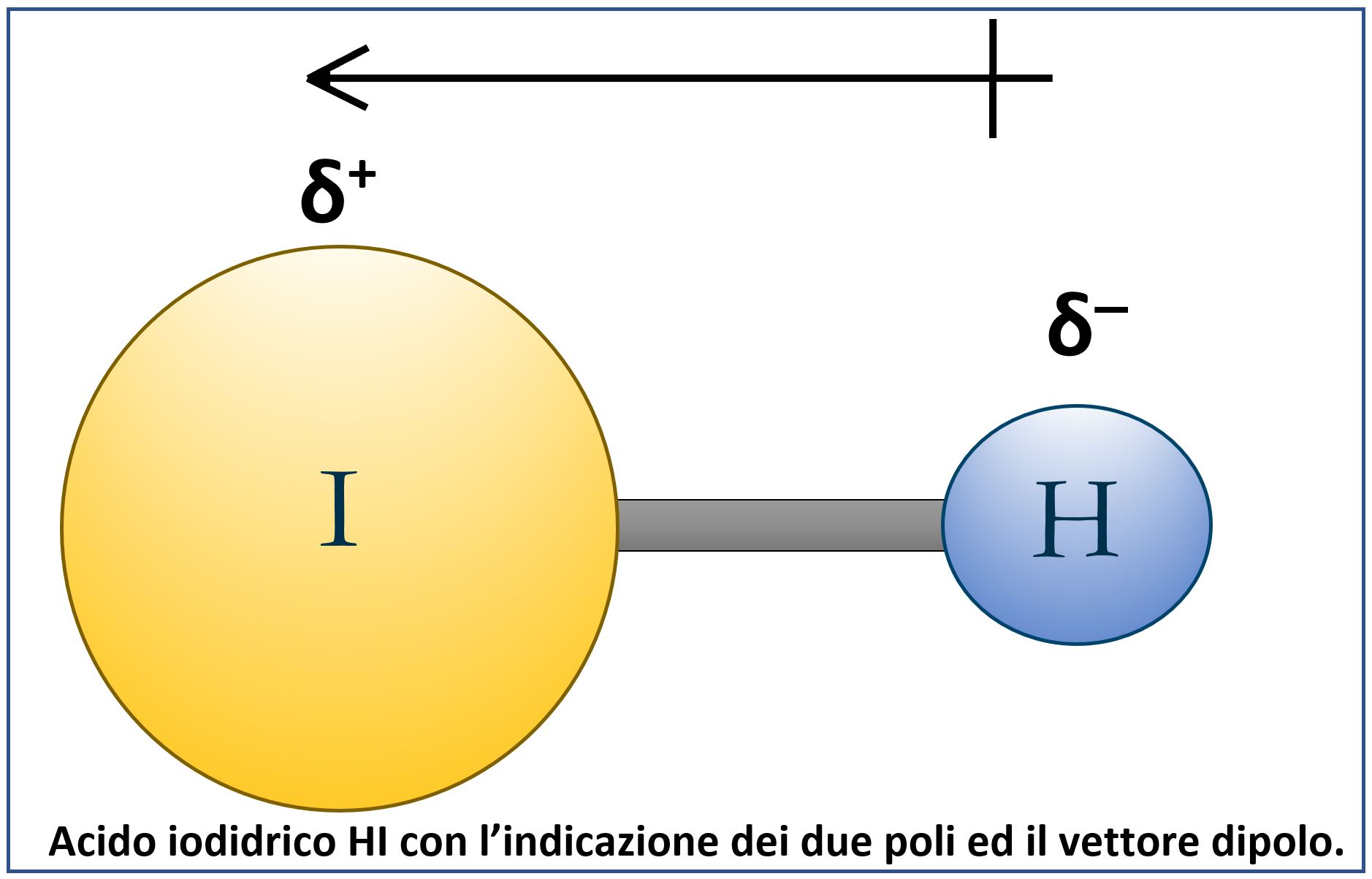 A volte si parla anche di momento di dipolo di legame che è dato dal prodotto della carica per la distanza di legame.
A volte si parla anche di momento di dipolo di legame che è dato dal prodotto della carica per la distanza di legame.
QUIZ sul Legame covalente |
|||
|---|---|---|---|
© il testo è di esclusiva proprietà dell’autore ed è sottoposto a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito