3.1 Gli orbitali
Un atomo possiede un numero di elettroni pari al numero di protoni presenti nel nucleo. Gli elettroni si trovano nello spazio esterno al nucleo in zone chiamate orbitali.
Per capire cosa sia un orbitale valutiamo la differenza tra il concetto di orbita e quello di orbitale.
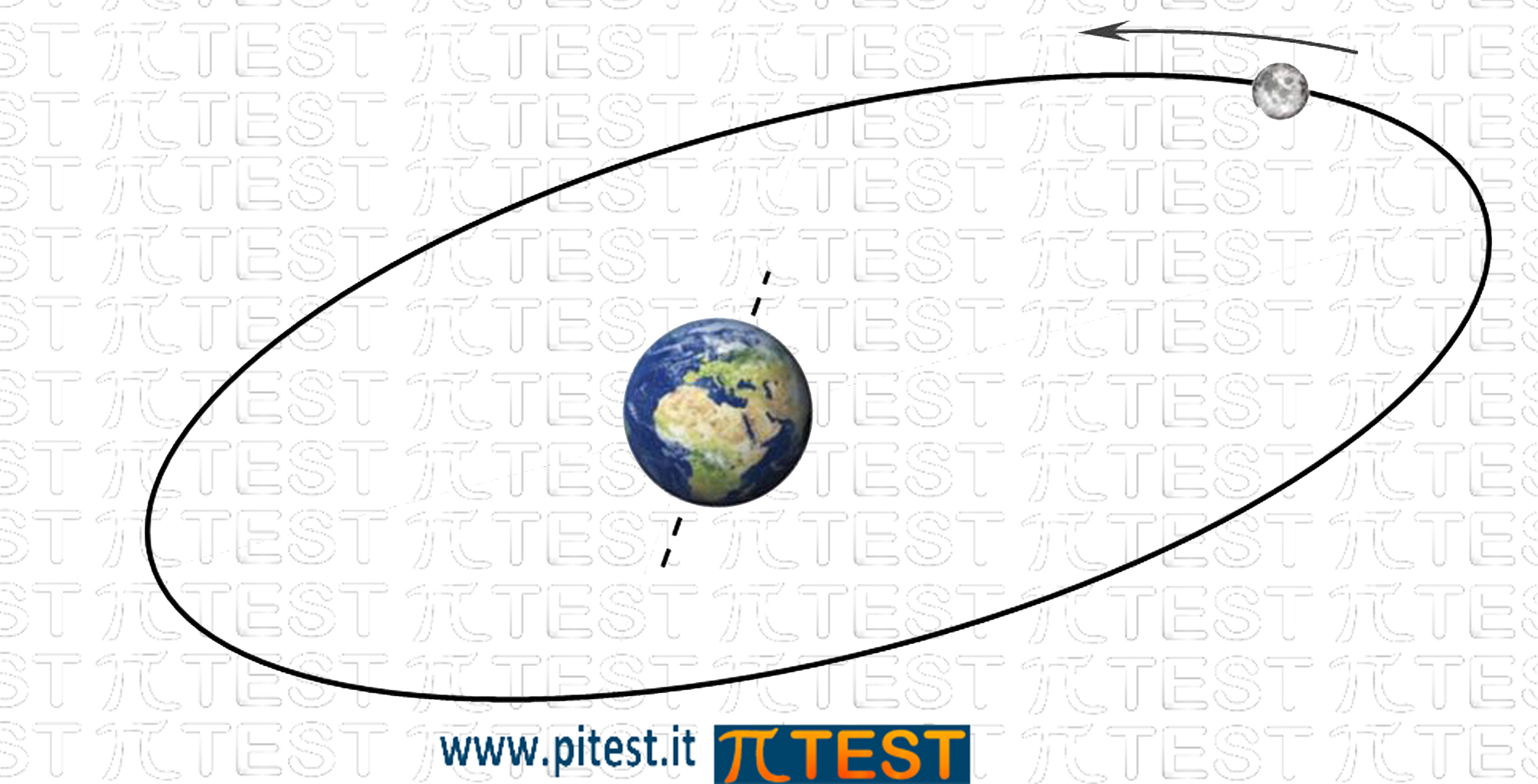
Un’orbita rappresenta la traiettoria ben precisa che percorre un corpo nel suo moto di rotazione attorno ad un altro, come accade per i corpi celesti (luna attorno alla terra, terra attorno al sole).
Un orbitale invece è costituito da una regione di spazio nella quale è probabile che si trovi l’elettrone. Si tratta perciò di una definizione probabilistica.
|
Orbita di un satellite attorno alla terra. Percorso preciso e prevedibile |
 |
|
Orbitale La diversa intensità di colorazione indica la maggiore o minore probabilità di presenza dell’elettrone |
 |
Associato alla definizione probabilistica dell’orbitale abbiamo il Principio di indeterminazine di Heisemberg che afferma che «non è possibile determinare contemporaneamente la posizione e la quantità di moto di un elettrone». In altre parole se riusciamo a stabilire la posizione di un elettrone allora non potremo misurarne la velocità e viceversa. Questo principio ha la seguente formulazione:
| Δx rappresenta l’incertezza nella misura della posizione e Δp l’incertezza nella determinazione della quantità di moto; h è la “costante di Plank ridotta”. |
In base al principio di esclusione di Pauli in ciascun orbitale possono trovarsi al massimo due elettroni che ruotano su se stessi con senso di rotazione opposto; diciamo che hanno spin opposto.
3.1.1 Livelli
Intorno al nucleo sono presenti numerosi orbitali che vanno ad occupare tutte lo spazio possibile. Gli orbitali hanno diverse possibili forme e si collocano in livelli crescenti detti anche gusci (in inglese shell). I gusci sono numerati anche con le lettere K, L, M, N, O, P, Q.
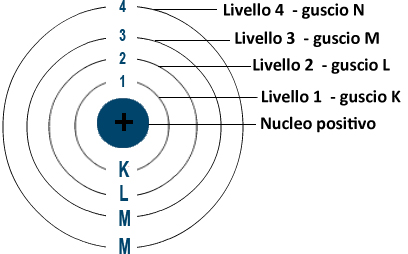
Gli elettroni si posizionano in livelli via via crescenti.
- Il primo livello (guscio o shell) detto anche K è piccolo e contiene solo 2 elettroni in un orbitale
- Il secondo livello detto anche L è più grande e ha posto per 8 elettroni in 4 orbitali
- Il terzo livello detto anche M ha posto per 18 elettroni in 9 orbitali
- Il quarto livello detto anche N ha posto per 30 elettroni in 15 orbitali
3.1.2 Forma
Gli orbitali hanno quattro diversi tipi di forma:
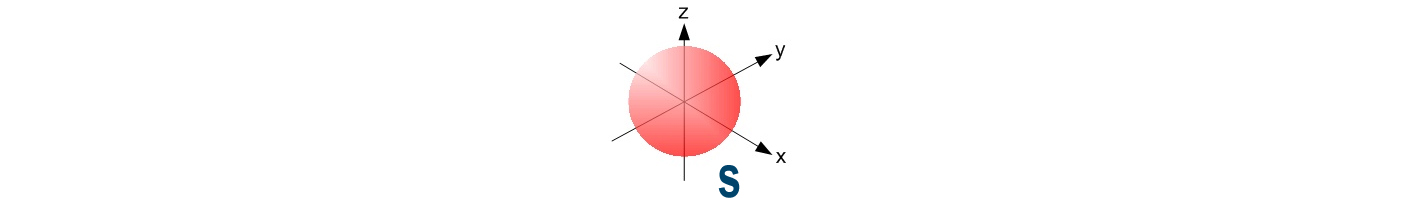
| s | Gli orbitali “s” sono sfere |
 |
|
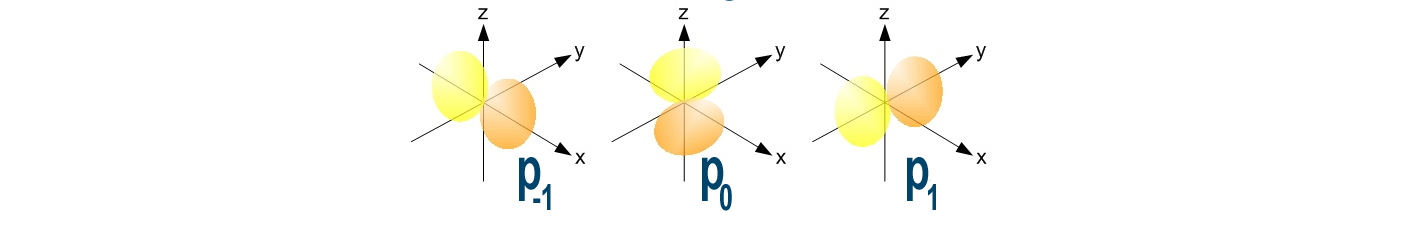
| p | Gli orbitali “p” sono anche detti bilobati. Ne esistono tre diversi che sono disposti nello spazio secondo gli assi x, y, e z in modo da avere ciascuno due distinte zone contrapposte (simile al segno di infinito) |
 |
|
| d | Gli orbitali “d”. Ne esistono cinque diversi ed hanno forme particolari |
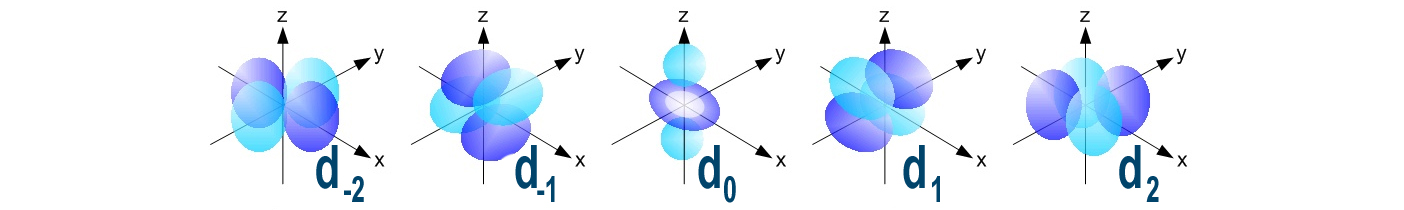 |
|
| f | Gli orbitali “f”. Ne esistono sette diversi ed hanno forme particolari |
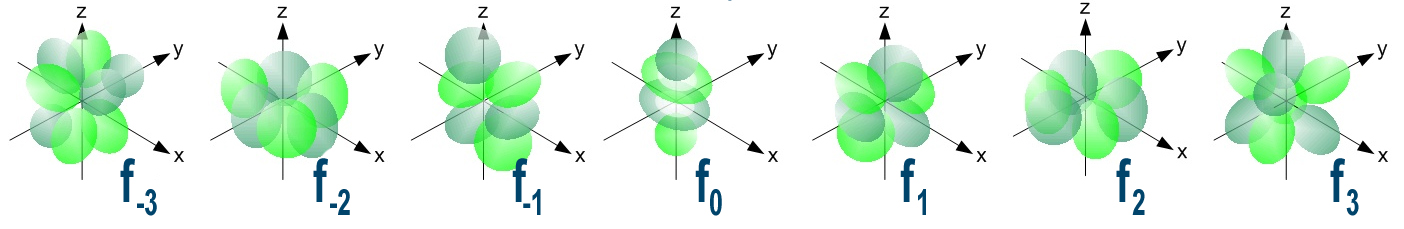 |
Nel primo livello, il più vicino al nucleo ed anche il più piccolo, si trova solo un orbitale di tipo s che chiamiamo 1s.
Nel secondo livello, più grande rispetto al precedente, c’è spazio per un orbitale sferico s e tre orbitali bilobati p. Chiamiamo questi orbitali rispettivamente 2s e 2p.
Nel terzo livello, più grande rispetto ai due precedenti, c’è spazio per un orbitale sferico s e tre orbitali bilobati p e cinque orbitali d. Chiamiamo questi orbitali rispettivamente 3s, 3p e 3d.
Nel quarto livello, più grande rispetto ai tre precedenti, c’è spazio per un orbitale sferico s e tre orbitali bilobati p, cinque orbitali d e sette orbitali f. Chiamiamo questi orbitali rispettivamente 4s, 4p, 4d e 4f.
Orbitali degeneri
Quando confrontiamo due orbitali, se questi appartengono allo stesso sottogruppo, come ad esempio due orbitali p del sottogruppo 2p, sono detti “orbitali degeneri”.
3.1.3 Energia
Ai diversi orbitali è associato un livello di energia che va crescendo al crescere del livello ed anche al variare del tipo di orbitale secondo lo schema in figura.
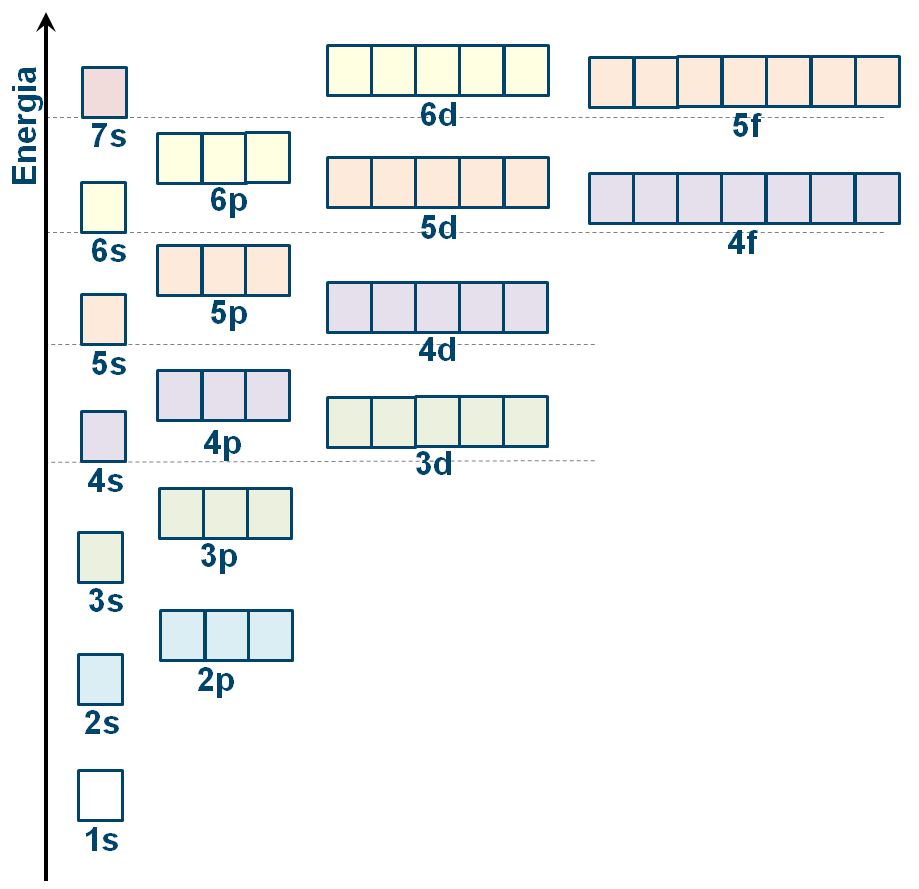
| QUIZ 3.1 Gli orbitali | |||
| QUIZ 1 | QUIZ 2 | QUIZ 3 | QUIZ 4 |
| QUIZ 5 | QUIZ 6 | ||
© il testo è di esclusiva proprietà dell’autore ed è sottoposto a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito
3.2 Ordine di riempimento degli orbitali e configurazione elettronica


