10.3 Gli ISOMERI
Nello studio degli idrocarburi abbiamo già incontrato molecole con lo stesso numero di atomi ma con disposizione diversa; queste sono dette isomeri. A seconda del modo in cui si presentano gli isomeri sono classificati secondo il seguente schema:
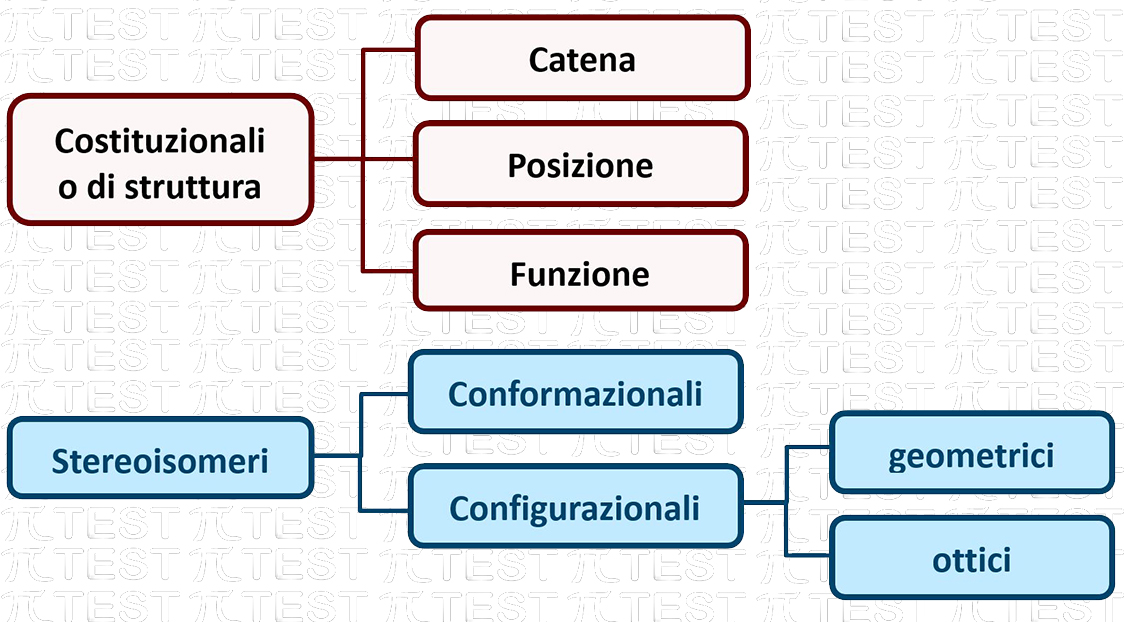
10.3.1 Isomeri COSTITUZIONALI DI CATENA
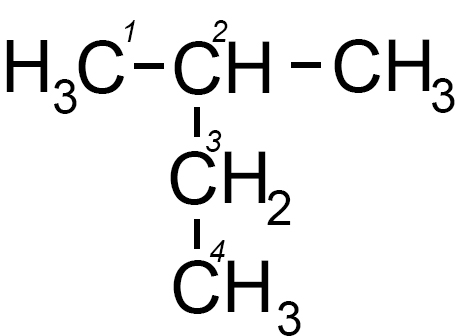
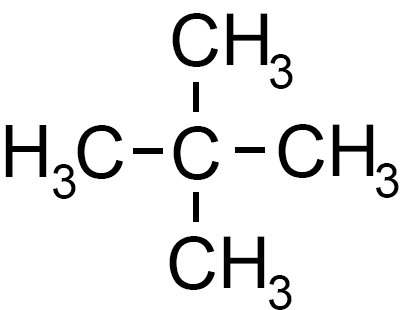
Abbiamo visto questo tipo di isomeri parlando degli isomeri del butano e del pentano (vedi).
Per esempio il pentano possiede tre isomeri di catena: il n-pentano, l’isopentano e il neopentano.
 |
 |
10.3.2 Isomeri COSTITUZIONALI DI POSIZIONE
Abbiamo visto questo tipo di isomeri parlando del butene (vedi) .
Per esempio il butene può avere il doppio legame tra il primo e il secondo atomo di carbonio (1-butene) oppure tra il secondo e il terzo atomo di carbonio (2-butene).
|
|
|
Nella definizione degli isomeri dobbiamo fare attenzione a non considerare due volte la stessa molecola. Infatti per il butene potremmo considerare anche l’isomero che presenta il doppio legame tra il terzo e il quarto atomo di carbonio (chiamandolo 3-butene), ma questo coincide con l’1-butene in quanto basta iniziare la numerazione degli atomi di carbonio in modo inverso per vedere che si tratta della stessa molecola.
|
|
|
|
10.3.3 Isomeri COSTITUZIONALI DI FUNZIONE
Quando, oltre al carbonio e all’idrogeno, è presente un atomo di un altro elemento (ad esempio ossigeno, azoto, zolfo), si formano composti con caratteristiche diverse; li vedremo nei prossimi paragrafi. Ad esempio la presenza dell’ossigeno può portare alla formazione di alcoli, eteri, aldeidi, chetoni e acidi carbossilici; composti chimici aventi caratteristiche molto diverse.
Ad esempio immaginiamo di aggiungere un atomo di ossigeno all’etano C2H6. L’ossigeno può comparire in un ossidrile −OH che andrà a formare un alcol (−OH è anche detto gruppo alcolico); l’atomo di ossigeno può anche inserirsi tra i due atomi di carbonio andando a formare un etere. La formula bruta è la stessa C2H6O ma le due sostanze sono molto diverse.
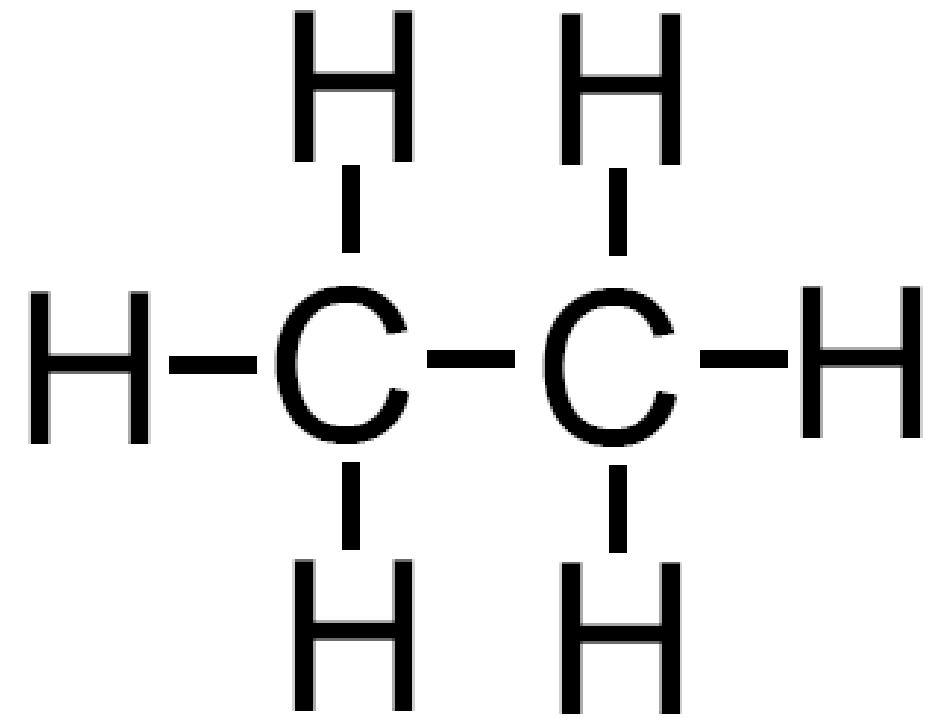
etano |
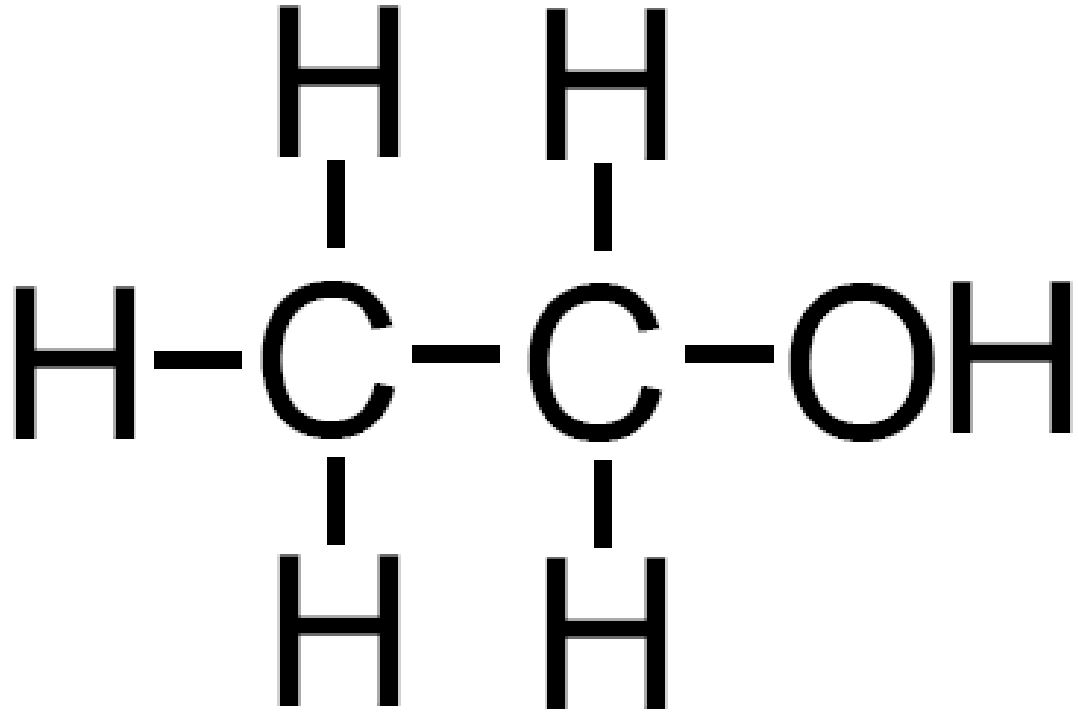
etanolo |
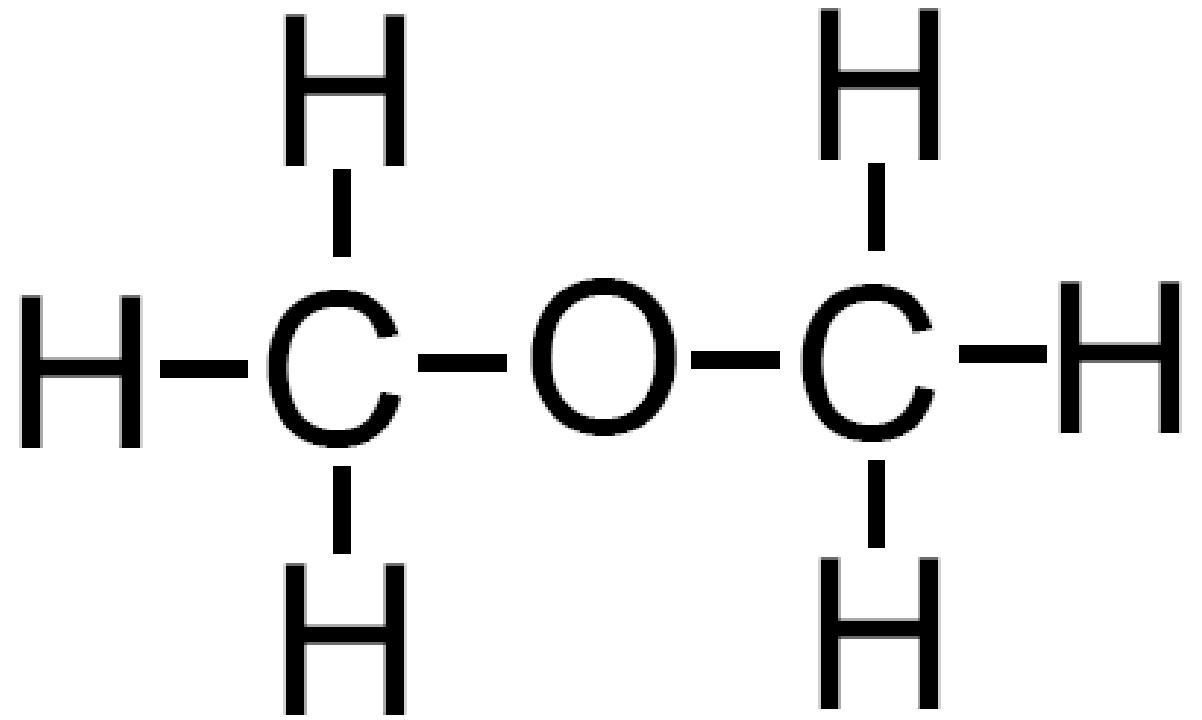 dimetiletere dimetiletereo etere dimetilico |
| C2H6O Stessa formula bruta | ||
10.3.4 Stereoisomeri CONFORMAZIONALI
Con il termine “stereoisomeri” consideriamo composti organici formati dagli stessi atomi legati nello stesso ordine, che differiscono per la loro disposizione spaziale all’interno della molecola.
Gli stereoisomeri conformazionali differiscono solo per la forma spaziale ed hanno la possibilità di interconvertirsi da una forma all’altra, senza rompere i legami, per semplice rotazione attorno ad un legame carbonio-carbonio. Il tipico esempio lo abbiamo visto con le due strutture del cicloesano: a sedia e a barca (vedi).
| Due diverse CONFORMAZIONI del cicloesano C6H12 | |
| Formule di struttura del cicloesano | 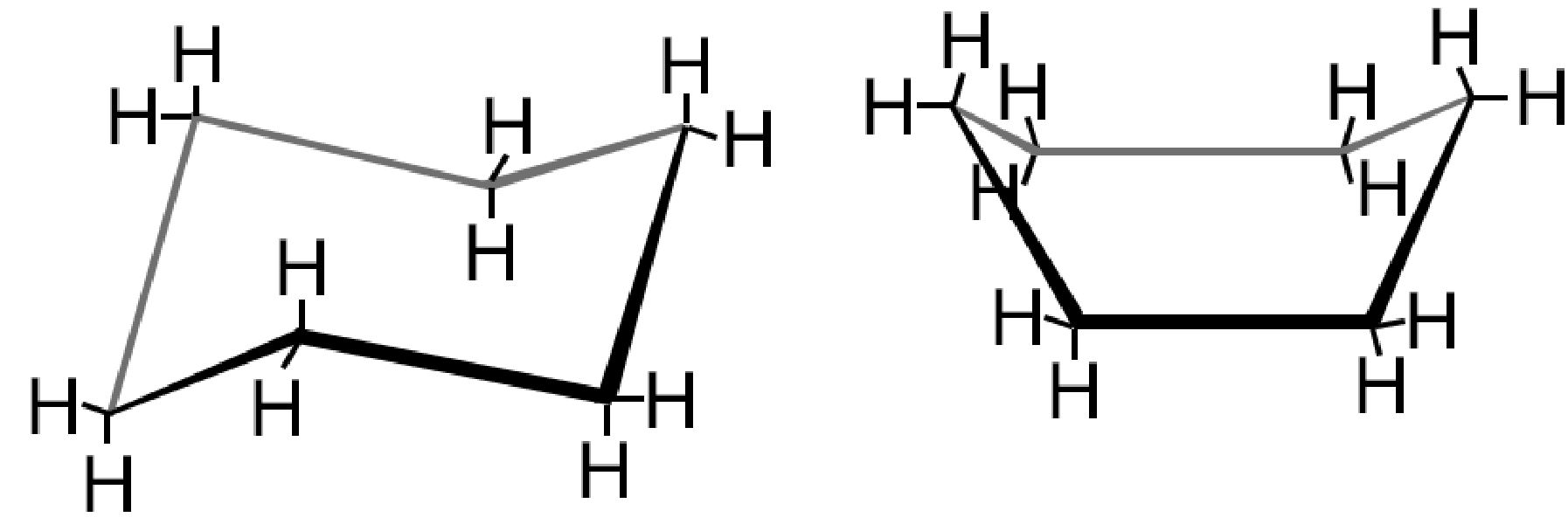 |
| Conformazione tridimensionale a sedia e a barca |
 |
10.3.5 Stereoisomeri CONFIGURAZIONALI GEOMETRICI
Questi differiscono tra di loro per la configurazione spaziale. Il classico esempio lo abbiamo visto per il cis– e trans– 2butene (vedi).
| Cis 2 butene | Trans 2 butene |
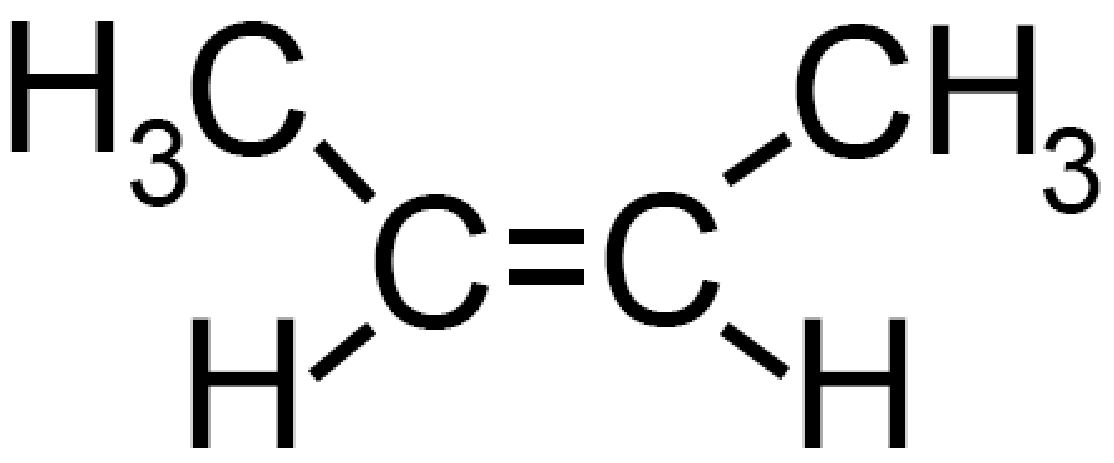 Formula di semistruttura Formula di semistruttura |
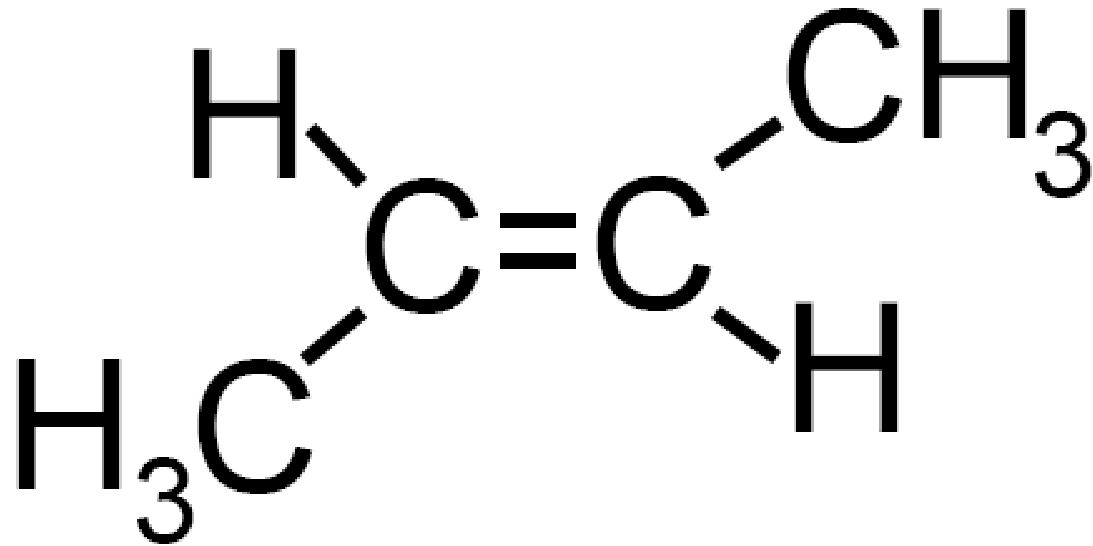 Formula di semistruttura Formula di semistruttura |
Nello studio bisogna prestare attenzione alla differenza tra conformazione e configurazione.
Il termine conformazione riguarda solamente la forma che assume la struttura tridimensionale a parità di tutte le strutture (ovvero di tutte le configurazoni). Riguarda la possibilità di rotazione attorno a legami semplici (legami sigma σ). Vedi qui sopra il precedente paragrafo.
Il termine configurazione riguarda invece il modo in cui sono posizionati i vari gruppi (radicali) lungo la molecola rispetto a posizioni non invertibili come quelle contigue al doppio legame.
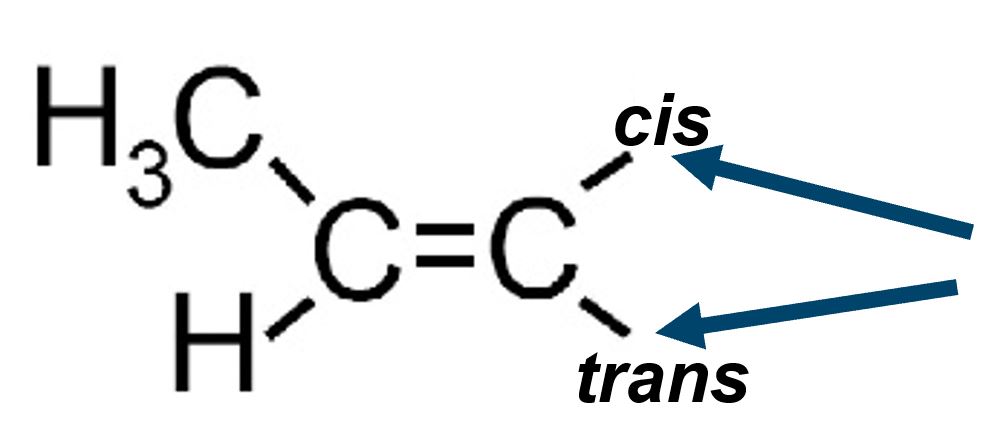 |
La scelta di dove posizionare un radicale (ad esempio un metile ‒CH3) crea una situazione univoca non invertibile a causa della non possibile rotazione attorno al doppio legame. |
10.3.6 Stereoisomeri CONFIGURAZIONALI OTTICI
Il termine “ottici” nasce dal fatto che i due diversi stereoisomeri ottici della stessa molecola presentano proprietà diverse nei confronti della luce polarizzata.
Questo tipo di isomeria si verifica quando in una molecola organica è presente un atomo di carbonio ibridato sp3 legato a quattro gruppi diversi; questo atomo di carbonio ASIMMETRICO è detto “chirale”.
Il tipico esempio si ha negli amminoacidi biologici (vedi) nei quali l’atomo di carbonio C2 è legato a:
- un carbossile −COOH
- un gruppo amminico −NH2
- un atomo di idrogeno
- un radicale generico −R
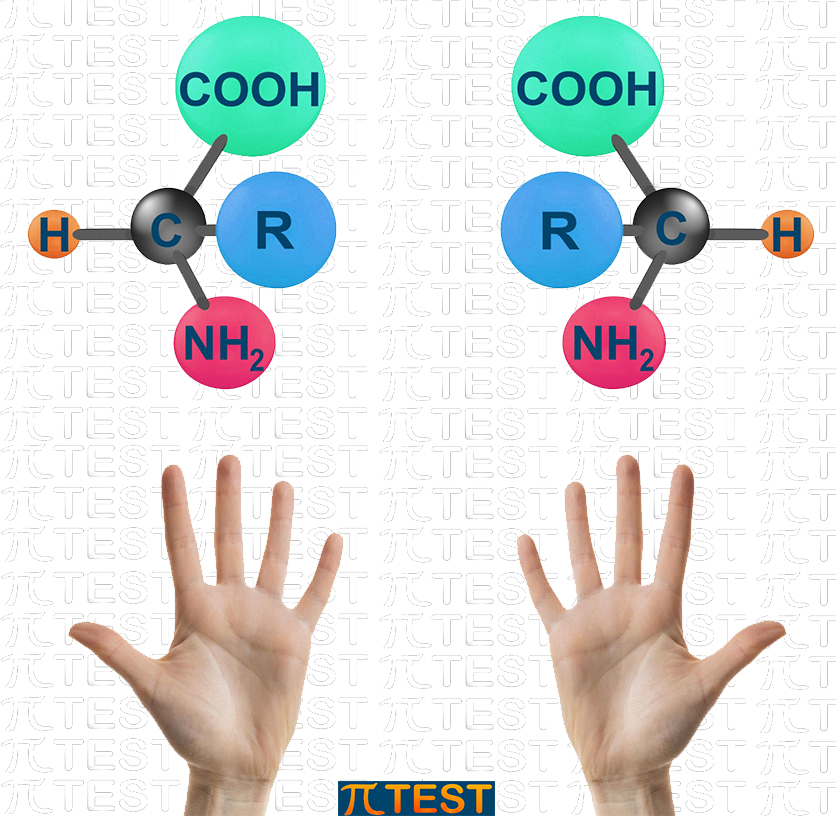 Un carbonio legato in questo modo presenta una struttura che può avere due varianti, una speculare all’altra così come lo sono le nostre mani, identiche in tutto ma non sovrapponibili (se poniamo la mano destra davanti ad uno specchio quella che vediamo è una mano sinistra). Le due possibili configurazioni che abbiamo descritto si chiamano enantiomeri.
Un carbonio legato in questo modo presenta una struttura che può avere due varianti, una speculare all’altra così come lo sono le nostre mani, identiche in tutto ma non sovrapponibili (se poniamo la mano destra davanti ad uno specchio quella che vediamo è una mano sinistra). Le due possibili configurazioni che abbiamo descritto si chiamano enantiomeri.
LUCE POLARIZZATA
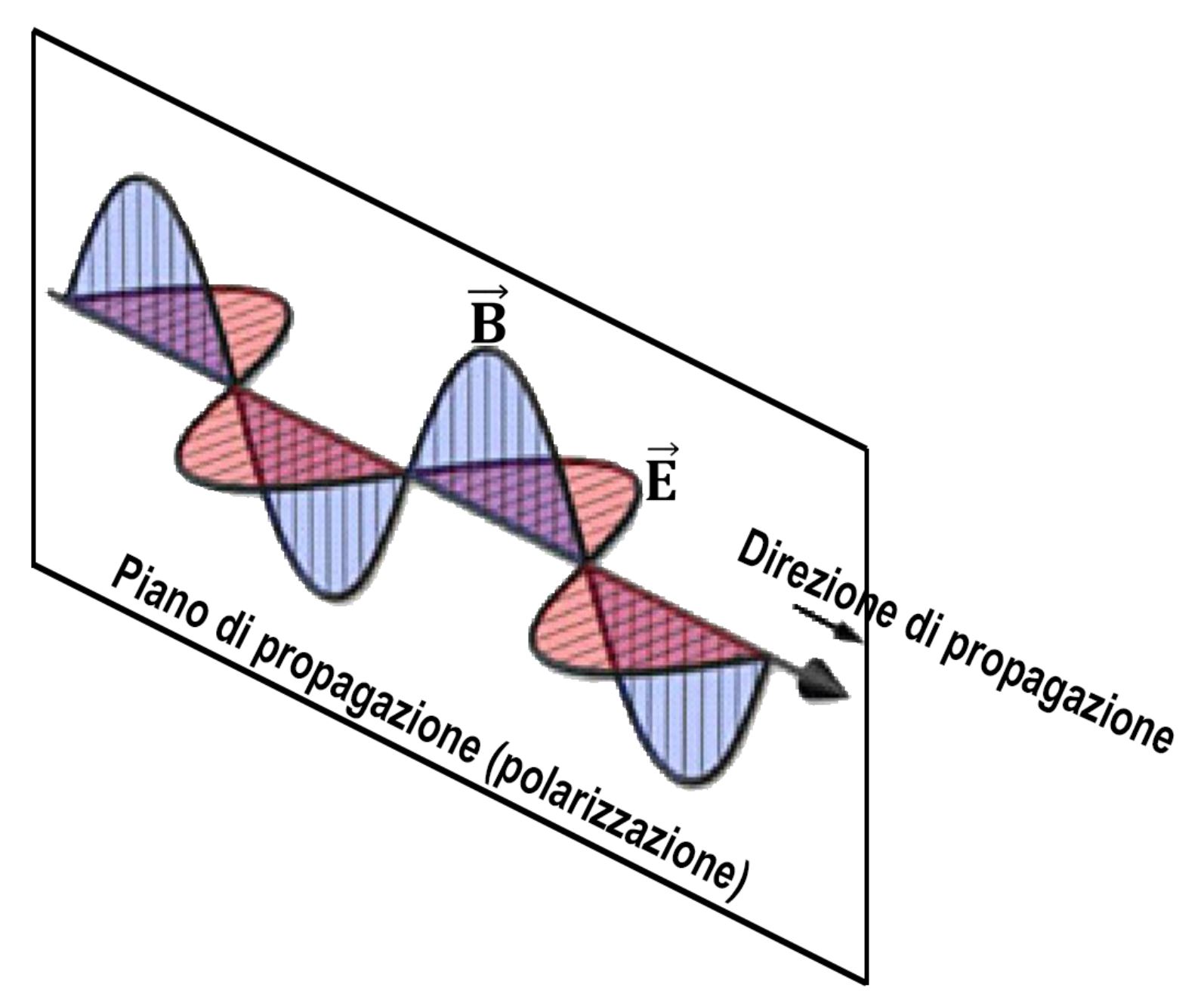
Un fascio luminoso è composto da fotoni emessi da una sorgente in modo non ordinato. Ogni fotone, in quanto radiazione elettromagnetica, possiede un piano di propagazione lungo il quale oscilla un campo elettrico E ed un altro piano ortogonale al primo sul quale oscilla un campo magnetico B
I piani di propagazione dei diversi fotoni sono diversi e non organizzati.
Esistono filtri della luce detti polarizzatori che lasciano passare solo i fotoni che possiedono un certo piano di polarizzazione. La luce che esce da questi filtri è detta luce polarizzata; i fotoni che la costituiscono si muovono tutti sullo stesso piano di polarizzazione. Nella figura seguente è rappresentata una sorgente che emette un fascio di luce no polarizzata con i fotoni che possiedono disordinatamente diversi piani di polarizzazione. Questo fascio attraversa un filtro polarizzatore che lascia passare soltanto quei fotoni che possiedono uno stesso piano di polarizzazione.
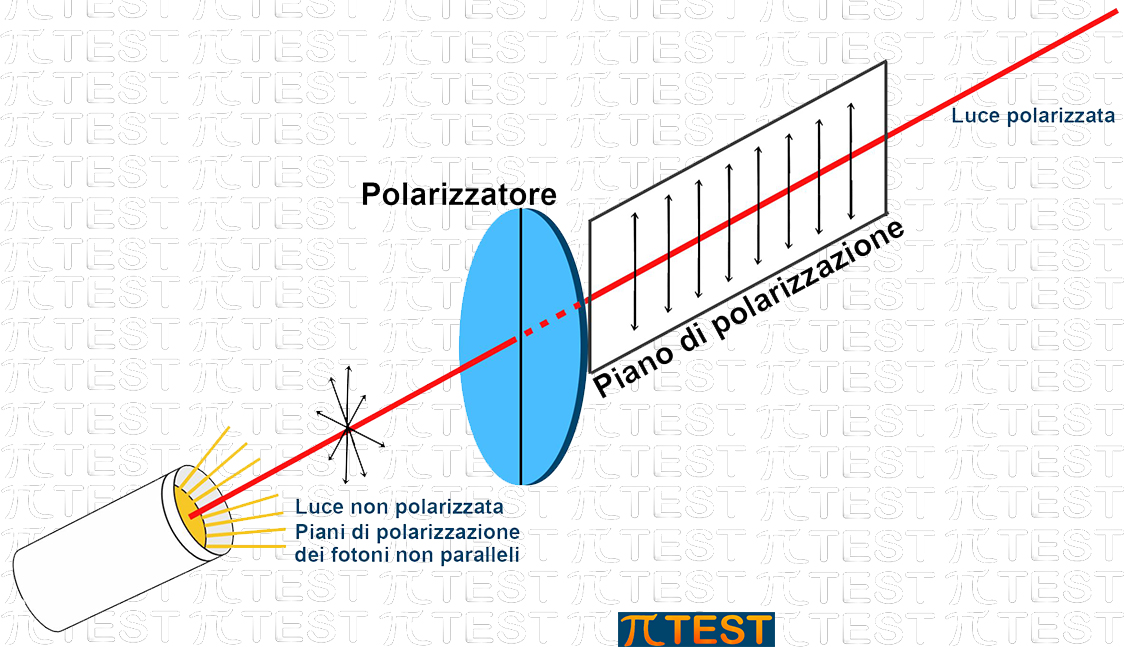
Ritorniamo ai composti cimici contenenti un atomo di carbonio chirale che possiede due enantiomeri possibili.
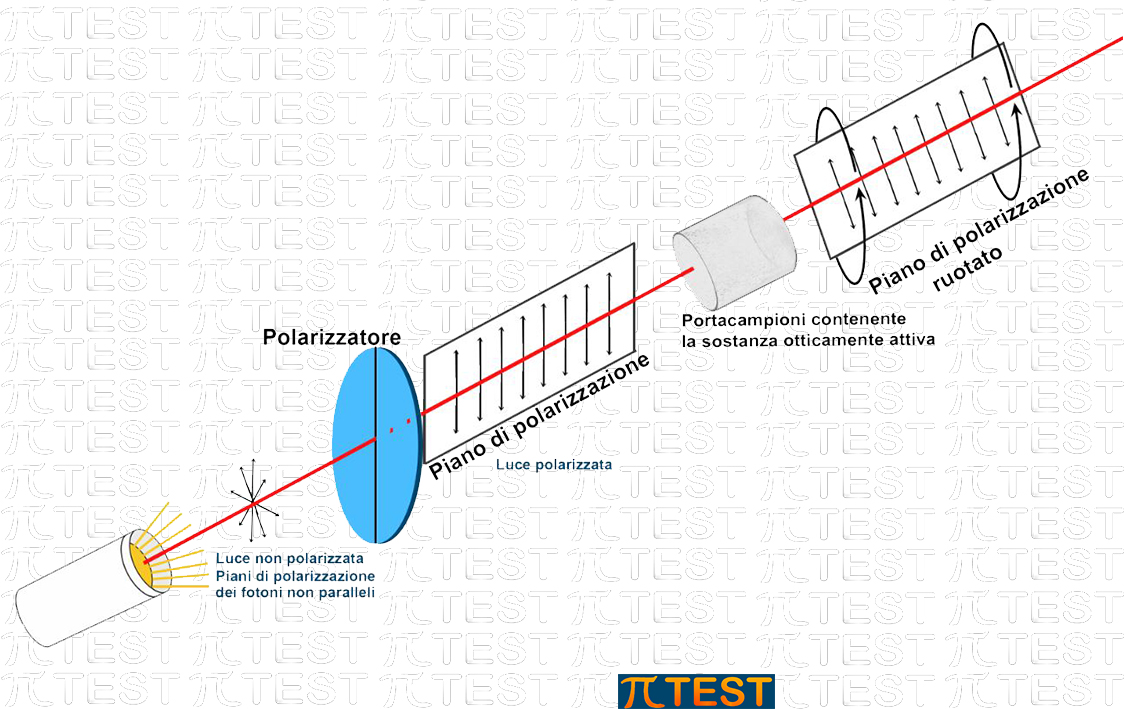
La presenza di un carbonio chirale ha la proprietà di “ruotare” il piano di polarizzazione dei fotoni. La rotazione sarà destrogira (R, right) per uno dei due enantiomeri e sarà invece levogira (L, left) per l’altro enantiomero. Nella nomenclatura di usa il prefisso R o L davanti al nome del composto per individuare quale dei due enantiomeri intendiamo.
La rotazione del piano di polarizzazione è rappresentata nella seguente figura che completa il percorso del fascio di luce polarizzata creato nella precedente figura. Il fascio di luce polarizzata attraversa un portacampioni contenente una certa quantità della sostanza otticamente attiva. Nel disegno seguente si vede che, quando il fascio di luce esce dal portacampioni, il piano di polarizzazione sarà ruotato. Esistono apparecchiature in grado di rilevare e quantificare la rotazione del piano di polarizzazione.
 Tutti gli amminoacidi presenti in natura (sul nostro pianeta) hanno una configurazione L del carbonio chirale C2 (quello legato al carbossile e all’ammina) ad eccezione della glicina nella quale, per l’estrema semplicità della molecola, il carbonio C2 è legato a due atomi di idrogeno (quindi identici) e non è perciò un chirale.
Tutti gli amminoacidi presenti in natura (sul nostro pianeta) hanno una configurazione L del carbonio chirale C2 (quello legato al carbossile e all’ammina) ad eccezione della glicina nella quale, per l’estrema semplicità della molecola, il carbonio C2 è legato a due atomi di idrogeno (quindi identici) e non è perciò un chirale.
© il testo e le immagini sono di esclusiva proprietà dell’autore e sono sottoposte a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito
CONTINUA LO STUDIO DELLA CHIMICA ORGANICA
10.1 Idrocarburi
10.2 Idrocarburi alifatici
10.2.1 Idrocarburi alifatici saturi: gli ALCANI
10.2.2 Radicali alchilici
10.2.3 Idrocarburi ramificati
10.2.4 Proprietà fisiche e chimiche degli alcani
10.2.5 Idrocarburi insaturi: ALCHENI
10.2.6 Proprietà fisiche e chimiche degli alcheni
10.2.7 Idrocarburi insaturi: ALCHINI
10.2.8 Proprietà fisiche e chimiche degli alchini
10.2.9 POLIENI
10.2.10 CICLOALCANI, CICLOALCHENI E COCLOALCHINI
10.2.11 Composti ETEROCICLICI SATURI
10.3 Gli isomeri
10.3.1 Isomeri COSTITUZIONALI DI CATENA
10.3.2 Isomeri COSTITUZIONALI DI POSIZIONE
10.3.3 Isomeri COSTITUZIONALI DI FUNZIONE
10.3.4 Stereoisomeri CONFORMAZIONALI
10.3.5 Stereoisomeri CONFIGURAZIONALI GEOMETRICI
10.3.6 Stereoisomeri CONFIGURAZIONALI OTTICI
10.4 IDROCARBURI AROMATICI
10.4.1 BENZENE
10.4.2 I PRINCIPALI COMPOSTI AROMATICI DERIVANTI DAL BENZENE ‒ ARENI
10.4.3 IDROCARBURI POLICICLICI AROMATICI
10.4.4 COMPOSTI ETEROCICLICI INSATURI
10.5 ADDIZIONE E SOSTITUZIONE ELETTROFILA
10.5.1 ADDIZIONE ELETTROFILA
10.5.2 SOSTITUZIONE ELETTROFILA
10.6 GRUPPI FUNZIONALI
10.6.1 ALOGENURI ALCHILICI E ARILICI
10.6.3 ALCOLI
10.6.4 Proprietà fisiche e chimiche e preparazione degli ALCOL
10.6.5 POLIALCOLI (POLIOLI)
10.6.6 ETERI
10.6.7 CARBONILE – ALDEIDI E CHETONI
10.6.8 CARBOSSILE – ACIDI ORGANICI
10.6.9 ANIDRIDI
10.6.10 ESTERI
10.6.11 LIVELLI DI OSSIDAZIONE DELLE MOLECOLE ORGANICHE
10.6.12 SAPONIFICAZIONE
10.6.13 FOSFOLIPIDI
10.6.14 LIPIDI O GRASSI
10.6.15 AMMINE
10.6.16 AMMIDI
10.6.17 AMMINOACIDI – PROTEINE
10.7 POLIMERI
10.8 CARBOIDRATI


