4.10 I legami intermolecolari
Abbiamo studiato nei precedenti paragrafi i legami che tengono uniti gli atomi all’interno delle molecole che chiamiamo legami intramolecolari (intra=dentro).
Studiamo ora i legami che esistono tra molecola e molecola e che danno un senso di coesione alla materia, i legami intermolecolari.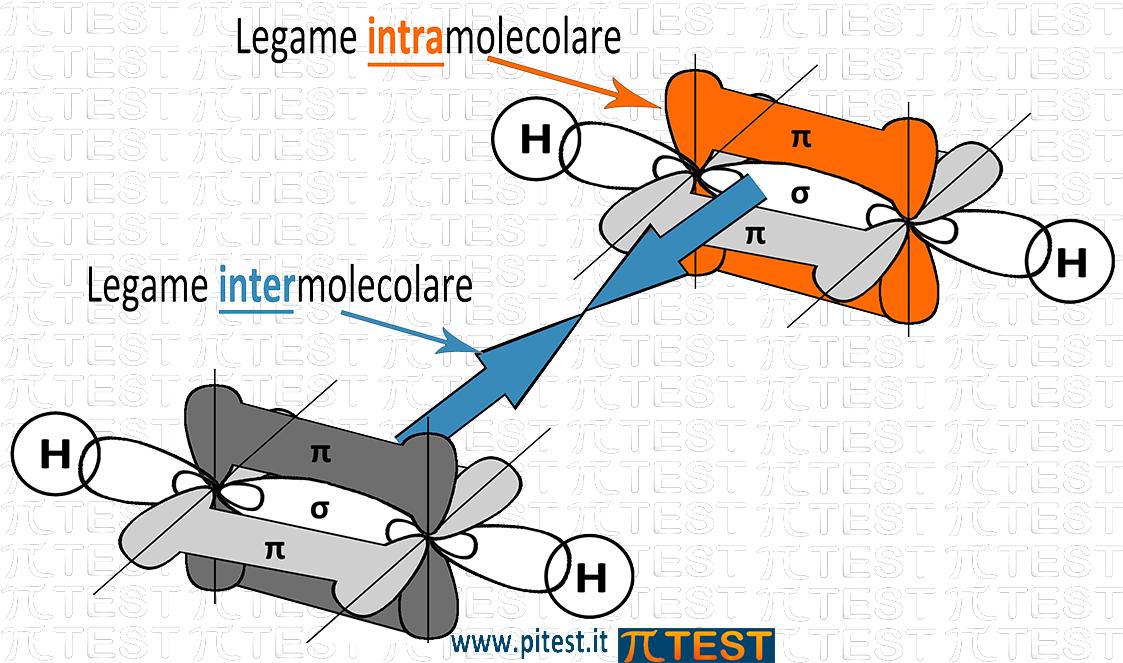
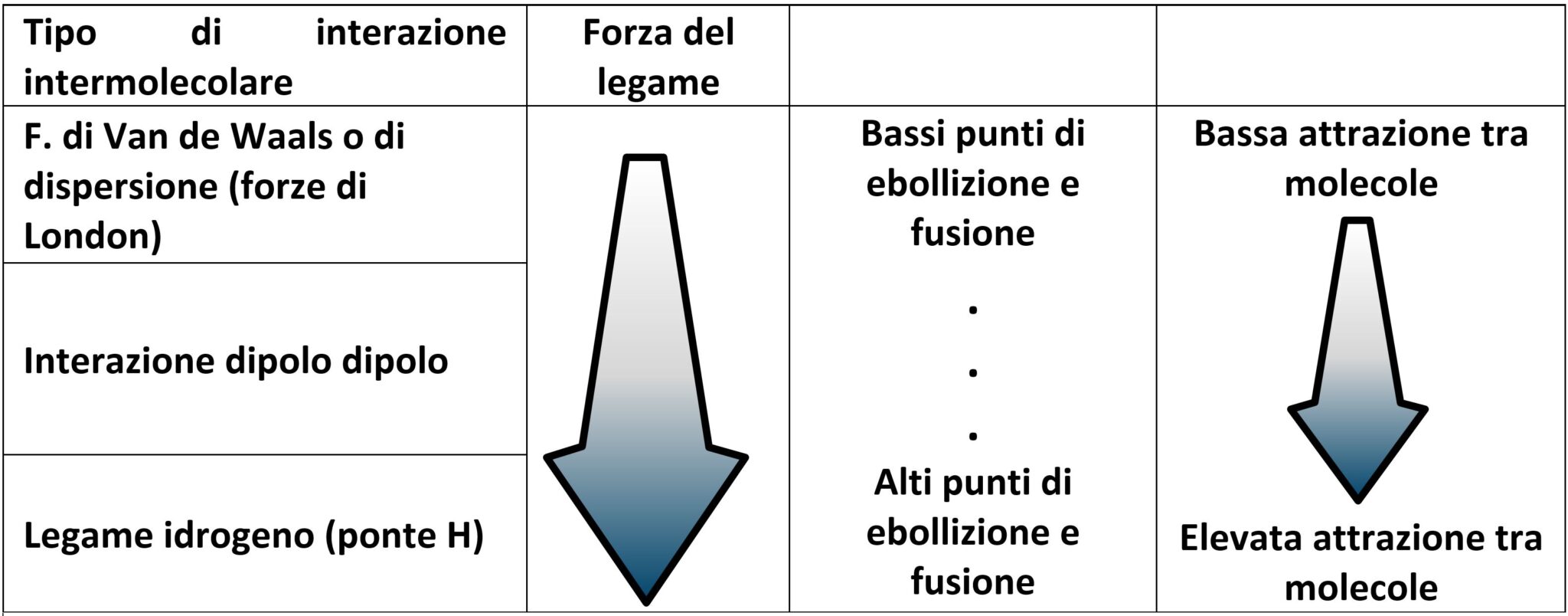
Le forze intermolecolari determinano alcune caratteristiche delle sostanze, come ad esempio punto di fusione o di ebollizione. Un’elevata forza fra le molecole di un liquido fa innalzare il suo punto di ebollizione. Per portare le molecole in fase vapore bisogna fornire una quantità di energia (calore) per rompere questi legami. Energia che è tanto maggiore quanto più forti sono le forze intermolecolari. Analogamente possiamo ragionare per il punto di fusione.
|
Forze intermolecolari elevate |
Alta temperatura di ebollizione
Alta temperatura di fusione |
|
Forze intermolecolari deboli |
Bassa temperatura di ebollizione
Bassa temperatura di fusione |
Le forze intermolecolari dipendono dalla polarità delle molecole. Nelle molecole polari sono presenti dipoli. Cioè all’interno della molecola possiamo individuare zone positive e zone negative che costituiscono i due poli δ+ δ– . Le molecole polari si posizionano nello spazio in modo che le loro polarità interagiscono in funzione dell’attrazione rivolgendosi con il polo negativo dell’una che si collega al polo positivo dell’altra. Classifichiamo queste interazioni con il nome dipolo-dipolo.
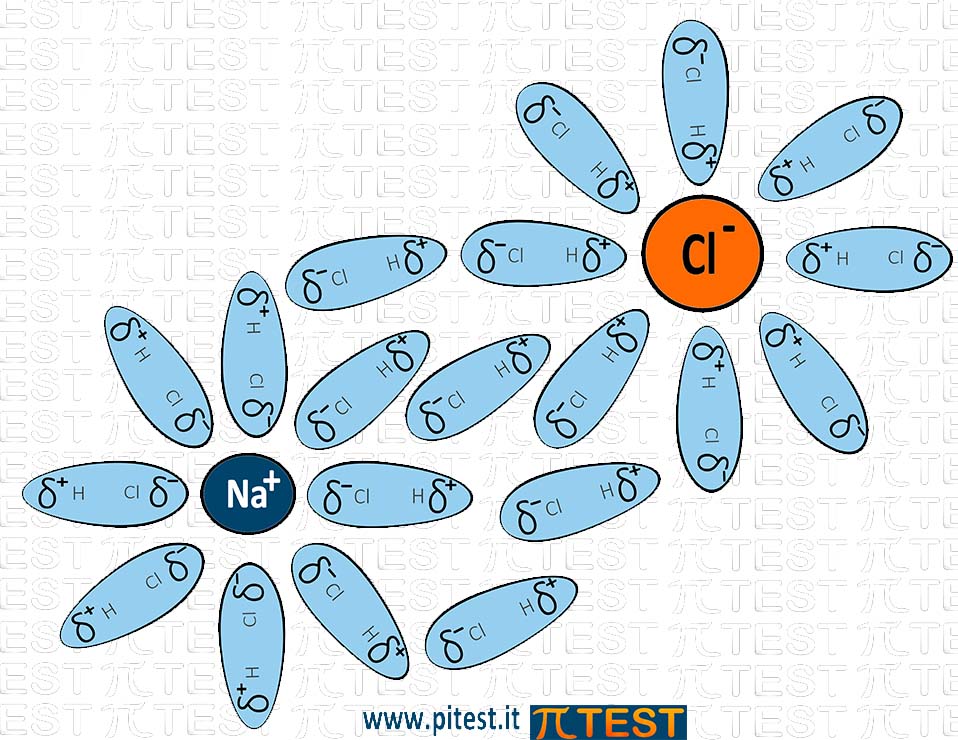
All’interno di liquidi polari subiscono forze simili anche gli ioni disciolti, le forze ione-dipolo.
In assenza di polarità (sostanze pure o con dipoli annullati internamente alla molecola) intervengono comunque forze più deboli note come forze di Van der Waals o di dispersione.
Molecole particolari formano legami intermolecolari molto forti detti Legame a idrogeno (o Ponte a idrogeno).
4.10.1 Forze intermolecolari dipolo-dipolo
Le molecole polari formano intorno a sé leggeri campi elettrici che agiscono su altre molecole polari vicine.
Le molecole dipolari tendono a disporsi in modo ordinato con i poli che si posizionano mettendosi uno difronte all’altro con polarità opposte.

4.10.2 Forze intermolecolari ione-dipolo
Un soluto ionico presente in un solvente viene circondato dai dipoli del solvente. Anche nel caso di solventi apolari nascono dipoli indotti nelle molecole del solvente.
4.10.3 Forze intermolecolari di dispersione o di Van der Waals
Anche le molecole non polari presentano una attrazione intermolecolare anche se molto debole nota come Forze di Van der Waals. La spiegazione di queste forze è stata data dal fisico Fritz London.
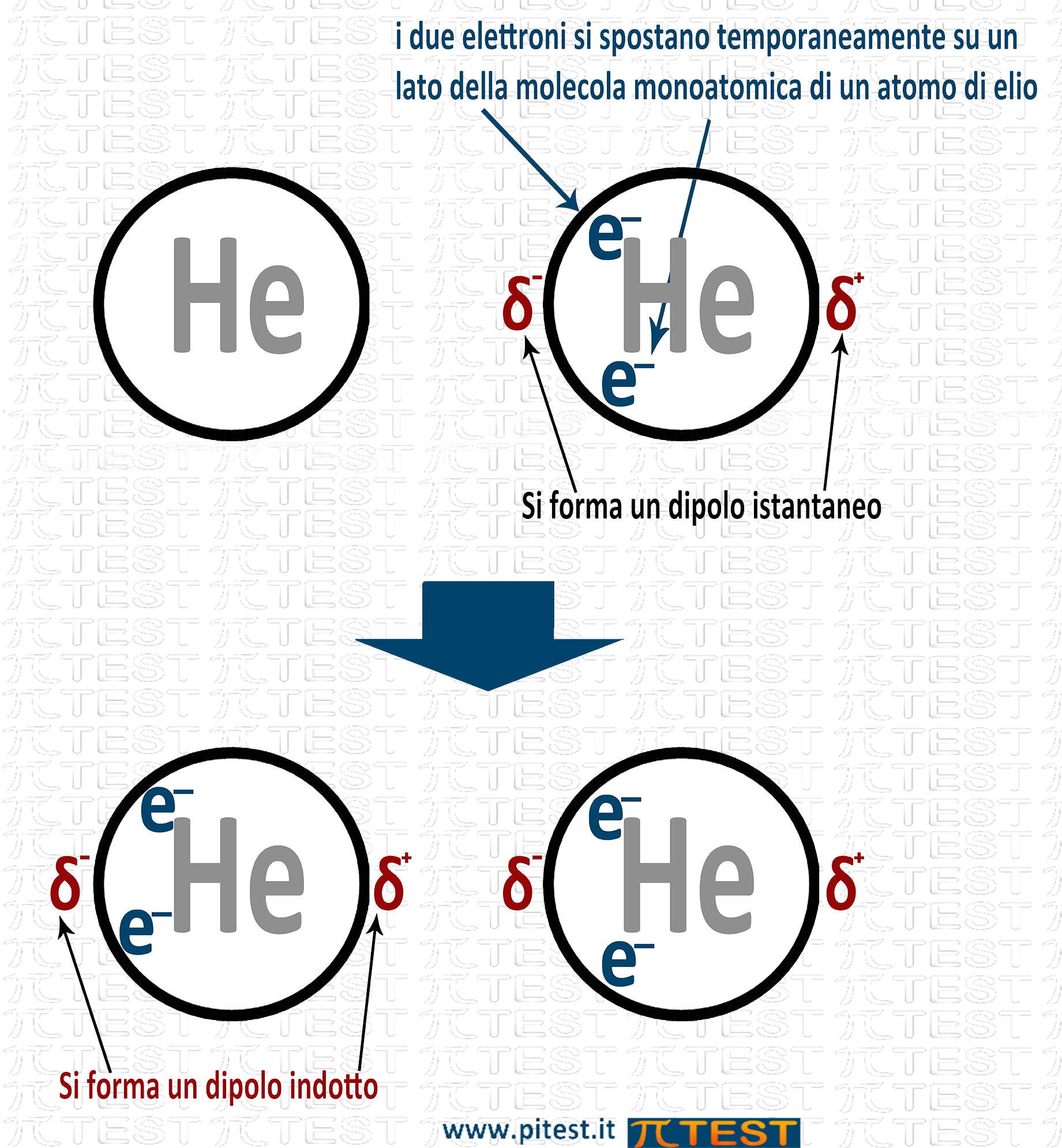
Secondo London le molecole apolari formano a volte per brevi istanti un dipolo a causa della distribuzione degli elettroni che, anche se mediamente è uniforme e senza polarità, per un istante possono trovarsi sbilanciati in eccesso da una parte della molecola formando un polo negativo temporaneo; dalla parte opposta rimane un polo positivo. Nel complesso si è formato un dipolo temporaneo o istantaneo (che dura un solo istante). Questo dipolo istantaneo crea un campo elettrico e induce nelle nuvole elettroniche delle molecole adiacenti un altro dipolo (dipolo indotto). Tra dipolo istantaneo e dipolo indotto si verifica una attrazione che pur breve nel tempo è sempre una attrazione.
Le forze di London sono più intense nelle molecole più grandi per la maggior facilità a polarizzarsi della nube elettronica più estesa.
Le forze di Van der Waals si manifestano solamente a breve distanza e sono presenti quindi solamente nella fase liquida e solida.
4.10.4 Legame idrogeno (ponte idrogeno)
Quando all’interno di un composto troviamo un atomo di idrogeno H legato ad un atomo molto elettronegativo (azoto N, ossigeno O e fluoro F), si forma un legame intermolecolare molto forte tra quest’atomo di idrogeno di una molecola con l’atomo elettronegativo (N, O o F) di un’altra molecola.
I composti che si utilizzano come esempi tipici di legame a idrogeno sono l’ammoniaca NH3, l’acqua H2O e l’acido fluoridrico HF.
Oltre al fatto che i legami H-O, H-N e H-F sono molto polari si aggiunge anche che azoto, ossigeno e fluoro possiedono doppietti elettronici liberi (orbitali occupati da due elettroni e non coinvolti in legami covalenti) che contribuiscono a creare un polo fortemente negativo δ−; di contro sugli atomi di idrogeno si forma un polo positivo δ+.
Il legame ad idrogeno o ponte idrogeno si forma quando un atomo di idrogeno è attratto elettrostaticamente dall’atomo elettronegativo di una molecola accanto.
Tra tutti i legami intermolecolari è il più forte. Ricordiamo che comunque i legami intermolecolari sono sempre legami deboli e tra questi il legame a idrogeno è il più forte.
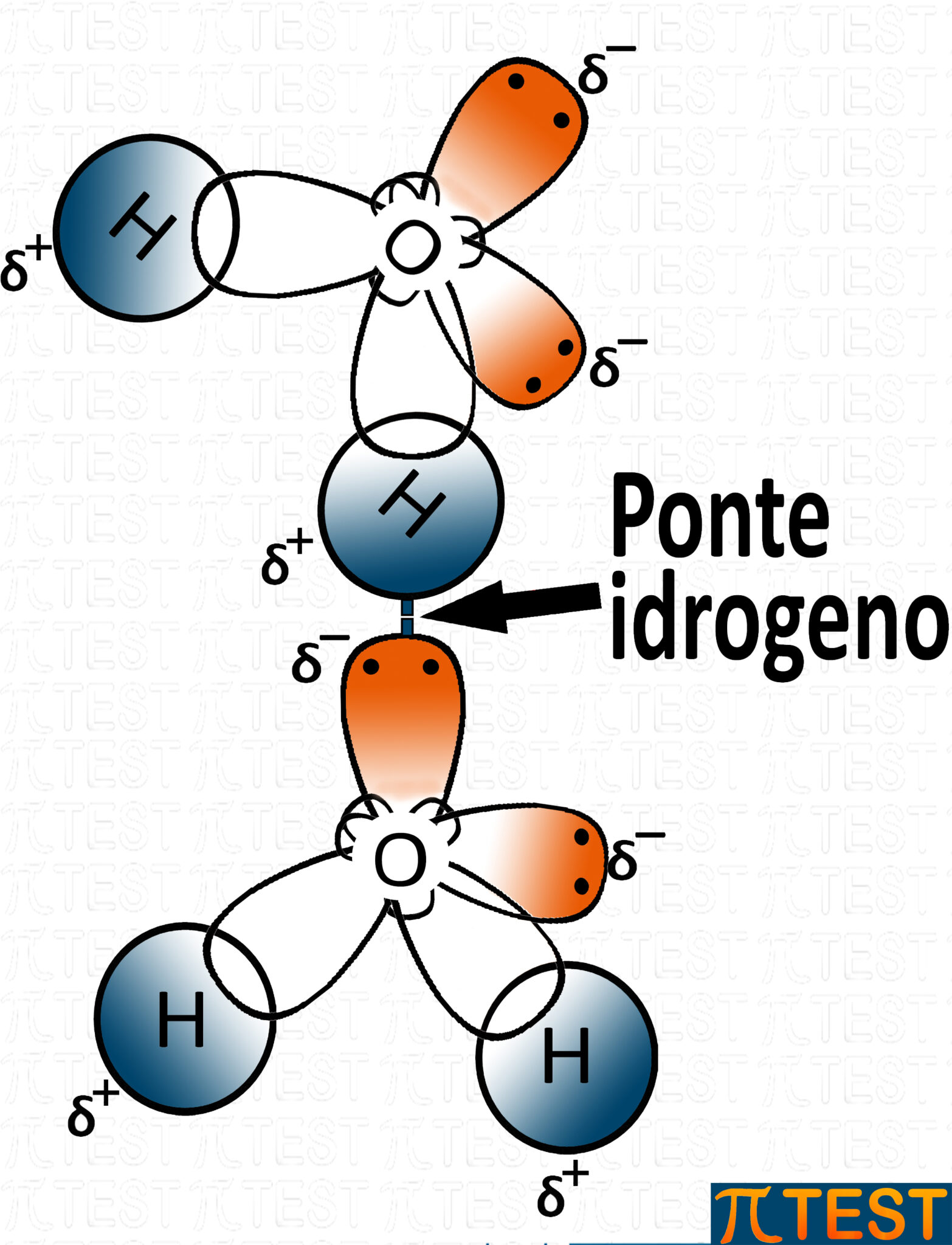
Legame a idrogeno nell’acqua
L’immagine qui sopra rappresenta un legame idrogeno tra due molecole d’acqua.
possiamo rappresentarlo anche con la seguente immagine.
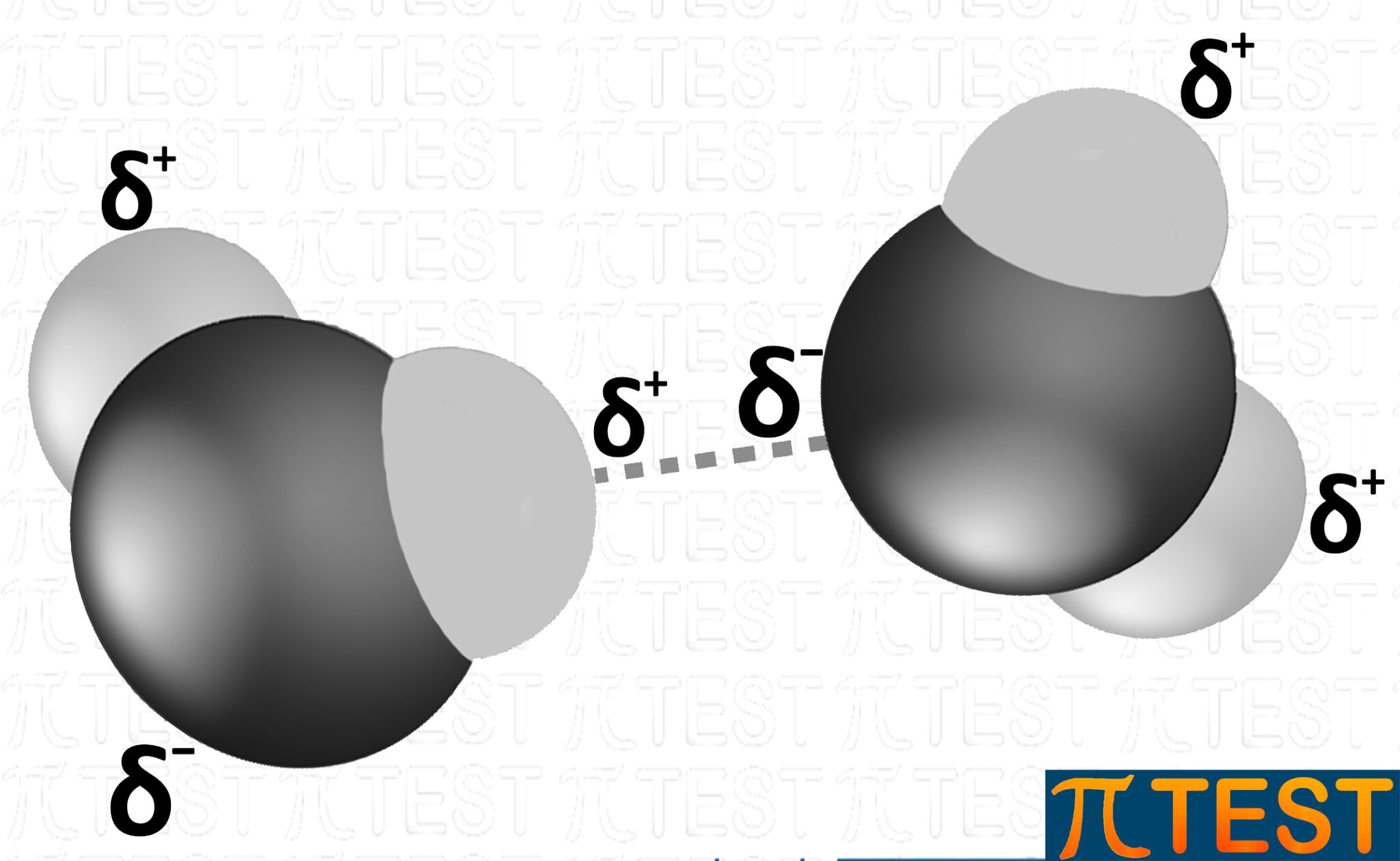
Tutte le molecole d’acqua sono collegate tramite ponti idrogeno.
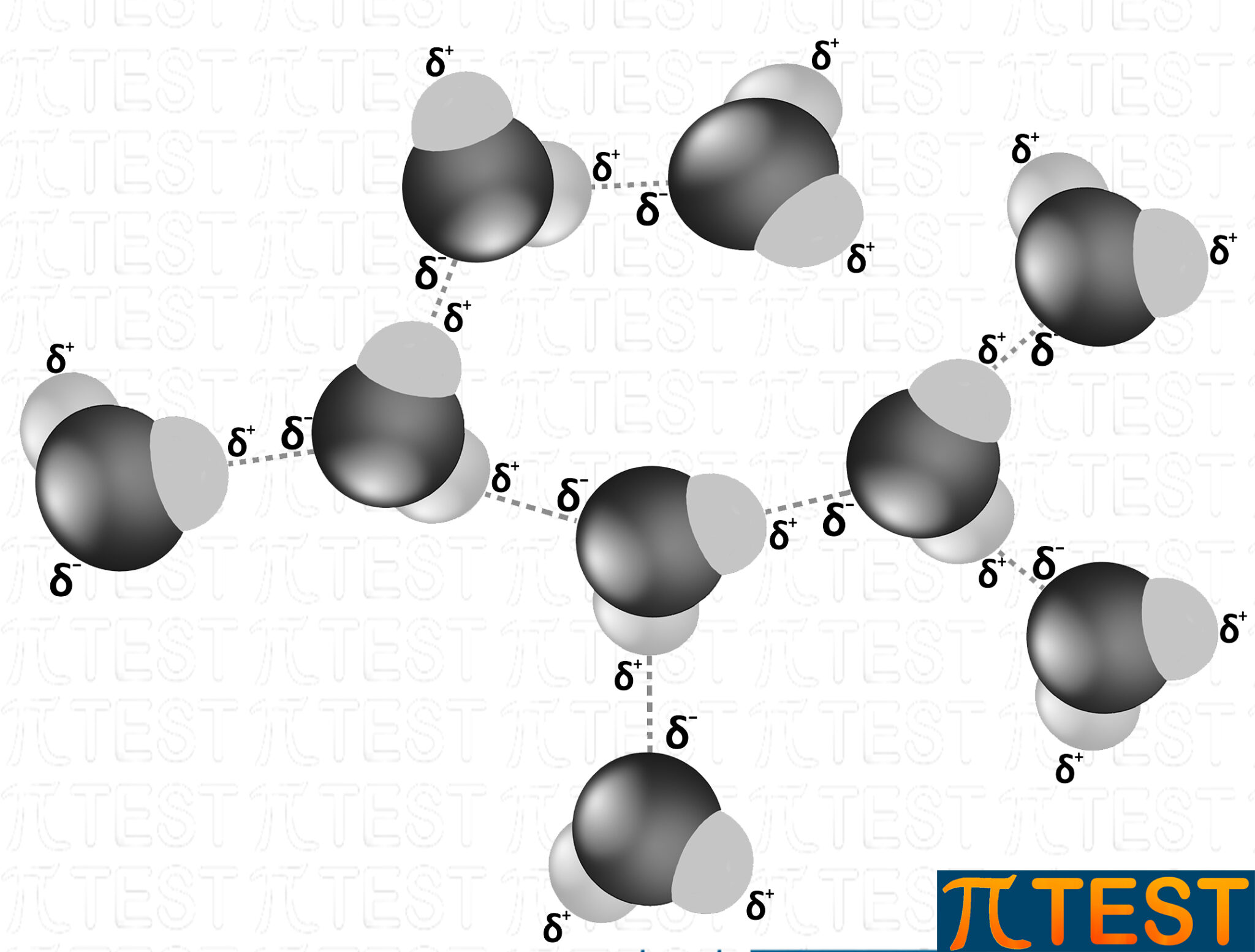
Nell’acqua il legame a idrogeno si forma sia nello stato liquido che nello stato solido.
Il legame ad idrogeno nell’acqua è responsabile di alcuni comportamenti particolari che caratterizzano l’acqua rispetto ad altre sostanze:
- Diminuzione di densità del solido rispetto al liquido. Nella fase solida le molecole d’acqua assumono una posizione l’una rispetto all’altra tale da rendere le posizioni “comode” che rispettano sia la presenza di ponti idrogeno, sia l’angolo proprio di 107,5° della molecola d’acqua. Questo porta la formazione di strutture esagonali con zone completamente vuote che alleggeriscono la struttura e diminuiscono la densità. Da tale diminuzione di densità deriva il galleggiamento del ghiaccio sull’acqua.
| acqua | ghiaccio |
 |
 |
| Densità dell’acqua liquida =
1000 kg/m3 = 1 g/cm3 |
Densità dell’acqua solida (ghiaccio) =
900 kg/m3 = 0,9 g/cm3 |
- Formazione del fiocco di neve che con la sua bellissima geometria è dovuto ai legami ad idrogeno tra molecole d’acqua che passano dallo stato gassoso a quello solido (brinamento) permettendo alle molecole di prendere la posizione più comoda che rispetta l’angolo proprio della molecola d’acqua di 107,5°.
- Il legame a idrogeno è responsabile di una forte coesione intermolecolare che causa un punto di ebollizione molto alto, di 100°C. Altre molecole polari anche più pesanti hanno un punto di ebollizione molto più basso per il solo fatto di non avere legami ad idrogeno. Ad esempio l’acido solfidrico H2S presenta una geometria identica (ibridazione sp3) ma non forma legami a idrogeno e per questo motivo il suo punto di ebollizione è di -140°C.
Legame a idrogeno in altre sostanze
Il legame a idrogeno si verifica nell’ammoniaca identicamente a come si verifica nell’acqua.
In una miscela acqua-ammoniaca i ponti idrogeno possono crearsi anche tra atomi di idrogeno appartenenti all’acqua e atomi di azoto dell’ammoniaca e viceversa si possono creare tra atomi di idrogeno dell’ammoniaca e atomi di ossigeno dell’acqua.
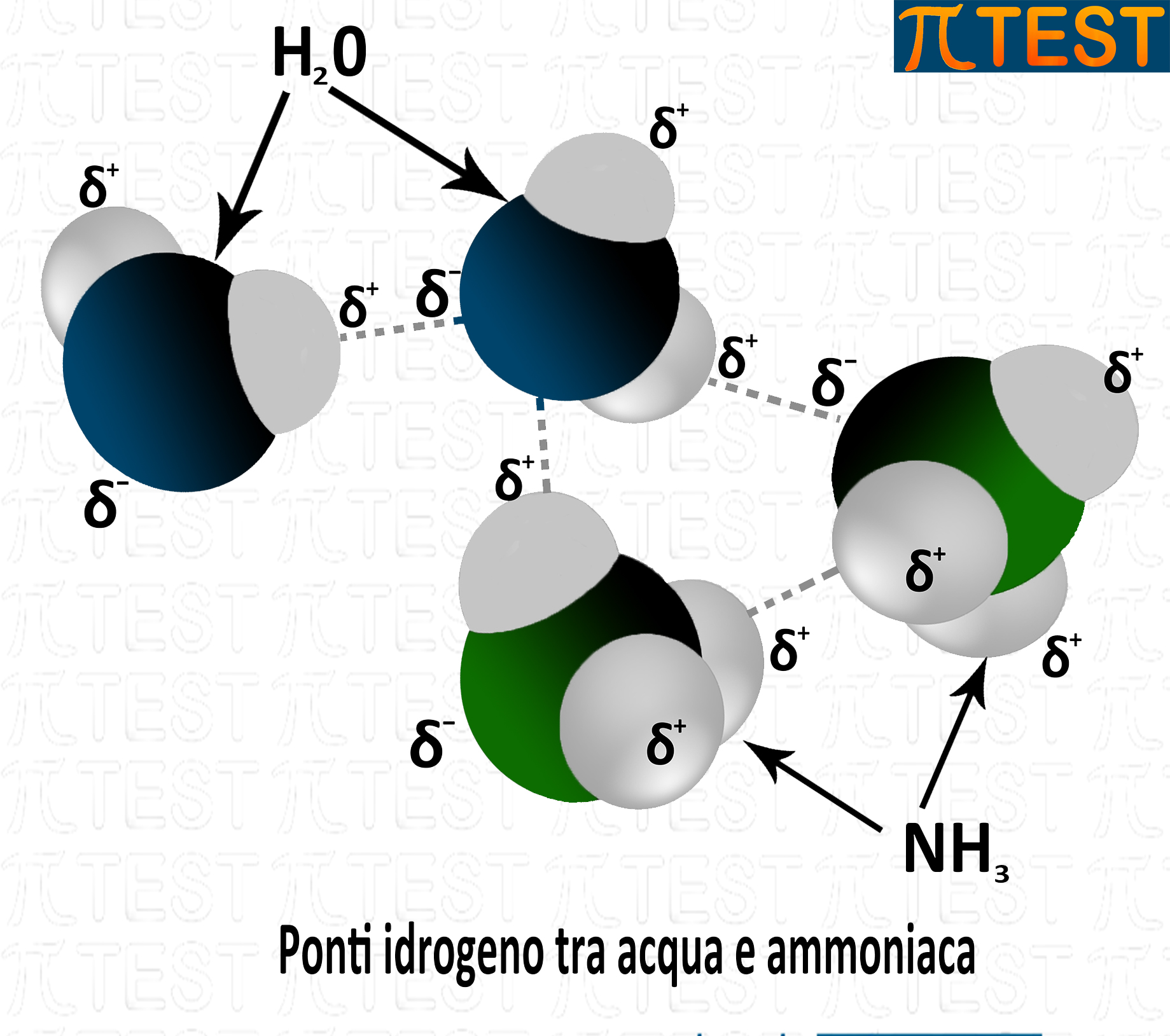
I ponti idrogeno di formano anche negli alcoli a causa della presenza di ossidrili –OH del gruppo funzionale alcolico. Grazie alla possibilità di ponti idrogeno gli alcoli hanno un punto di ebollizione molto più alto rispetto ai corrispondenti idrocarburi.
Sempre grazie al gruppo alcolico –OH accade che gli alcoli sono ben miscibili con l’acqua. Si formano infatti ponti idrogeno tra l’idrogeno dell’ossidrile alcolico e la molecola d’acqua.
Anche nelle ammine primarie e secondarie la presenza del gruppo –NH2 e –NH permette la formazione di ponti idrogeno.
Il legame a idrogeno si verifica anche nelle biomolecole:
- la doppia elica del DNA risulta stabilizzata dei legami a idrogeno che si formano tra le basi azotate opposte presenti sui filamenti;
- la struttura secondaria delle proteine viene definita sulla base del network di legami ad idrogeno. Nella struttura ad elica la catena polipeptidica della proteina forma una spirale destrogira, avvolgendosi grazie a ponti idrogeno che si formano tra l’idrogeno del gruppo amminico e l’ossigeno del gruppo C=O di un altro amminoacido. La struttura proteica a foglietto è invece formata da alcune catene affiancate tenute insieme dallo stesso tipo di legame cioè dall’idrogeno del gruppo amminico e l’ossigeno del gruppo C=O di un altro amminoacido di una catena affiancata.
QUIZ sui Legami Intermolecolari |
|||
|---|---|---|---|
© il testo è di esclusiva proprietà dell’autore ed è sottoposto a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito


