1.5 Lo stato liquido
1.5.1 La tensione superficiale
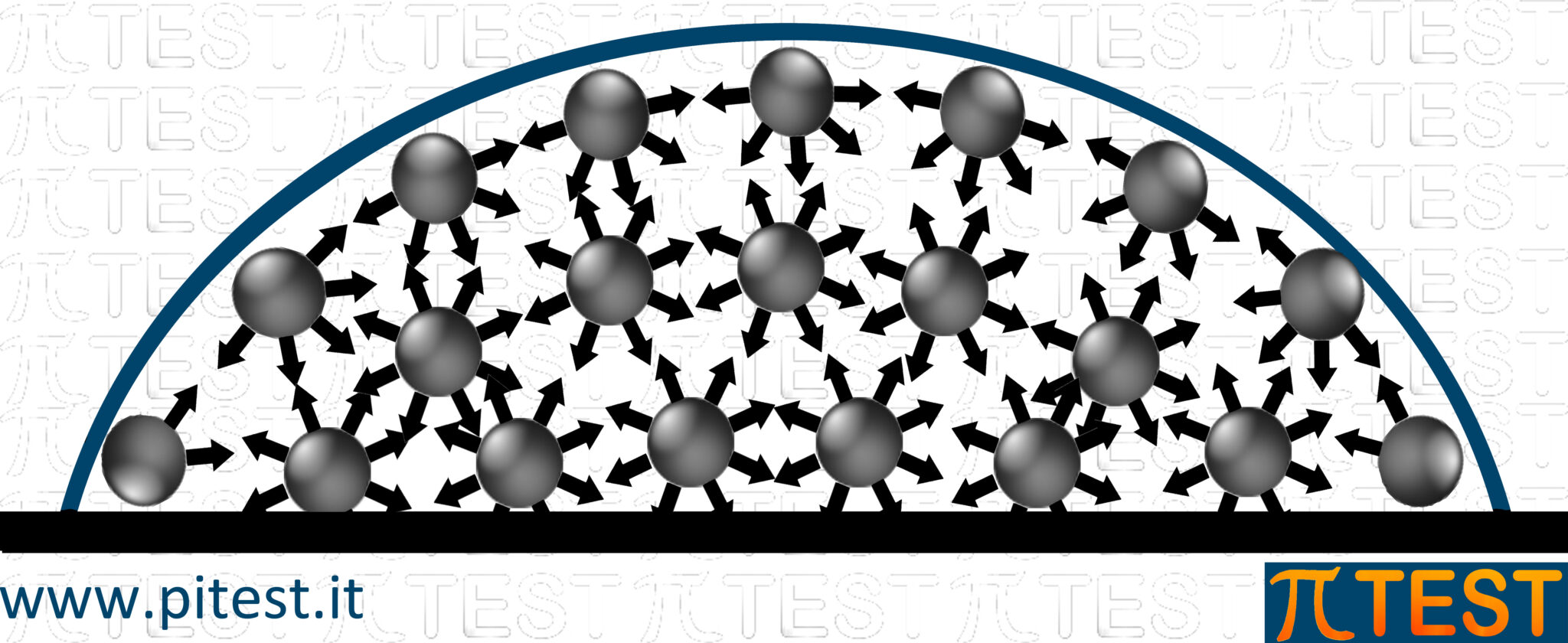 Le molecole presenti sulla superficie di un liquido sono attratte dalle molecole sottostanti: manca però altrettanta attrazione dalla parte esterna. Ne consegue un’attitudine delle molecole a compattarsi verso l’interno. Da questo fenomeno deriva la Tensione Superficiale. Le superfici di un liquido per questo motivo è come se avessero un velo di protezione costituito da uno strato di molecole coese. È per questo motivo che le gocce libere (ad esempio della pioggia) risultano compatte.
Le molecole presenti sulla superficie di un liquido sono attratte dalle molecole sottostanti: manca però altrettanta attrazione dalla parte esterna. Ne consegue un’attitudine delle molecole a compattarsi verso l’interno. Da questo fenomeno deriva la Tensione Superficiale. Le superfici di un liquido per questo motivo è come se avessero un velo di protezione costituito da uno strato di molecole coese. È per questo motivo che le gocce libere (ad esempio della pioggia) risultano compatte.
1.5.2 Capillarità e bagnabilità
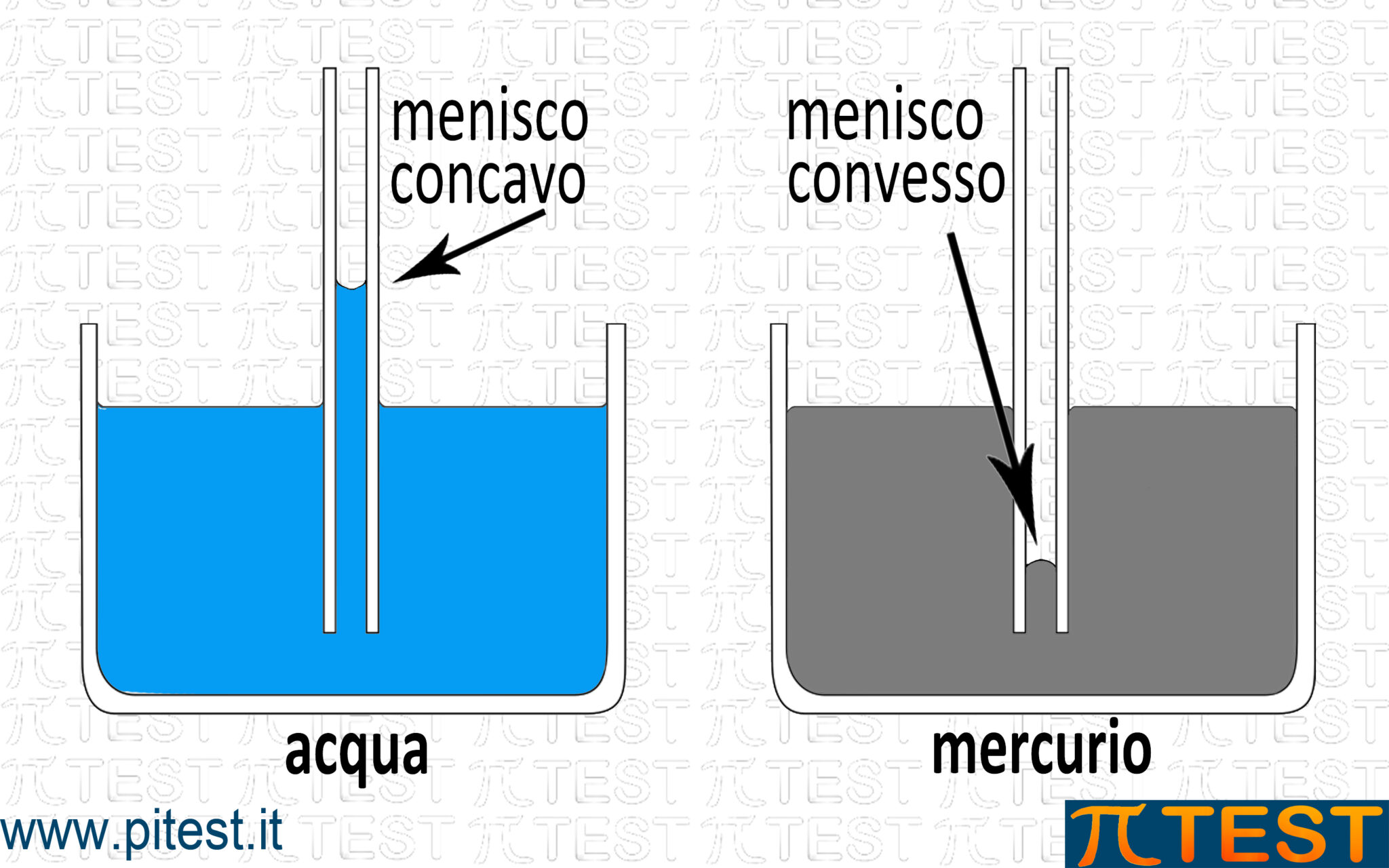
Un liquido possiede nei confronti dei corpi solidi diversi possibili comportamenti in funzione del tipo di interazione intermolecolare. La superficie del liquido in prossimità del solido assume di conseguenza forme diverse. Se consideriamo un tubo di vetro inserito nel liquido, chiamiamo menisco la forma della superficie del liquido. Ad esempio il vetro ha un’alta bagnabilità da parte dell’acqua mentre ha una bassa bagnabilità da parte del mercurio. Il menisco formato con l’acqua risulta concavo perché l’acqua tende a risalire sulle superfici del vetro (per poterle bagnare) mentre quello formato col mercurio risulta convesso perché il mercurio “evita” di bagnare le superfici del vetro.
1.5.3 Viscosità
| La viscosità di un liquido determina la tendenza ad opporsi ai movimenti.
Un liquido più viscoso fa più resistenza quando viene messo in movimento e scorre con più difficoltà. |
 |
|
1.5.4 Densità
La densità è definita come il rapporto tra massa e volume d=massa/volume .
| L’olio, come quasi tutti i fluidi organici, ha una densità inferiore all’acqua e, poiché è immiscibile, si formano due fasi liquide nelle quali l’olio occupa la parte superiore in quanto è quello “meno pesante”. |  |
|
Per i quiz è importante conoscere il valore della densità dell’acqua nelle diverse unità di misura:
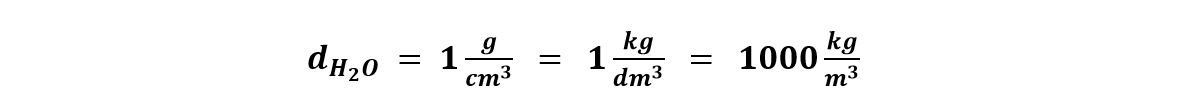
Questi valori per l’acqua sono validi a 4°C. Quando la temperatura non viene specificamente indicata dal quiz, assumiamo sempre questi valori.
1.5.5 Sistemi a due fasi liquide
Due diverse sostanze allo stato liquido possono formare una miscela omogenea oppure un sistema a due fasi a seconda della reciproca miscibilità.
I liquidi polari formano soluzioni omogenee con altri liquidi polari e similmente i liquidi apolari con altri liquidi apolari secondo la regola “similes cum similibus” (i simili con i simili).
Al contrario i liquidi polari non si mescolano con i liquidi apolari e si formano due distinte fasi. L’esempio più classico è quello dell’acqua con l’olio. Anche se mescoliamo con energia le due fasi avremo una emulsione con piccole particelle di olio disperse nell’acqua di dimensioni non visibili ad occhio nudo; il sistema rimane comunque eterogeneo.
| QUIZ 1.5 Lo stato liquido | |||
| QUIZ 1 | QUIZ 2 | QUIZ 3 | |
© il testo è di esclusiva proprietà dell’autore ed è sottoposto a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito


