8.8 Le proprietà colligative
In un solvente puro, cioè senza soluti disciolti in esso, le molecole sono libere di interagire tra loro, attraendosi. L’aggiunta di un soluto influenza queste interazioni, determinando il fenomeno della solvatazione e incidendo, in modo significativo, su molti parametri fisici della soluzione (punto di ebollizione, punto di fusione, tensione di vapore ecc.), che risulteranno diversi da quelli misurati sul solvente puro. Le differenze saranno particolarmente evidenti quando al solvente viene aggiunto un soluto non volatile, che determinerà una diminuzione della tensione di vapore della soluzione, rispetto a quella misurata sul solvente puro. La diminuzione della tensione di vapore provocherà, a sua volta, un innalzamento della temperatura di ebollizione.
Il generale chiamiamo proprietà colligative quelle caratteristiche di una soluzione che dipendono dal variare dei fenomeni di interazione intermolecolari (collegamenti tra molecola e molecola).
Le proprietà colligative sono:
- l’abbassamento della tensione di vapore;
- l’innalzamento del punto di ebollizione (innalzamento ebullioscopico);
- l’abbassamento del punto di congelamento (abbassamento crioscopico);
- la pressione osmotica.
Coefficiente di Van’t Hoff « i »
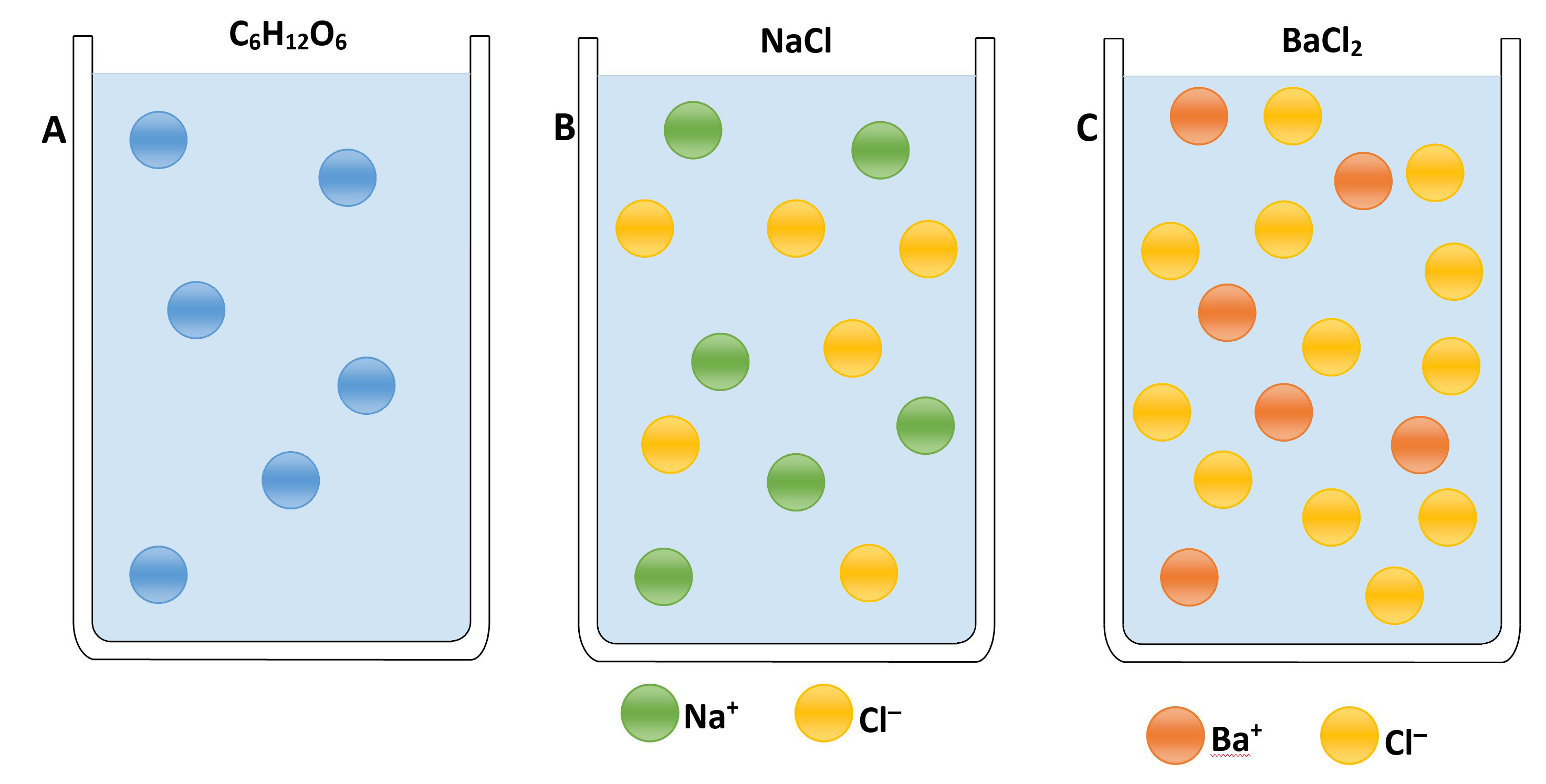
Nelle formule che utilizziamo per quantificare le proprietà colligative si utilizza il coefficiente di Van’t Hoff che tiene conto della molteplicità delle specie ioniche rilasciate in soluzione. Per comprendere meglio vediamo l’esempio dei tre becher in figura nei quali sono state sciolte lo stesso numero di moli in (A) di glucosio C6H12O6, in (B) di cloruro di sodio NaCl, e in (C) di cloruro di bario BaCl2. Il numero delle particelle presenti nelle tre soluzioni, però, non è uguale, perché in (A) c’è glucosio, un composto molecolare che non si dissocia; in (B) c’è un composto ionico che in soluzione è dissociato in due ioni, Na+ e Cl–; in (C) c’è un sale che si scompone in tre ioni, uno di Ba2+ e due di Cl–.
Coefficiente di Van ‘t Hoff « i »
C6H12O6 = 1
NaCl = 2
BaCl2 = 3
Abbassamento della tensione di vapore
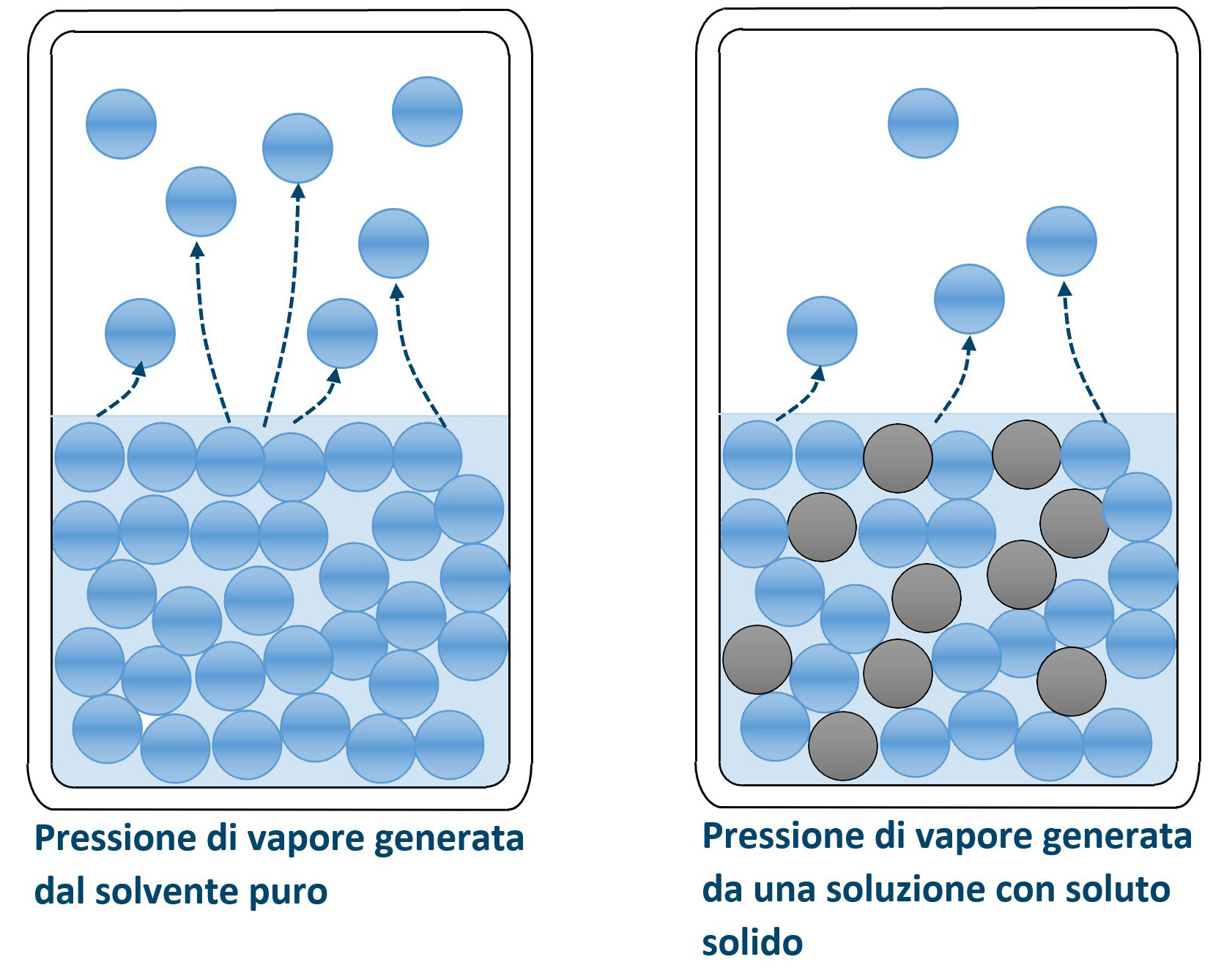
La tensione o pressione di vapore è la pressione esercitata dai vapori generati da un liquido ed in equilibrio con esso, in un recipiente chiuso. Questa pressione aumenta all’aumentare della temperatura. All’aumentare della temperatura, infatti, aumenta l’energia delle molecole ed aumenta il numero di molecole capaci di staccarsi dalla fase liquida. Un maggior numero di molecole nella fase gassosa aumenta il numero degli urti verso le pareti del recipiente, urti che sono la causa della pressione.
Fissiamo la temperatura e quindi fissiamo anche la tensione di vapore. Se nel liquido, considerato come un solvente, immettiamo un soluto solido come ad esempio un sale, avremo un abbassamento della tensione di vapore. Consideriamo le moli di solvente e le moli di soluto e le loro frazioni molari:

La frazione molare del solvente è un valore minore di uno perché nella soluzione non c’è solo il solvente ma anche il soluto. Per quanto riguarda l’evaporazione le molecole si solvente evaporano e vanno a costituire una certa pressione di vapore; le molecole del soluto, che di sua natura è un solido come ad esempio un sale, invece non evaporano e non contribuiscono al valore della pressione. La tensione di vapore (o pressione di vapore) complessiva sarà così minore al valore che si genera quando il solvente è puro. Il suo valore si calcola con la legge di Raoult:
Psoluzione=Psolvente ∙ χsolvente
Affermiamo così la regola generale, così come possiamo trovarla nei quiz:
All’aumentare della presenza di soluti solidi in un solvente diminuisce la tensione di vapore
————————–
Approfondimento:
Se una soluzione è data da una miscela di due o più liquidi con diversa volatilità (*), la tensione di vapore è data da una combinazione delle volatilità dei diversi liquidi che compongono la miscela. La fase di vapore, rispetto alla composizione della miscela stessa, sarà più ricca del componente più volatile. Questo è il principio alla base della distillazione (vedi i metodi di separazione).
_____
Nota: (*) La volatilità indica la propensione di un liquido ad evaporare; il liquido con volatilità più alta avrà una temperatura di ebollizione più bassa.
Innalzamento ebullioscopico
L’ebollizione è un passaggio dalla fase liquida alla fase di vapore, genericamente chiamato evaporazione, che avviene in condizioni particolari ad una temperatura tale che la tensione di vapore (pressione di vapore) è uguale alla pressione esterna.
La tensione di vapore, o pressione di vapore, aumenta all’aumentare della temperatura. Quando raggiunge un valore uguale alla pressione dell’ambiente esterno si possono formare bolle di vapore anche all’interno della massa liquida. Bolle che non riuscirebbero ad esistere a temperature inferiori perché avrebbero una pressione inferiore e verrebbero schiacciate e costrette a ricondensare.
La presenza di un soluto di natura solida, come ad esempio un sale disciolto, diminuisce la pressione di vapore e per raggiungere un valore di pressione pari a quella esterna abbiamo bisogno di temperature più alte. Questo aumento di temperatura per raggiungere l’ebollizione in presenza di un soluto è detto Innalzamento Ebullioscopico.
∆Teb = Teb._soluzione – Teb._solvente puro
L’innalzamento ebullioscopico dipende dalla concentrazione molale m, dal coefficiente di Van’t Hoff e da una costante sperimentale caratteristica di ciascun solvente, detta costante ebullioscopica Keb, secondo la relazione:
∆Teb = Keb · m · i
Abbassamento crioscopico
La temperatura di solidificazione o di fusione (si tratta dello stesso passaggio di stato letto nei due sensi opposti), detta anche punto di fusione, è la temperatura alla quale avviene il passaggio di stato da solido a liquido.
La presenza di un soluto di natura solida, come ad esempio un sale disciolto, aumenta la possibilità che la soluzione rimanga ancora liquida a temperature inferiori a quella di solidificazione, perché il soluto interferisce indebolendo le forze attrattive tra le molecole del liquido. Questa diminuzione della temperatura per raggiungere la solidificazione in presenza di un soluto è detto Abbassamento Crioscopico.
∆Tcr. = Tcr._solvente puro – Tcr._soluzione
L’abbassamento crioscopico dipende dalla concentrazione molale m, dal coefficiente di Van’t Hoff e da una costante sperimentale caratteristica di ciascun solvente, detta costante crioscopica Kcr, secondo la relazione:
∆Tcr = Kcr · m · i
Pressione osmotica
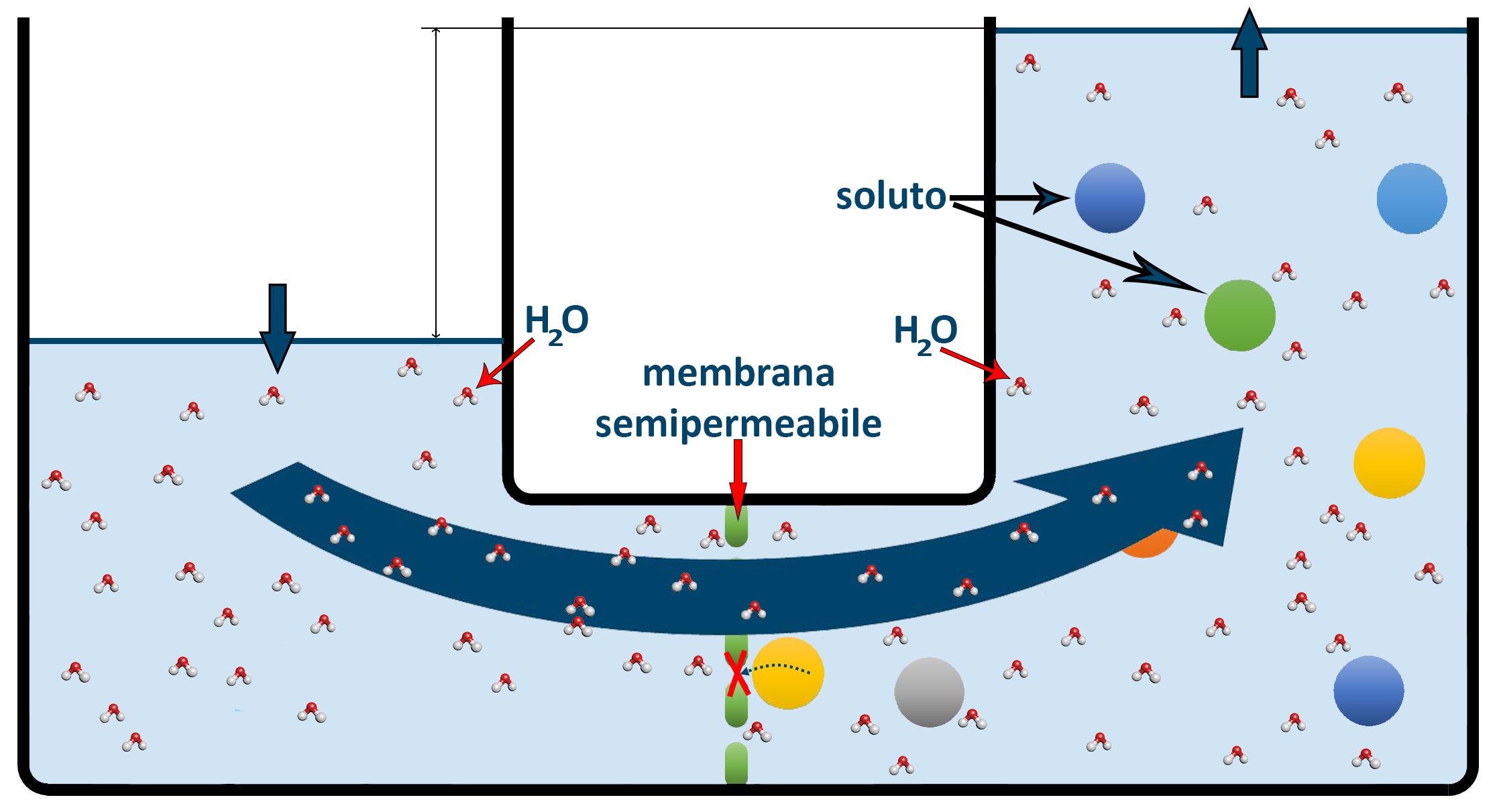
L’osmosi è la migrazione spontanea delle molecole del solvente da una soluzione più diluita a una più concentrata, attraverso una membrana semipermeabile (setto poroso; membrana cellulare) che permette il passaggio del solvente ma non dei soluti di natura solida (sali, glucosio, proteine, ecc.).
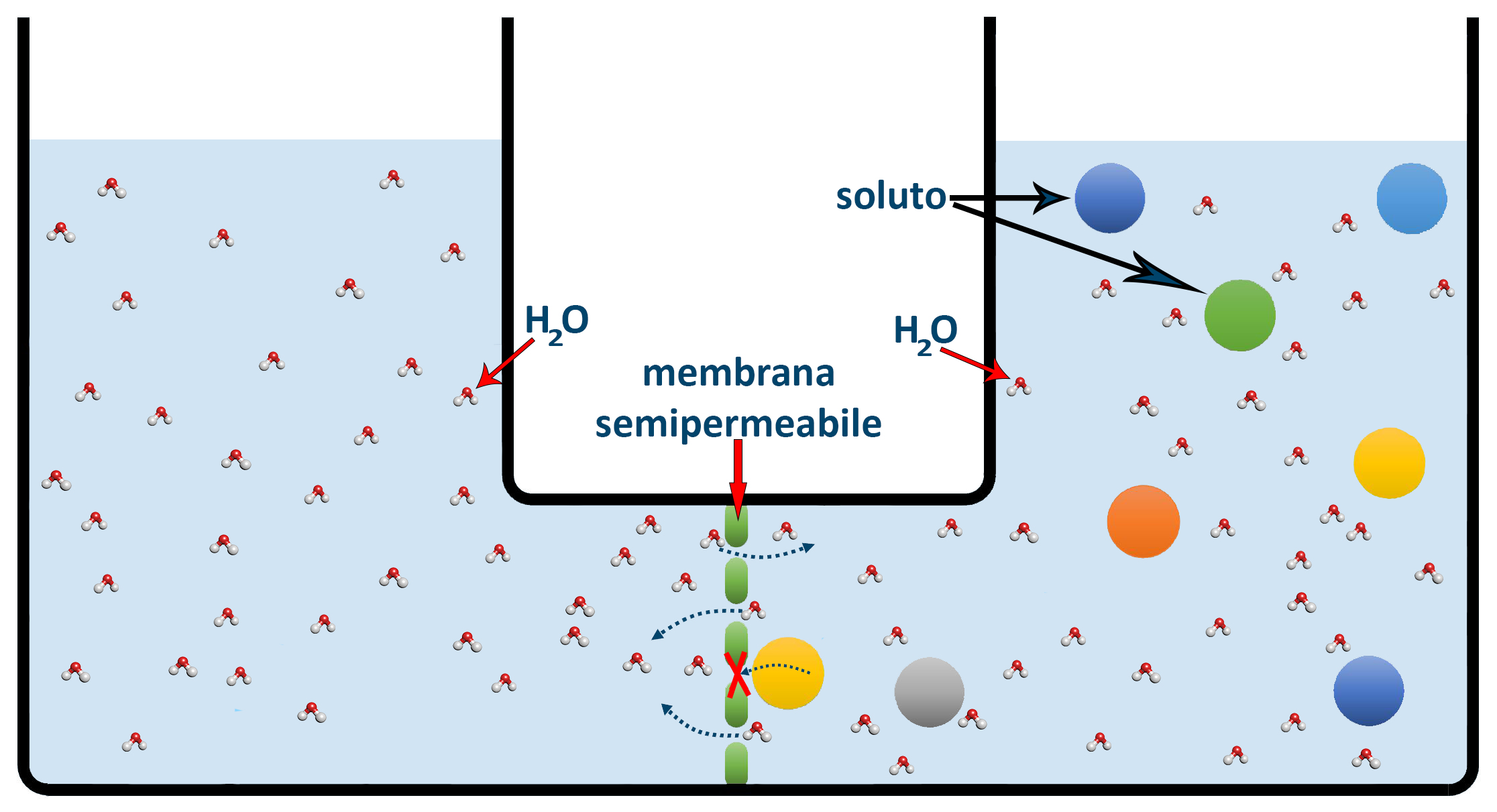 Nella figura superiore vediamo un contenitore con al centro una membrana semipermeabile che permette il passaggio delle molecole d’acqua, ma non delle molecole dei soluti disciolti. L’acqua dalla soluzione di sinistra con meno soluto o senza soluto come nella figura passa nella soluzione di destra più ricca di soluto. L’acqua sta cercando di diluire la soluzione più concentrata per uniformare le due soluzioni. Questo passaggio dell’acqua (o in generale del solvente) avviene in modo spontaneo e possiede una spinta naturale che può essere paragonata ad una vera pressione: per questo viene chiamata Pressione osmotica.
Nella figura superiore vediamo un contenitore con al centro una membrana semipermeabile che permette il passaggio delle molecole d’acqua, ma non delle molecole dei soluti disciolti. L’acqua dalla soluzione di sinistra con meno soluto o senza soluto come nella figura passa nella soluzione di destra più ricca di soluto. L’acqua sta cercando di diluire la soluzione più concentrata per uniformare le due soluzioni. Questo passaggio dell’acqua (o in generale del solvente) avviene in modo spontaneo e possiede una spinta naturale che può essere paragonata ad una vera pressione: per questo viene chiamata Pressione osmotica.
 Consideriamo una soluzione di concentrazione pari a M che si trova ad una temperatura T (espressa in kelvin). La pressione osmotica Π rispetto al solvente puro è data dalla relazione:
Consideriamo una soluzione di concentrazione pari a M che si trova ad una temperatura T (espressa in kelvin). La pressione osmotica Π rispetto al solvente puro è data dalla relazione:
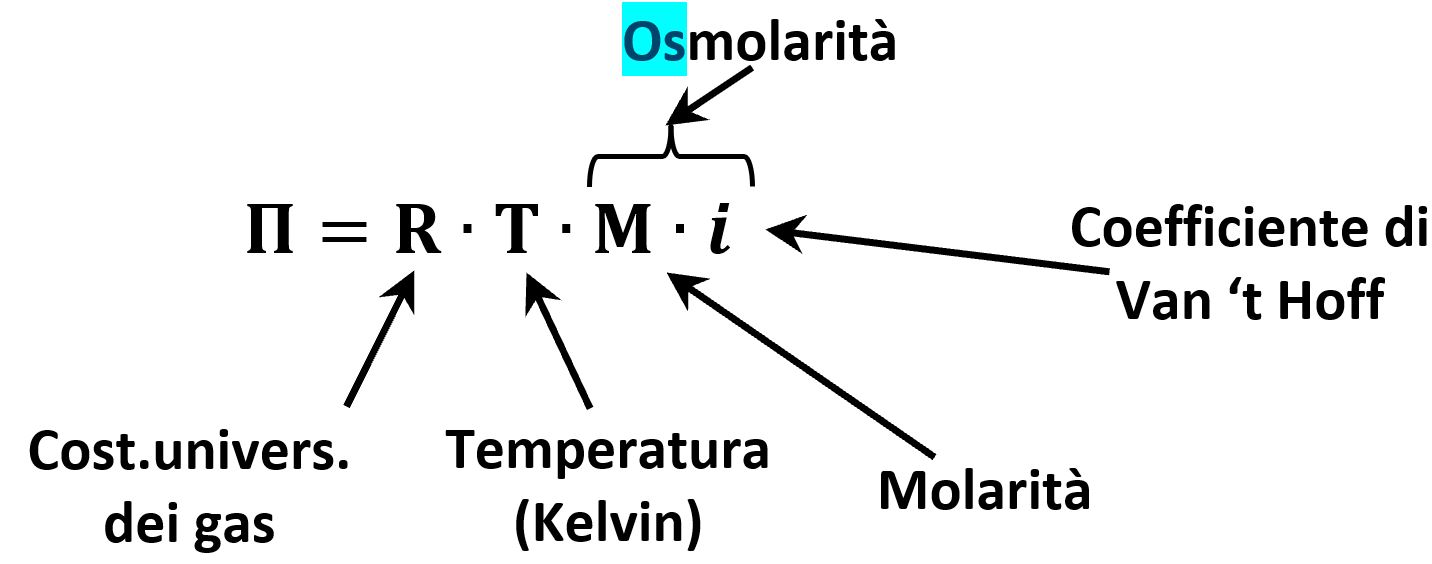
Nella formula isoliamo il termine M·i che chiamiamo osmolarità. Per capirne il significato immaginiamo una soluzione 1 Molare di NaCl che in acqua è dissociato in Na+ e Cl‒. Ai fini dell’osmosi abbiamo in un litro di soluzione una mode di Na+ e più una mole di Cl‒; in tutto due moli efficaci ai fini dei fenomeni di osmosi. Il numero di Van’t Hoff di NaCl vale appunto 2 e l’osmolarità sarà:
M·i = 1 · 2 = 2
Se in una soluzione sono presenti diverse sostanze, ai fini del calcolo della pressione osmotica si sommano tutte le osmolarità dei diversi soluti.
La pressione osmotica del sangue è dovuta principalmente ai sali in esso disciolti; la concentrazione molare delle proteine, a causa del loro alto peso molecolare, è talmente bassa che, sul totale di circa 7,63 atm (valore della pressione osmotica del sangue a 37° C), il contributo delle proteine è solo di circa 0,045 atm.
© il testo e le immagini sono di esclusiva proprietà dell’autore e sono sottoposti a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito


