1.4 Lo stato gassoso
1.4.1 Gas perfetti (o ideali)
Tutti i gas, indipendentemente dalla loro natura chimica, hanno un comportamento fisico simile per quanto riguarda le grandezze Pressione, Volume e Temperatura e spesso si comportano come un gas perfetto o ideale, cioè le molecole occupano tutte lo stesso volume indipendentemente dalla loro forma e massa molecolare.
In particolare quando un gas può essere assimilato ad un gas ideale vale la Legge dei gas perfetti che lega le grandezze fisiche P, V e T.
|
P⋅V = n⋅R⋅T |
P Pressione (Pa)
V Volume (m3) n numero di moli (mol) T Temperatura (Kelvin) |
R Costante universale dei gas
= 8,314 J/(mol·K) = 0,082 (Litri·atm)/(mol·K) |
Nelle condizioni ambientali del pianeta l’aria atmosferica si trova in condizioni da essere considerata un gas perfetto. Le molecole sono libere e viaggiano ad elevata velocità (ordine di grandezza nelle condizioni ambientali 1000 km/h ≈ 300 m/s). In generale Un gas reale può essere assimilato ad un gas perfetto in condizioni di sufficiente rarefazione tale da non far intervenire i fattori sterici (forma della molecola).
A livello microscopico tra le molecole di un gas agiscono forze di attrazione intermolecolare dette forze di Van der Waals o di dispersione o di London. Le molecole urtano tra di loro e contro le pareti. L’effetto macroscopico dell’urto contro le pareti provoca la pressione esercitata dal gas sulle superfici.
1.4.2 Le pressioni parziali
Quando un gas presente in un contenitore è costituito da diverse sostanze aeriformi, si può immaginare il contenitore con una sola sostanza alla volta e attribuire a tal sostanza una sua pressione parziale.
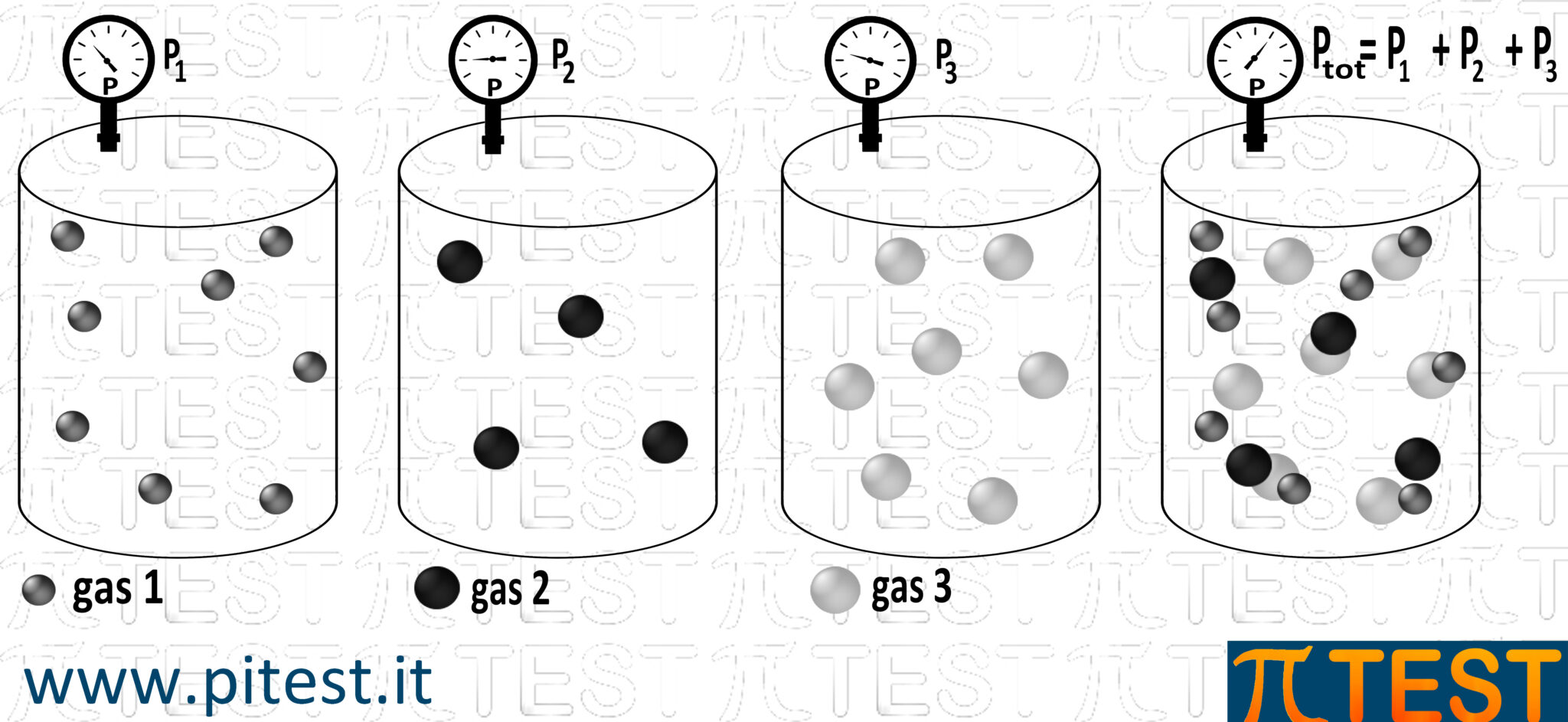
La pressione totale è la somma delle pressioni parziali di tutti i gas presenti:
Ptot=P1+P2+P3 + … + Pn
| ! | La pressione parziale è la pressione esercitata da ciascun gas in assenza degli altri. |
1.4.3 Il principio di Avogadro
All’inizio dell’800 il chimico Amedeo Avogadro espose il principio che prende il suo nome:
« Volumi uguali di gas diversi nelle stesse condizioni di temperatura e di pressione contengono lo stesso numero di molecole ».
Quando un gas è assimilabile ad un gas perfetto, per uno stesso numero di moli (1 mole corrisponde a 6,023·1023 elementi della specie in esame) il volume è lo stesso sia per gas monoatomici come i gas nobili, sia per i biatomici come H2 oppure O2, sia per i triatomici come H2O o CO2 o anche più complessi. Il volume non dipende quindi né dalla struttura molecolare né dalla massa molecolare.
Se applichiamo la legge dei gas perfetti ricaviamo il volume di una mole di gas in condizioni standard, cioè alla pressione di 1atm e alla temperatura di 0°C (273K):
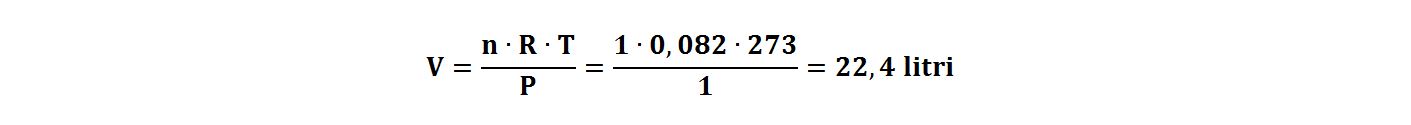
| Nei quiz è possibile che per definire la quantità in moli di una sostanza allo stato gassoso venga fornito il suo volume come multipli o sottomultipli di 22,4 litri. | 5,6 litri | 1/4 = 0,25 moli |
| 11,2 litri | 1/2 = 0,5 moli | |
| 22,4 litri | 1 mole | |
| 44,8 litri | 2 moli | |
| 67,2 litri | 3 moli |
QUIZ sullo stato gassoso |
|||
|---|---|---|---|
© il testo è di esclusiva proprietà dell’autore ed è sottoposto a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito


