10.8 CARBOIDRATI
Nella famiglia dei carboidrati troviamo molecole ternarie (composte da carbonio, idrogeno e ossigeno) che hanno la generica formula Cn(H2O)n ovvero CnH2nOn. Per ciascun atomo di carbonio sono presenti idrogeno e ossigeno secondo un rapporto 2:1 come nell’acqua. Potremmo pensare che per ogni atomo di carbonio sono presenti idrogeno e ossigeno nelle stesse quantità di una molecola d’acqua.
Lungo una catena carboniosa la generica unità che compone un carboidrato è rappresentabile come in figura:
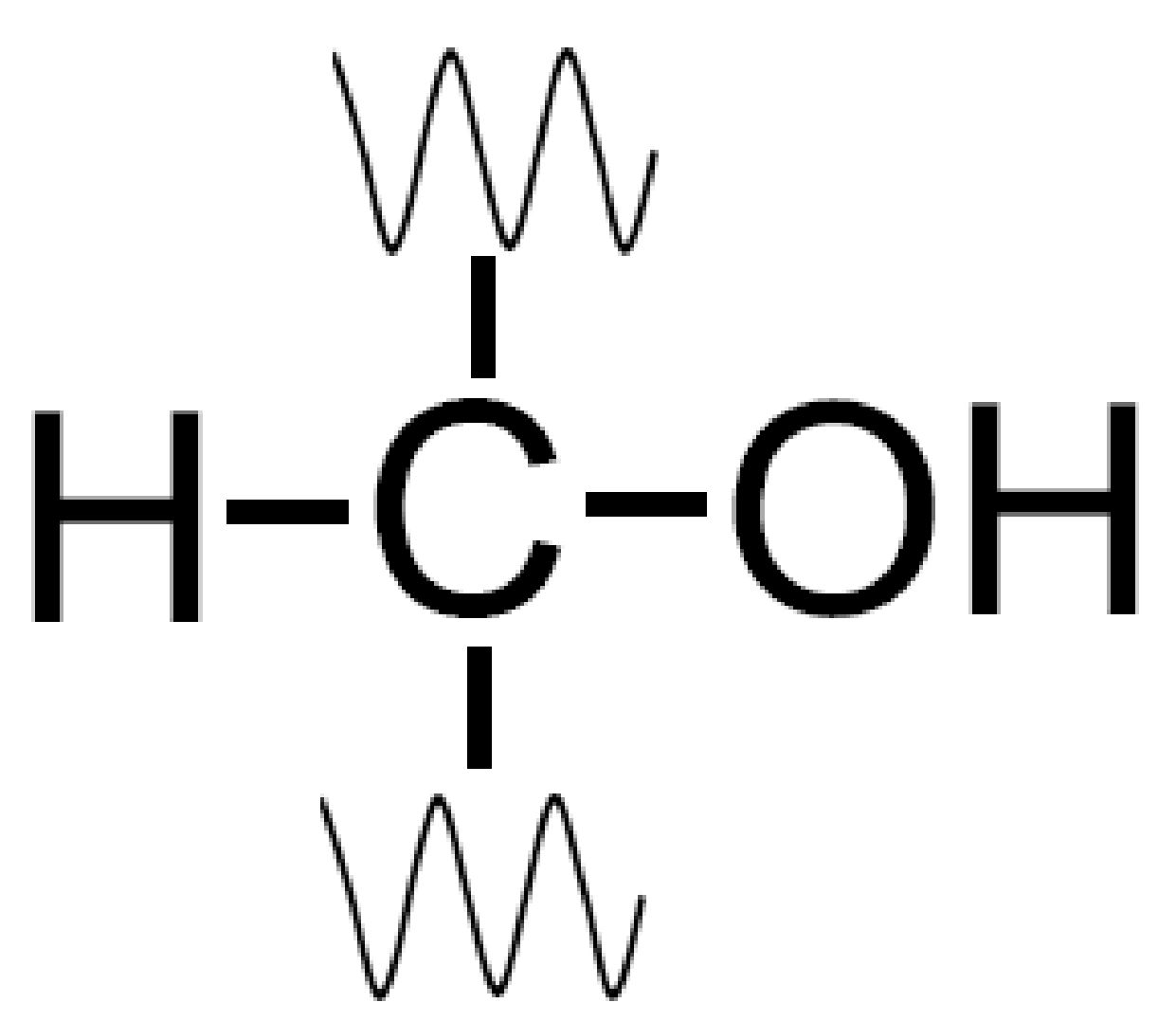
Per rispettare il rapporto Cn(H2O)n che definisce un carboidrato, è presente lungo la catena carboniosa anche un gruppo carbonilico, come vedremo fra breve.
ZUCCHERI
Gli zuccheri appartengono alla famiglia dei carboidrati. Sono classificati come monosaccaridi o polisaccaridi (catene di monosaccaridi)
10.8.1 MONOSACCARIDI
Detti anche zuccheri semplici, sono carboidrati con 5 o 6 atomi di carbonio. Vengono distinti in pentosi ed esosi (rispettivamente con 5 e 6 atomi di carbonio). Lungo la catena uno degli atomi di carbonio costituisce un carbonile. Se il carbonile è uno atomo di carbonio di testa della catena, allora il monosaccaride è detto aldoso perché la struttura è quella di una aldeide. Se invece il carbonio del carbonile è centrale nella catena, allora il monosaccaride è detto chetoso perché la struttura è quella di un chetone.
La presenza di numerosi gruppi −OH, convolti nei legami intermolecolari a ponte idrogeno anche con l’acqua, rendono queste molecole perfettamente solubili in acqua.
|
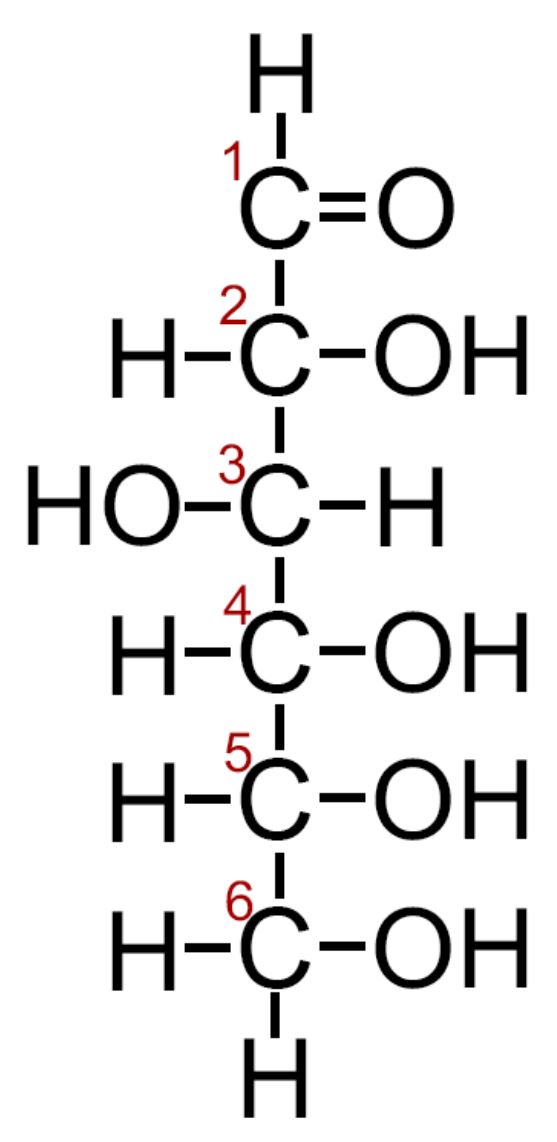
Il Glucosio è un monosaccaride aldoesoso: esoso con sei atomi di carbonio; aldoso con il carbonile in C1 che forma una aldeide. È la molecola più diffusa in natura, principale prodotto della fotosintesi e combustibile della respirazione cellulare. Negli atomi di carbonio C2, C3, C4 e C5 sono presenti strutture chirali (vedi). Presenta due forme tra loro enantiomere D e L. È la forma destrogira D-glucosio quella più diffusa in natura, detta anche Destrosio; l’altro enantiomero L-glucosio è detto anche Levulosio. |
|
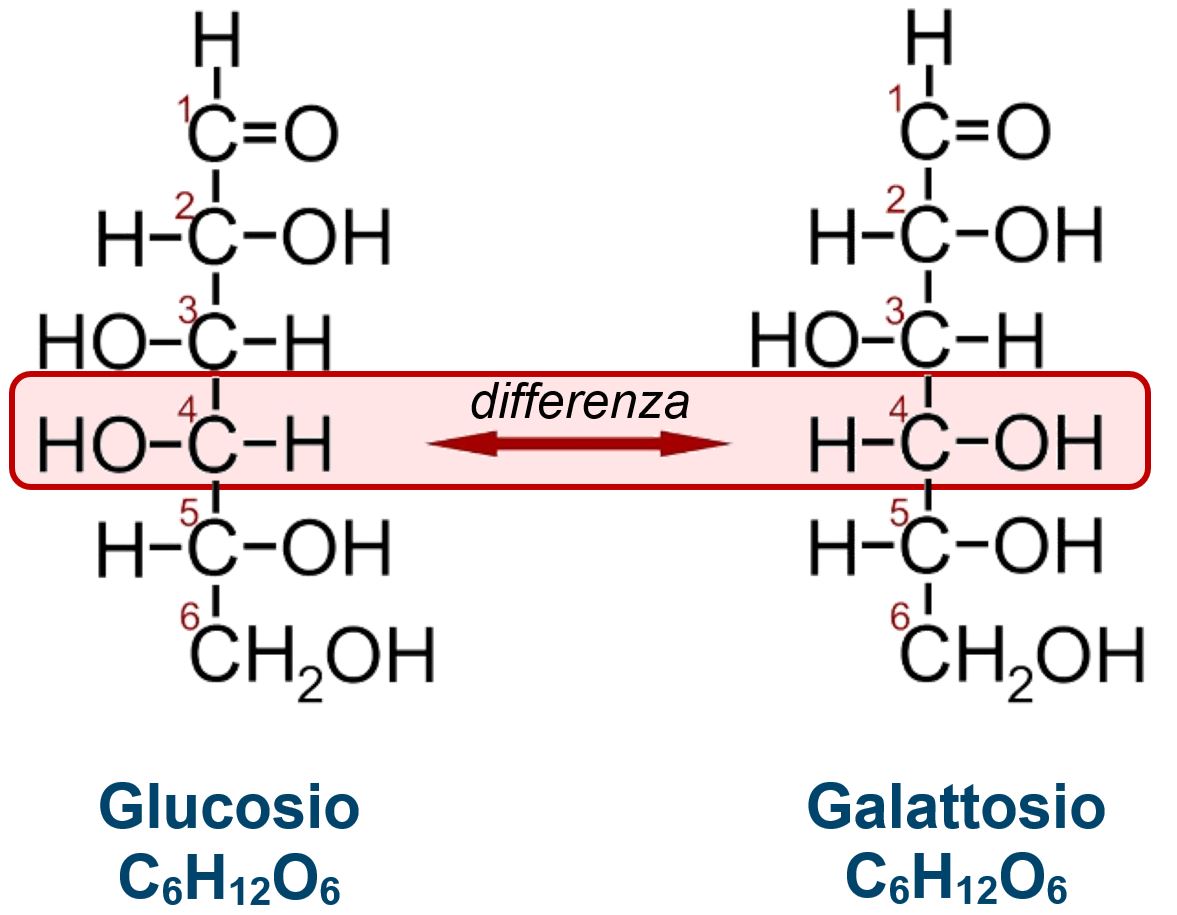
GLUCOSIO E GALATTOSIO
|
Due monosaccaridi entrambi esosi (sei atomi di carbonio) e aldosi (il carbonio C1 è un carbonile e conferisce la natura di aldeide) Sono EPIMERI Differiscono solo per la conformazione del carbonio chirale C4 Sono EPIMERI, cioè stereoisomeri con differente configurazione su un solo carbonio Nota: i carboni C2, C3, C4 e C5 sono tutti chirali con proprietà ottiche |
|
GLUCOSIO E FRUTTOSIO
|
Sono isomeri Differiscono solo per la posizione del carbonile Due monosaccaridi entrambi esosi (sei atomi di carbonio) Il Glucosio è aldoso (il carbonile in C1 conferisce la natura di aldeide) Il Fruttosio è chetoso (il carbonile in C2 conferisce la natura di chetone) |
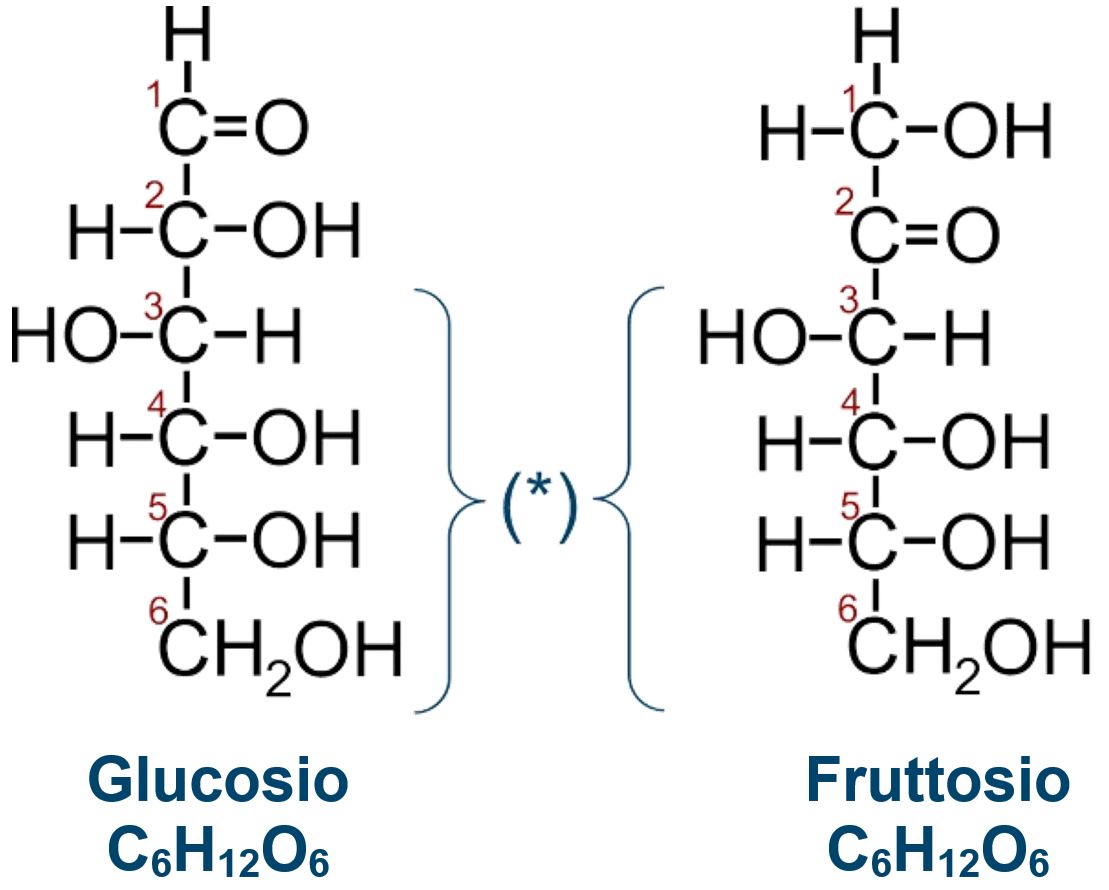 |
La parte indicata in figura con (*) dei carboni da C3 a C6 è identica nei due zuccheri. Glucosio e Fruttosio possono trasformarsi uno nell’altro con un processo detto TAUTOMERIA.
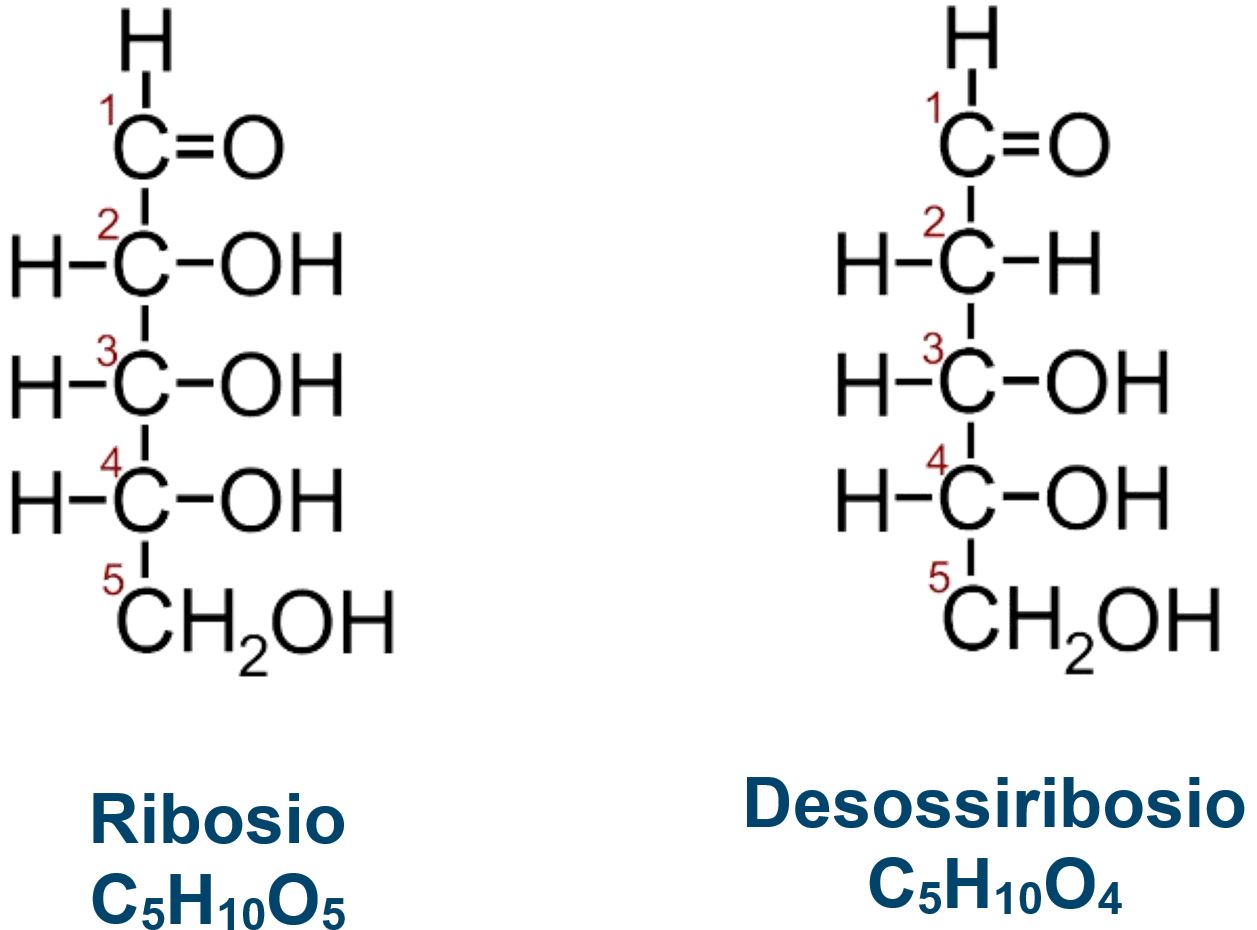
RIBOSIO E DESOSSIRIBOSIO
Il Ribosio è un monosaccaride
Il Desossiribosio (o deossiribosio) differisce per l’assenza dell’ossidrile nel carbonio C2. Sono monosaccaridi importanti in quanto molecole costitutive di acidi nucleici (RNA e DNA) ed altre molecole a base nucleotidica. |
|
CONFIGURAZIONE CICLICA
I monosaccaridi pentosi ed esosi oltre alla configurazione lineare (aperta) vista qui sopra, assumono anche una configurazione ciclica. Avviene una reazione reversibile tra l’ossigeno del carbonile che rompe il doppio legame e si lega con il penultimo carbonio con eliminazione di una molecola d’acqua. I monosaccaridi esosi assumono la configurazione esagonale (piranosi); i monosaccaridi pentosi assumono la configurazione pentagonale (furanosi). È sempre presente un atomo di ossigeno in una delle posizioni dell’anello.
Nel formare la struttura ciclica, si viene a formare, in una parte della struttura, un emiacetale (1). Per questo la forma ciclica del monosaccaride è detta anche forma emiacetalica.
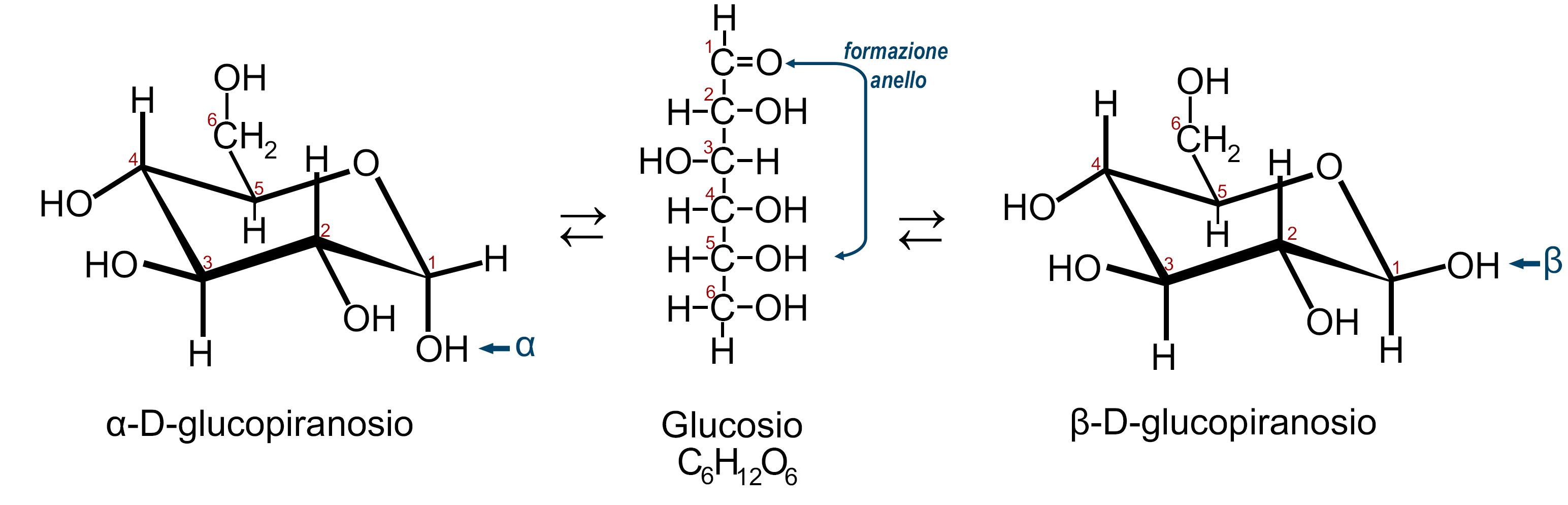
Il D-glucosio in forma aldeidica aperta è in equilibrio con la forma ciclica detta glucopiranosio.
Il glucopiranosio può avere due diverse configurazioni a seconda che il gruppo −OH del carbonio C1 di trovi sul piano superiore o su quello inferiore (piano dell’anello). Le due configurazioni sono dette alfa e beta: α-D-glucopiranosio e β-D-glucopiranosio. I due isomeri sono detti Anomeri. Ciascuno dei due anomeri è in equilibrio con la forma aldeidica a catena aperta; per questo motivo i due anomeri possono trasformarsi l’uno nell’altro passando appunto dalla forma aperta (fenomeno della mutarotazione)
Nota (1): emiacetale: è così chiamata una struttura organica che deriva dalla addizione di un alcol con un carbonile (aldeidico o chetonico). Questa struttura si forma nella ciclizzazione di un monosaccaride quando il carbonile interagisce con il gruppo −OH presente su un altro atomo di carbonio dello stesso monosaccaride.
POTERE RIDUCENTE
Quando uno zucchero possiede un’aldeide o un chetone, questi svolgono un potere riducente (vedi). Il carbonile aldeidico degli aldosi può ossidarsi formando un carbossile e, come tutte le sostanze che si ossidano, è un agente riducente. La forma chetonica per tautomeria può trasformarsi in quella aldeidica (da chetosi ad aldosi) come abbiamo visto avvenire tra glucosio e fruttosio. E per questo motivo anche i chetosi hanno potere riducente.
Ai fini della preparazione ai test di ammissione non approfondiamo ulteriormente questo tema, ma semplicemente osserviamo che tutti i monosaccaridi hanno potere riducente.
10.8.2 POLISACCARIDI
Una caratteristica degli zuccheri è la formazione di catene polimeriche di monosaccaridi che formano così i polisaccaridi unendosi per condensazione con eliminazione di una molecola di acqua con un legame detto glicosidico nel quale due gruppi ossidrilici −OH si uniscono con eliminazione di una molecola d’acqua.
DISACCARIDI
SACCAROSIO
Il saccarosio è il disaccaride costituito dalla condensazione di glucosio e fruttosio, più precisamente di α-D-glucopiranosio e β-D-fruttofuranosio.
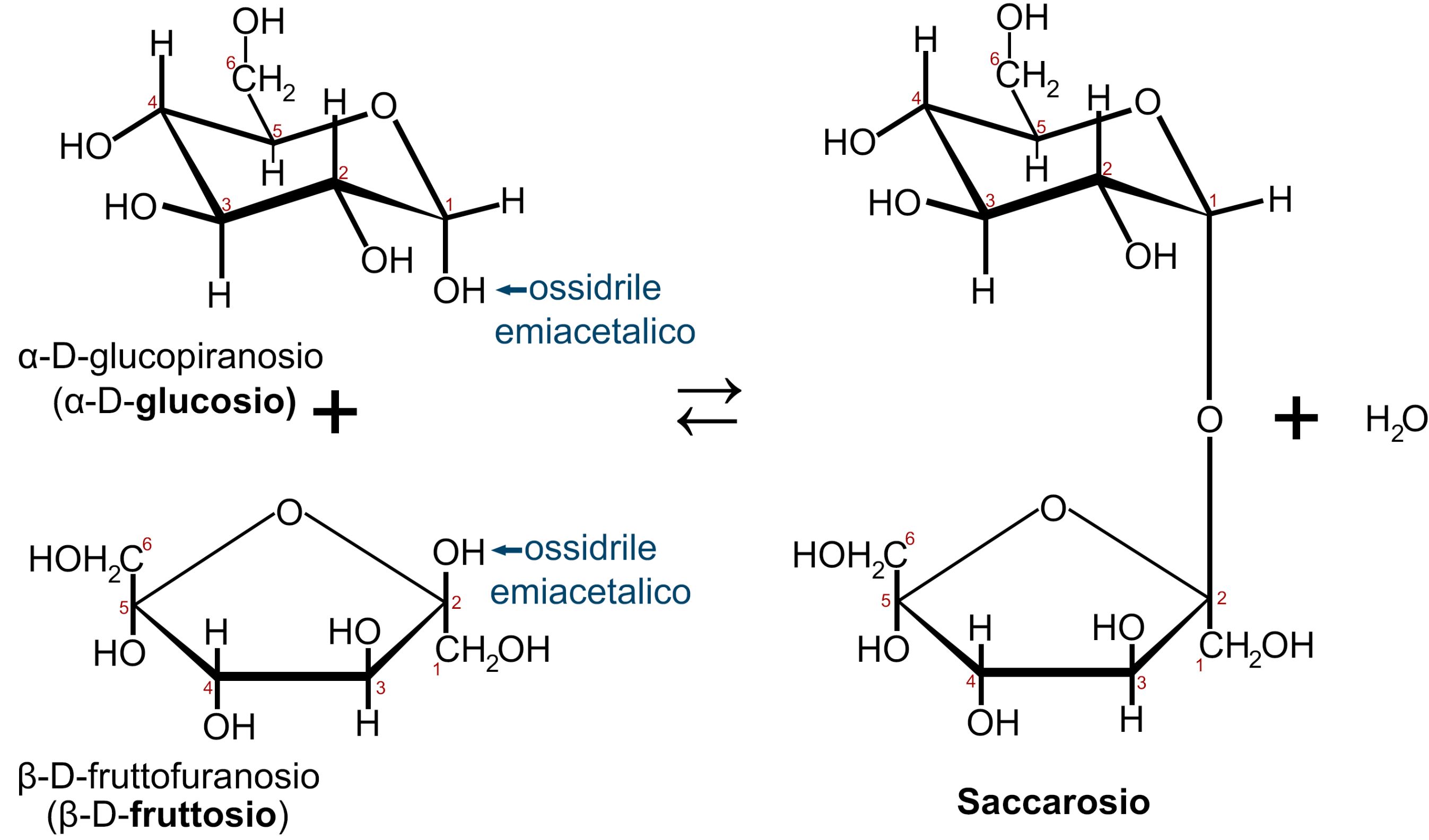
Questo legame glicosidico tra glucosio e fruttosio avviene tra il carbonio 1 del glucosio e il carbonio 2 del fruttosio, legame detto anche 1-2 α,β diglicosidico. I due gruppi ossidrilici −OH interessati nel legame appartengono ai due carboni anomerici (estremità riducenti) e ne deriva che il saccarosio NON è uno zucchero riducente.
MALTOSIO
Il maltosio è il disaccaride costituito dalla condensazione di due molecole di glucosio.
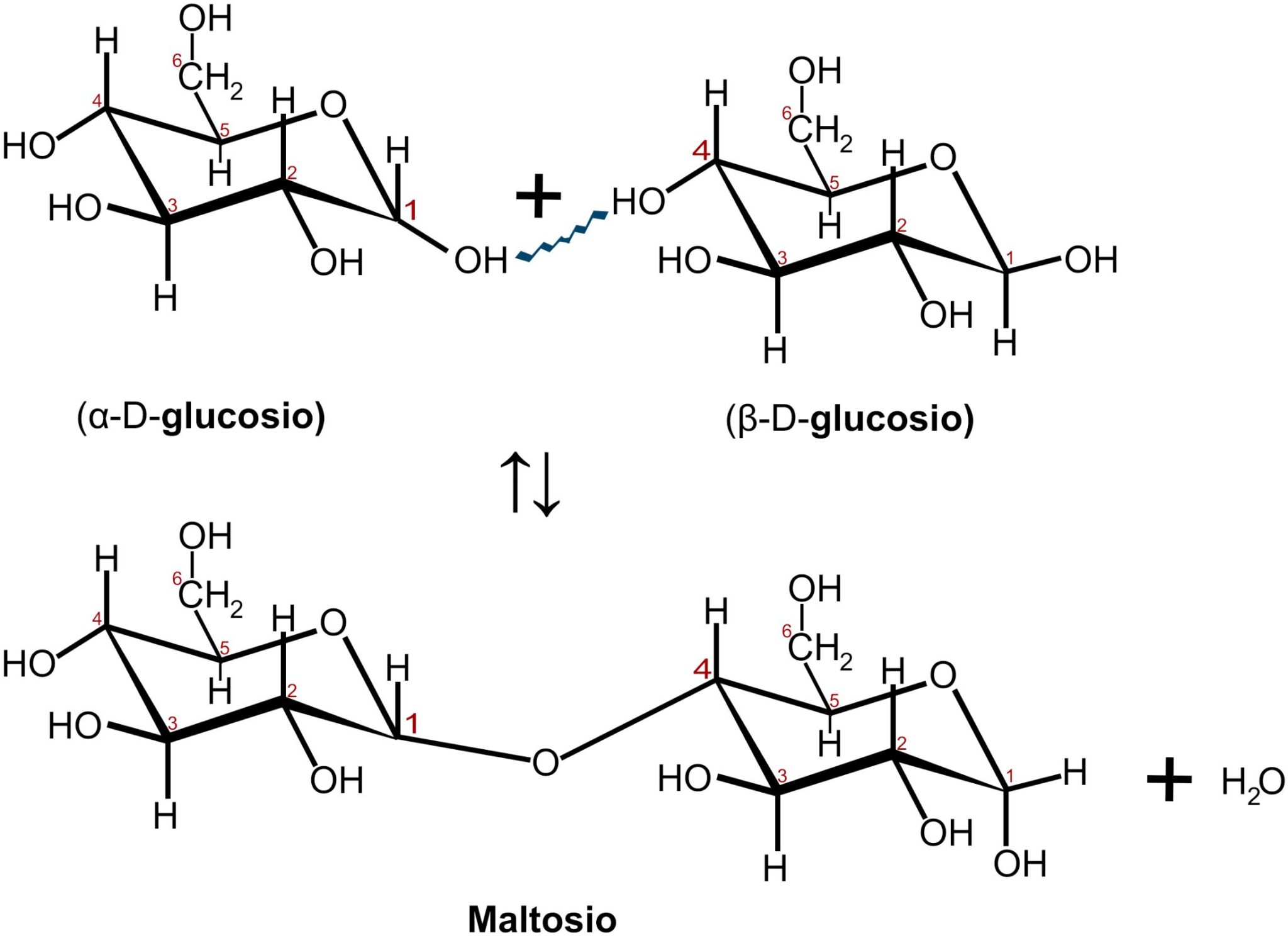
Questo legame glicosidico avviene tra il carbonio 1 di una molecola di glucosio e il carbonio 4 dell’altra molecola di glucosio, legame detto anche α 1,4 glicosidico. Dei due gruppi ossidrilici −OH interessati solo il primo appartiene ad un carbonio anomerico; la seconda molecola di glucosio può aprirsi a formare una catena aperta presentando il gruppo aldeidico con il suo potere riducente. Per questo motivo il maltosio è uno zucchero riducente.
LATTOSIO
Il lattosio è il disaccaride costituito dalla condensazione di una molecola di galattosio con una di glucosio con eliminazione di una molecola d’acqua.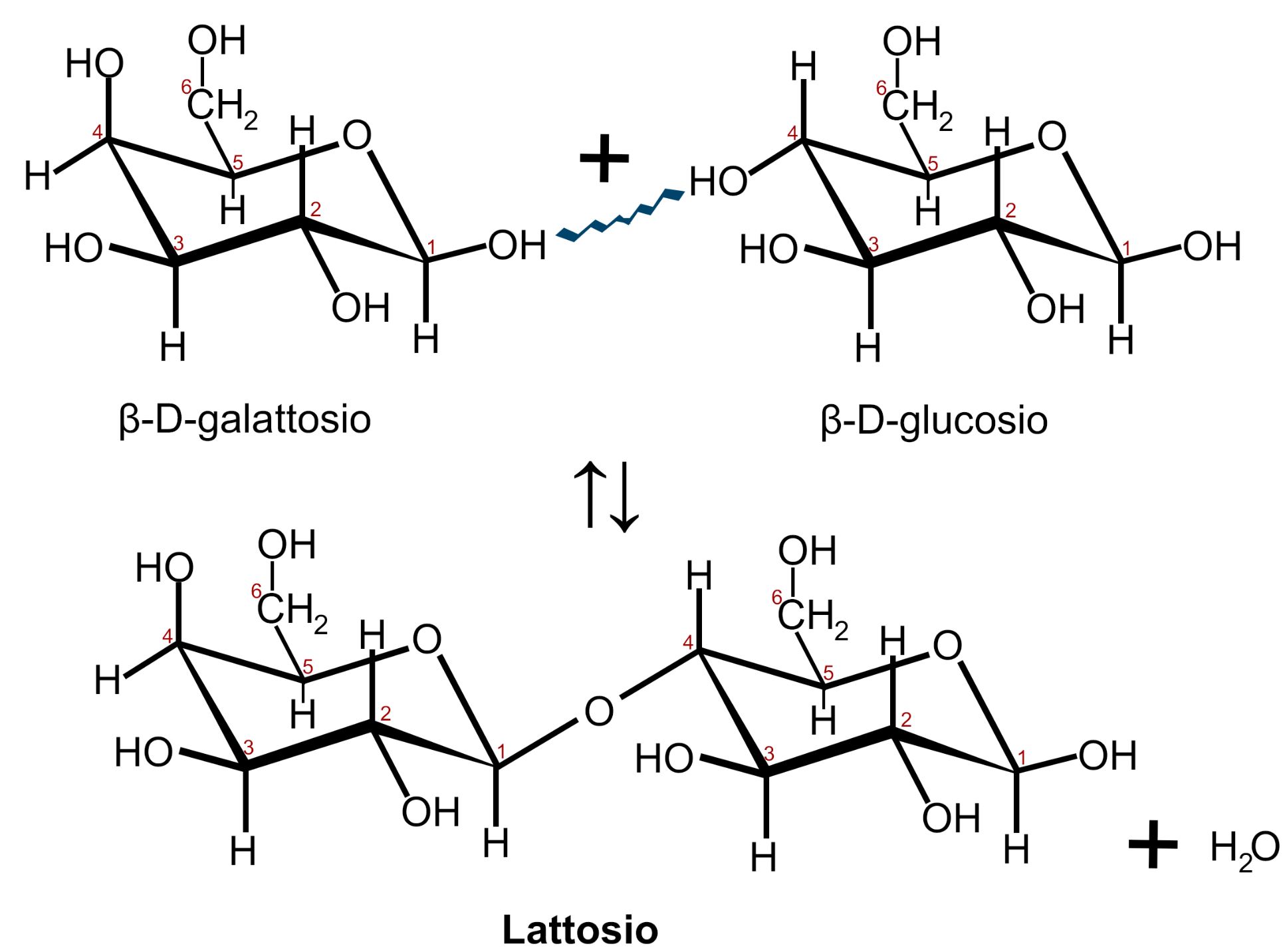
Questo legame glicosidico avviene tra il carbonio 1 di una molecola di β-D-galattosio e il carbonio 4 dell’altra molecola di glucosio, legame detto anche β 1,4 glicosidico. Dei due gruppi ossidrilici −OH interessati solo il primo appartiene ad un carbonio anomerico; la molecola di glucosio può aprirsi a formare una catena aperta presentando il gruppo aldeidico con il suo potere riducente. Per questo motivo il Lattosio è uno zucchero riducente.
CELLOBIOSIO
Il Cellobiosio è il disaccaride costituito dalla condensazione di due molecole di β-D-glucosio (o più specificamente β-D-glucopiranosio).
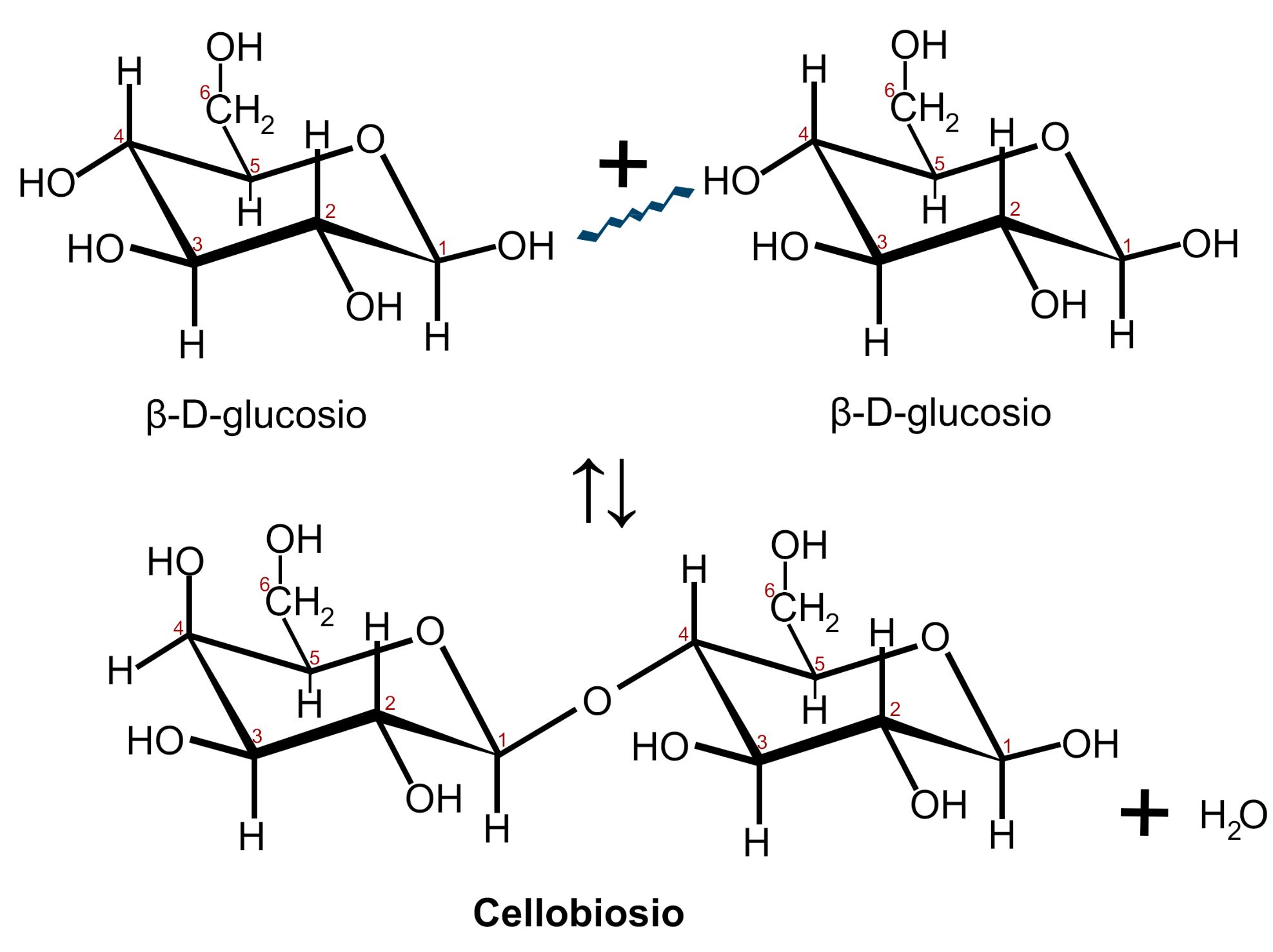
Questo legame glicosidico avviene tra il carbonio 1 di una molecola di β-D-glucosio e il carbonio 4 dell’altra molecola di β-D-glucosio, legame detto anche β 1,4 glicosidico. Dei due gruppi ossidrilici −OH interessati solo il primo appartiene ad un carbonio anomerico; la molecola di glucosio può aprirsi a formare una catena aperta presentando il gruppo aldeidico con il suo potere riducente. Per questo motivo il maltosio è uno zucchero riducente.
L’uomo non possiede enzimi in grado di scindere il legame β 1,4 glicosidico del cellobiosio.
10.8.1 POLISACCARIDI
I polisaccaridi sono i polimeri dei monosaccaridi.
Sono carboidrati complessi con funzioni strutturali e di riserva energetica.
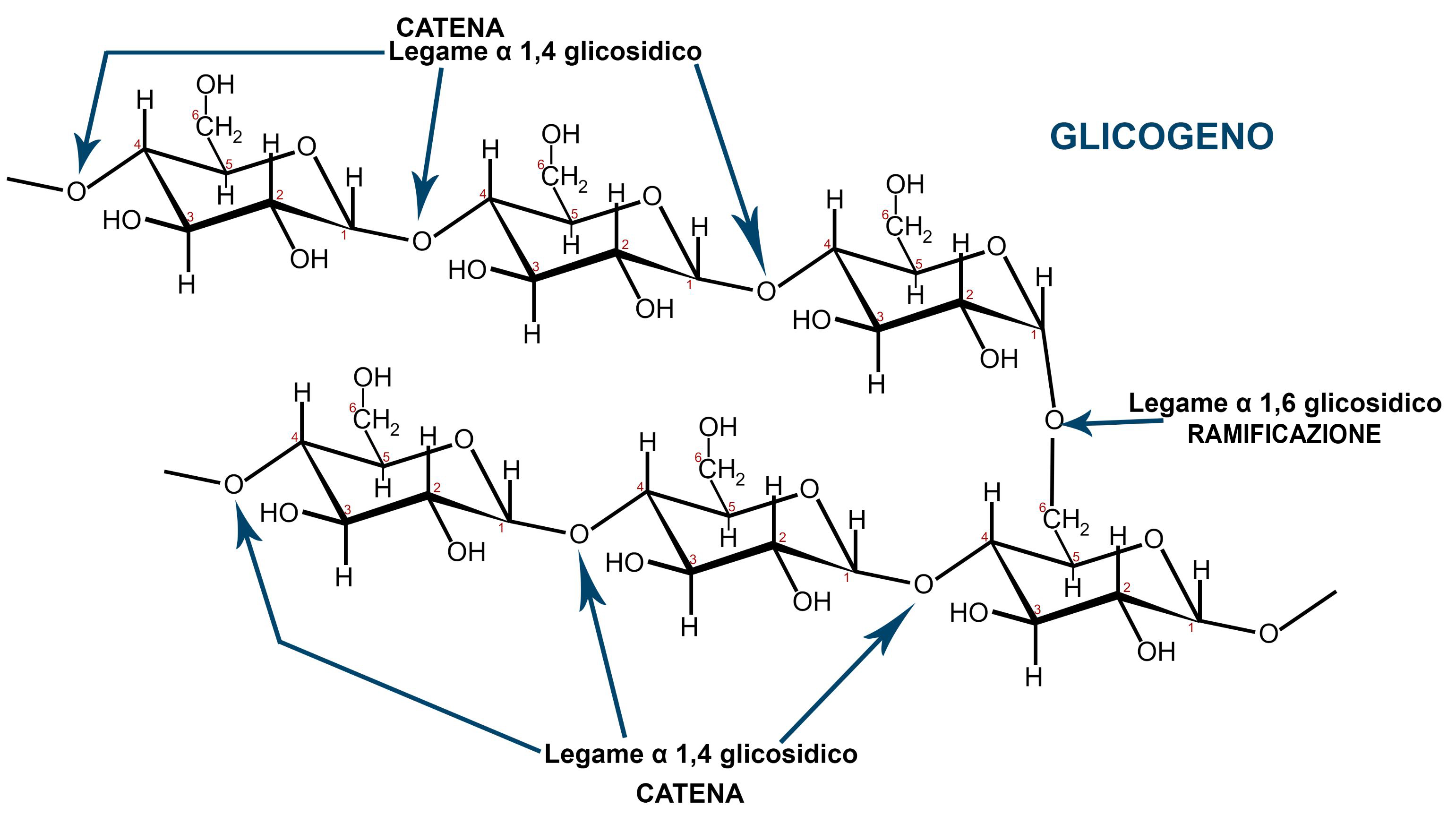
L’AMIDO è la forma in cui il glucosio è immagazzinato nelle piante, deriva dall’unione di due diversi polimeri del glucosio: amilosio, molecola lineare in cui il legame è sempre α 1,4 glicosidico, e amilopectina, in cui sono presenti anche legami α 1,6 glicosidici, che rendono la molecola ramificata.
La CELLULOSA, polimero lineare del β-glucosio, è un polisaccaride con funzione strutturale contenuto nelle piante.
È la molecola organica più abbondante sul pianeta.
Il GLICOGENO, presente nel nostro corpo, soprattutto nel fegato ed in minor misura nei muscoli, ha struttura ramificata simile a quella dell’amilopectina (uno dei due componenti dell’amido). È presente in generale negli animali e nei funghi, con funzione di riserva energetica.
Anche la CHITINA, polimero di un derivato azotato del glucosio, è un polisaccaride ed è presente in alcuni animali [esoscheletro degli artropodi] e nei funghi [ne compone la parete cellulare], come molecola strutturale.
© il testo è di esclusiva proprietà dell’autore ed è sottoposto a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito
CONTINUA LO STUDIO DELLA CHIMICA ORGANICA
10.1 Idrocarburi
10.2 Idrocarburi alifatici
10.2.1 Idrocarburi alifatici saturi: gli ALCANI
10.2.2 Radicali alchilici
10.2.3 Idrocarburi ramificati
10.2.4 Proprietà fisiche e chimiche degli alcani
10.2.5 Idrocarburi insaturi: ALCHENI
10.2.6 Proprietà fisiche e chimiche degli alcheni
10.2.7 Idrocarburi insaturi: ALCHINI
10.2.8 Proprietà fisiche e chimiche degli alchini
10.2.9 POLIENI
10.2.10 CICLOALCANI, CICLOALCHENI E COCLOALCHINI
10.2.11 Composti ETEROCICLICI SATURI
10.3 Gli isomeri
10.3.1 Isomeri COSTITUZIONALI DI CATENA
10.3.2 Isomeri COSTITUZIONALI DI POSIZIONE
10.3.3 Isomeri COSTITUZIONALI DI FUNZIONE
10.3.4 Stereoisomeri CONFORMAZIONALI
10.3.5 Stereoisomeri CONFIGURAZIONALI GEOMETRICI
10.3.6 Stereoisomeri CONFIGURAZIONALI OTTICI
10.4 IDROCARBURI AROMATICI
10.4.1 BENZENE
10.4.2 I PRINCIPALI COMPOSTI AROMATICI DERIVANTI DAL BENZENE ‒ ARENI
10.4.3 IDROCARBURI POLICICLICI AROMATICI
10.4.4 COMPOSTI ETEROCICLICI INSATURI
10.5 ADDIZIONE E SOSTITUZIONE ELETTROFILA
10.5.1 ADDIZIONE ELETTROFILA
10.5.2 SOSTITUZIONE ELETTROFILA
10.6 GRUPPI FUNZIONALI
10.6.1 ALOGENURI ALCHILICI E ARILICI
10.6.3 ALCOLI
10.6.4 Proprietà fisiche e chimiche e preparazione degli ALCOL
10.6.5 POLIALCOLI (POLIOLI)
10.6.6 ETERI
10.6.7 CARBONILE – ALDEIDI E CHETONI
10.6.8 CARBOSSILE – ACIDI ORGANICI
10.6.9 ANIDRIDI
10.6.10 ESTERI
10.6.11 LIVELLI DI OSSIDAZIONE DELLE MOLECOLE ORGANICHE
10.6.12 SAPONIFICAZIONE
10.6.13 FOSFOLIPIDI
10.6.14 LIPIDI O GRASSI
10.6.15 AMMINE
10.6.16 AMMIDI
10.6.17 AMMINOACIDI – PROTEINE
10.7 POLIMERI
10.8 CARBOIDRATI