9.3 Definizione di acido e base
Nel precedente paragrafo abbiamo visto che in una soluzione acida sono presenti più ioni idronio H3O+ rispetto agli ioni ossidrile OH‒; viceversa in una soluzione basica sono presenti più ioni ossidrile. Partendo da questa osservazione il chimico Svante Arrhenius nel 1884 diede la seguente definizione di acido e di base.
Acido e base secondo Arrhennius
- un acido è una sostanza in grado di liberare ioni idrogeno H+ in una soluzione acquosa;
- una base è una sostanza in grado di liberare ioni idrossido OH‒ in una soluzione acquosa.
Un classico esempio di acido secondo Arrhenius è l’acido cloridrico HCl che in acqua libera H+:
HCl → H+ + Cl‒
La scrittura più corretta di questa reazione sarebbe:
HCl +H2O→ H3O+ + Cl‒
Un classico esempio di base secondo Arrhenius è l’idrossido di sodio NaOH che in acqua libera OH‒:
NaOH → Na+ + OH‒
Questa definizione così semplice ed immediata non trovava riscontro per sostanze basiche (dette anche alcaline) come l’ammoniaca che in soluzione acquosa rende l’acqua basica. L’ammoniaca NH3 infatti si lega allo ione H+ con legame dativo o di coordinazione, formando lo ione ammonio NH4+.
H+ + :NH3 ⇆ NH4+
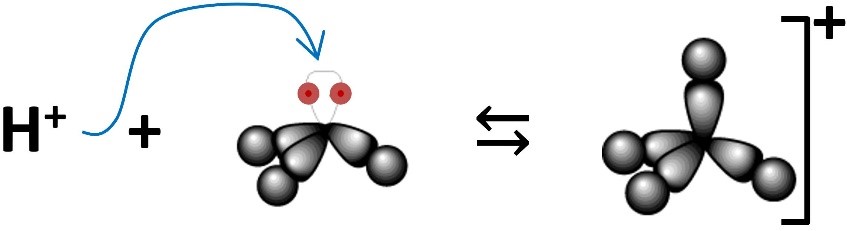 Questa reazione complessivamente può essere vista come
Questa reazione complessivamente può essere vista come
NH3 + H2O ⇆ NH4+ + OH‒
In questa ultima scrittura della reazione la molecola d’acqua sci scinde in H+ e OH‒; lo ione H+ viene “catturato” dall’ammoniaca con legame dativo e lo ione OH‒ rimane in soluzione rendendola basica.
È nata così la nuova definizione di acido e di base data da Brønsted e Lowry:
Acido e base secondo Brønsted e Lowry
-
un acido è una sostanza in grado di donare protoni ad un’altra detta base;
-
una base è una sostanza in grado di accettare protoni da un’altra detta acido.
L’acido non è tale se non in presenza di una controparte cui cedere il proprio ione H+
La base non è tale se non in presenza di una controparte da cui accettare lo ione H+
Secondo questa teoria non esistono quindi acidi e basi a sé stanti.
Se studiamo il comportamento di una base, alla base che ha accettato un H+ si associa la nuova sostanza che possiede un comportamento acido, che chiamiamo acido coniugato della base.
Se studiamo il comportamento di un acido, all’acido che ha ceduto un H+ si associa la nuova sostanza che possiede un comportamento basico che chiamiamo base coniugata dell’acido.
Vediamo, come esempio, l’ammoniaca (base) che reagisce con l’acqua (gioca il ruolo di acido) e l’acido nitrico (acido) che reagisce con l’acqua (gioca il ruolo di base):
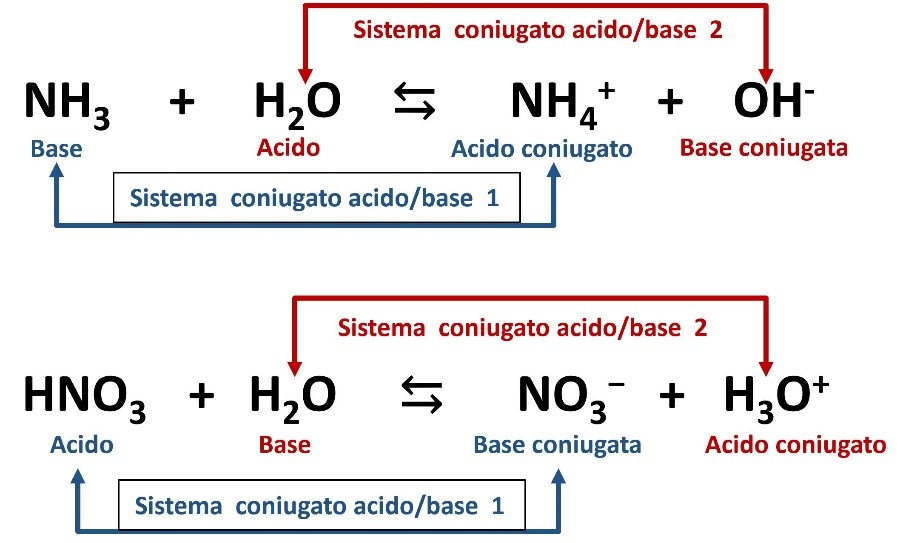
Alcune sostanze, come l’acqua, hanno la caratteristica di potersi comportare sia da acido che da base a seconda della situazione e sono dette anfotere o anfoliti.
Nelle due reazioni riportare sopra vediamo appunto l’acqua che si comporta da acido nei confronti dell’ammoniaca NH3 e si comporta da base nei confronti dell’acido nitrico HNO3.
Altre sostanze anfotere sono gli ioni di deprotonazione non totale di acidi poliprotici. Le vedremo più avanti.
Oltre alla definizione di acido e di base secondo Brᴓnsted e Lowry, esiste anche la definizione data da Lewis.
Acido e base secondo Lewis
un acido è una sostanza in grado di accedttare una coppia di elettroni;
una base è una sostanza in grado di donare una coppia di elettroni
Vediamo la basicità dell’ammoniaca dal punto di vista di Brønsted e di Lewis.
| Ammoniaca basica secondo Brønsted e Lowry | |
| L’ammoniaca che mostra il suo comportamento basico secondo Brønsted accettando un H+. |  |
| Ammoniaca basica secondo Lewis | |
| L’ammoniaca mostra il suo comportamento basico secondo Lewis cedendo un doppietto elettronico. | 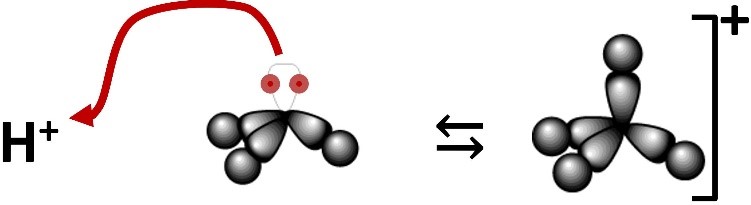 |
La definizione di acido e di base secondo Lewis è stata introdotta per poter classificare come acidi e basi sostanze che non possiedono idrogeno ma che reagiscono con uno scambio di una coppia di elettroni come la reazione tra ammoniaca NH3 e fluoruro di boro BF3 che reagiscono come in figura.
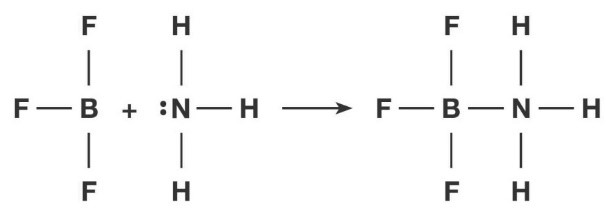 |
L’ammoniaca, comportandosi da base, dona il suo doppietto libero al fluoruro di boro che si comporta da acido.
|
Confronto tra le diverse definizioni |
||
| Acido | Base | |
| Arrhenius | Libera ioni H+ | Libera ioni OH− |
| Brᴓnsted e Lowry | Cede protoni | Accetta protoni |
| Lewis | Accetta coppia di e− | Cede coppia di e− |
© il testo e le immagini sono di esclusiva proprietà dell’autore e sono sottoposti a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito
© il testo e le immagini sono di esclusiva proprietà dell’autore e sono sottoposti a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito
9.1 Autoprotolisi
9.2 Soluzioni acide e basiche – pH
9.3 Definizione di acido e base
9.4 Acidi mono e poli-protici
9.5 Costante di equilibrio di acidi e basici
9.6 Acidi e basi forti e deboli
9.7 Rapporto tra Ka e Kb
9.8 Acidi e basi FORTI in soluzione
9.9 Diluizioni di acidi e basi forti in soluzione
9.10 Acidi e basi DEBOLI in soluzione
9.11 Neutralizzazione
9.12 Sali neutri, acidi e basici
9.13 Tamponi


