4.6 Strutture di risonanza
Capita spesso che per una stessa molecola ci sia più di una possibile struttura molecolare. In queste uno o più doppi legami si trovano in posizioni diverse.
4.6.1 Ozono O3
Ad esempio nell’ozono O3 (molecola che studieremo anche nel prossimo capitolo) sono possibili due diverse strutture che chiamiamo strutture limite di risonanza.
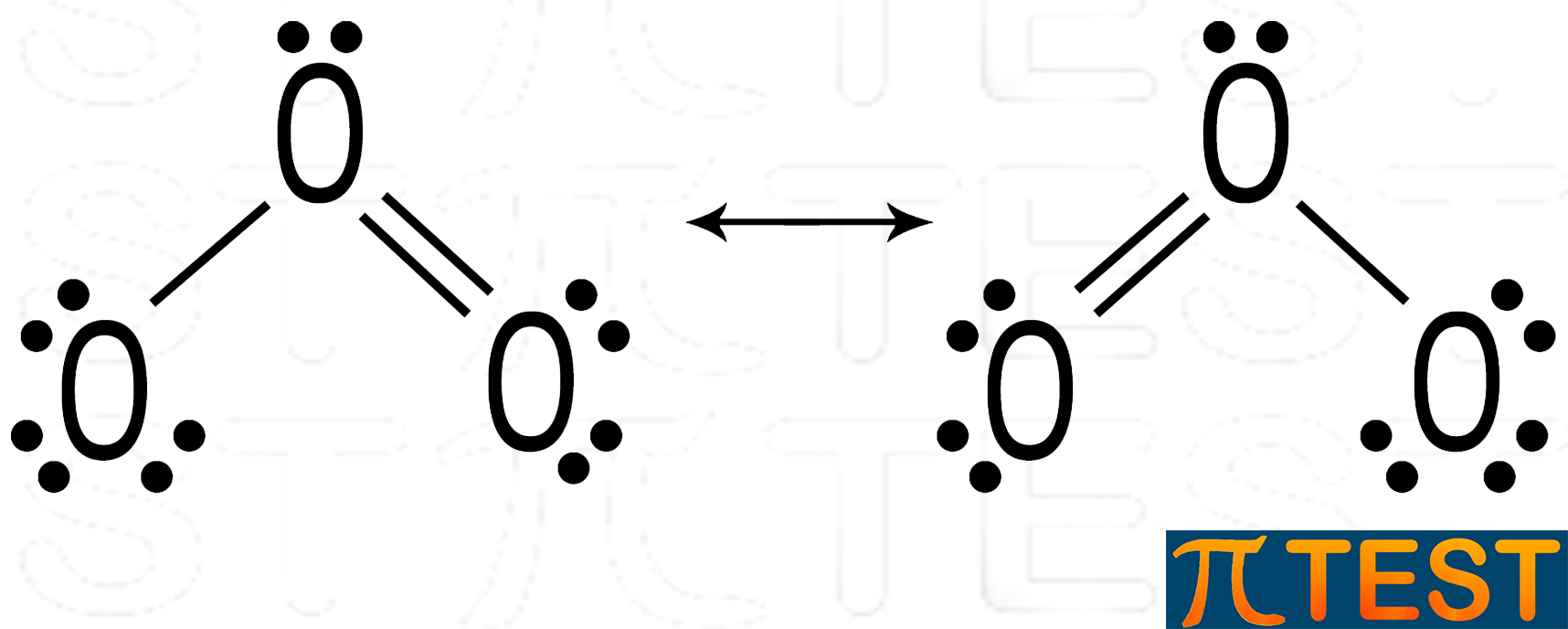
Vediamo in figura che il doppio legame tra due atomi di ossigeno può trovarsi sia nel legame a destra che in quello a sinistra. In realtà la molecola si trova sia nell’una che nell’altra forma. Si potrebbe pensare che le due forme limite si alternano nel tempo, ma in realtà coesistono in una situazione nella quale non ci sono un doppio ed un singolo legame tra gli atomi di ossigeno, ma c’è un legame e mezzo da entrambe le parti. Il legame π si dice che è delocalizzato, questo significa che non si trova in un luogo specifico ma sta in entrambe le parti. Questo tipo di struttura viene detta ibrido di risonanza.
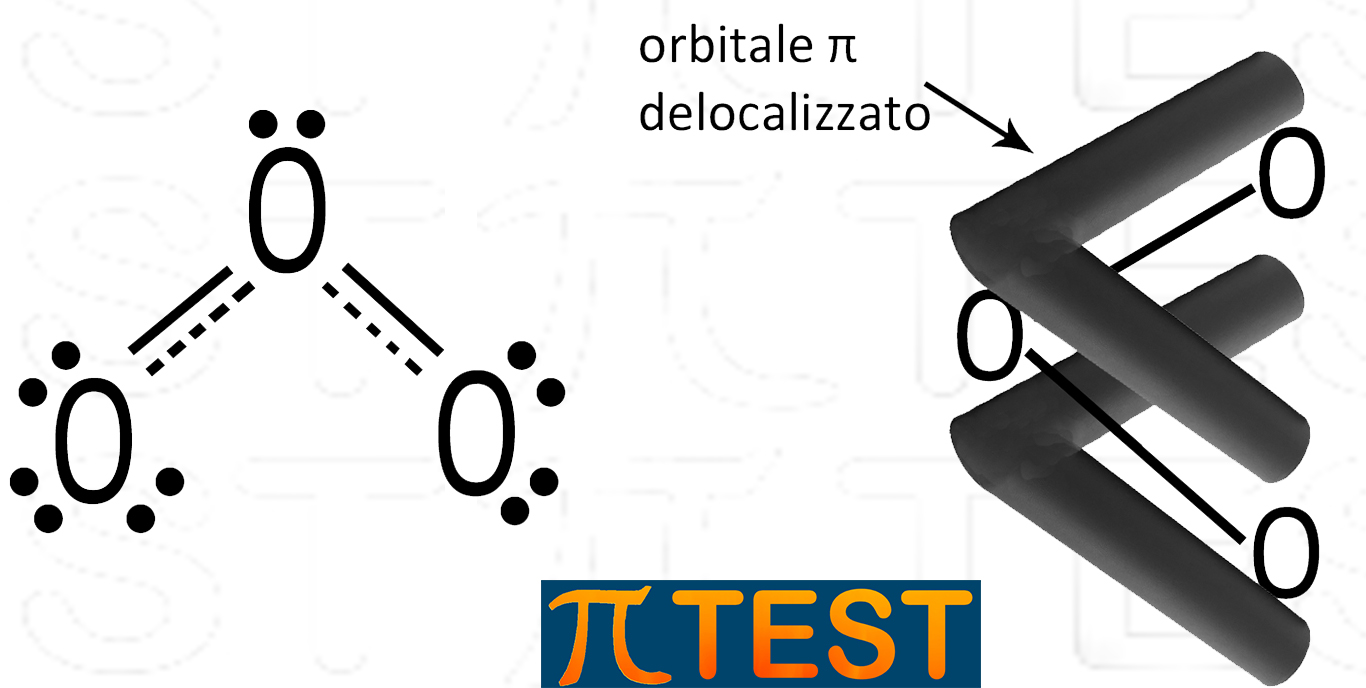
| Si ha risonanza (o mesomeria) quando più formule, dette formule limite, concorrono a definire la vera struttura di una molecola.
La molecola non oscilla tra le diverse strutture di Lewis (dette strutture limiti di risonanza): l’ibrido di risonanza è una miscela di strutture allo stesso modo in cui un mulo lo è del cavallo e dell’asino. |
4.6.2 Benzene C6H6
Un’altra molecola importante da conoscere è quella del benzene C6H6.
Il benzene è una molecola costituita da sei atomi di carbonio disposti ad esagono su un piano (geometria esagonale piana). Ciascun atomo di carbonio ha una ibridazione sp2 e forma un doppio legame con un altro atomo di carbonio. Si vede in figura che esistono due strutture limite di risonanza nelle quali i doppi legami si trovano tra atomi di carbonio diversi.
In realtà il benzene possiede un unico legame π delocalizzato a forma di doppio anello. Come vedremo nello studio della chimica organica, il benzene spesso si rappresenta con un esagono circoscritto ad un cerchio.
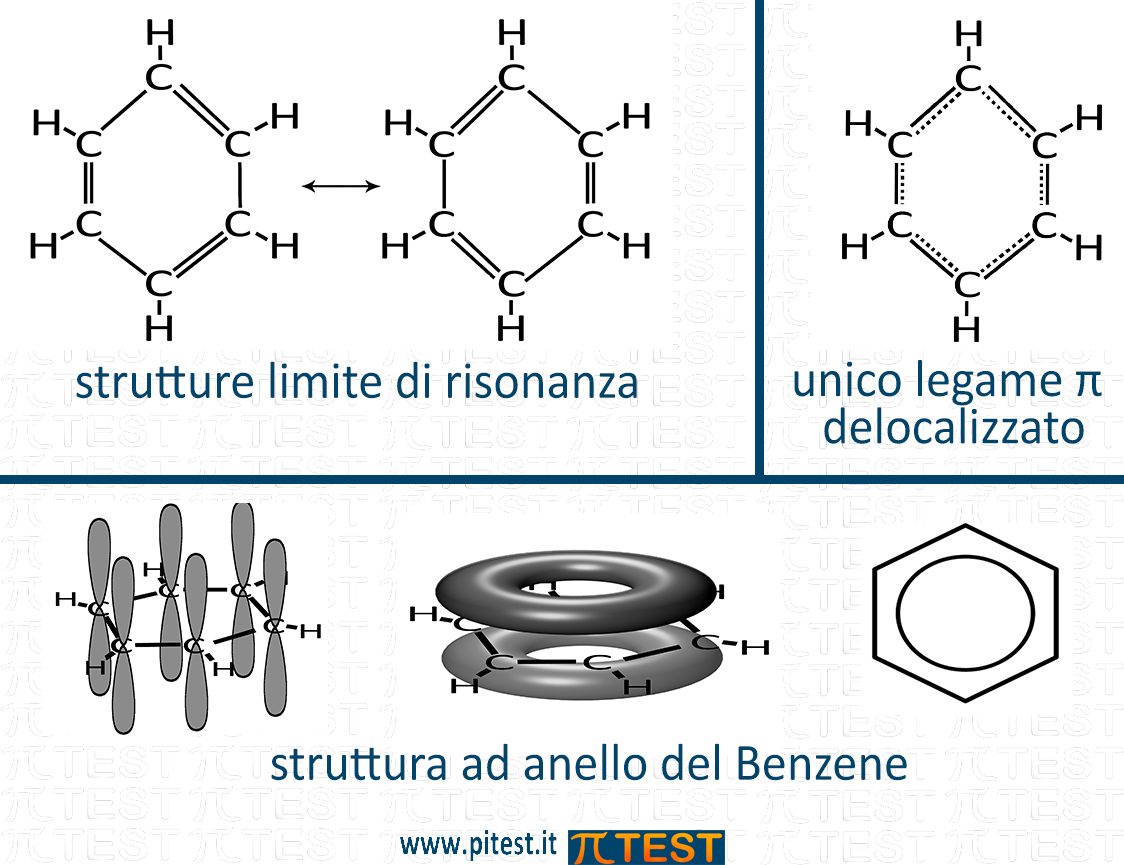
I sei orbitali p dei sei atomi di carbonio si fondono in un unico legame π delocalizzato che coinvolge tutti gli atomi di carbonio.
4.6.3 Altre strutture ibride di risonanza
Sono numerose le strutture che presentano ibridi di risonanza. Oltre all’ozono e al benzene ne vediamo qualcun’altra.
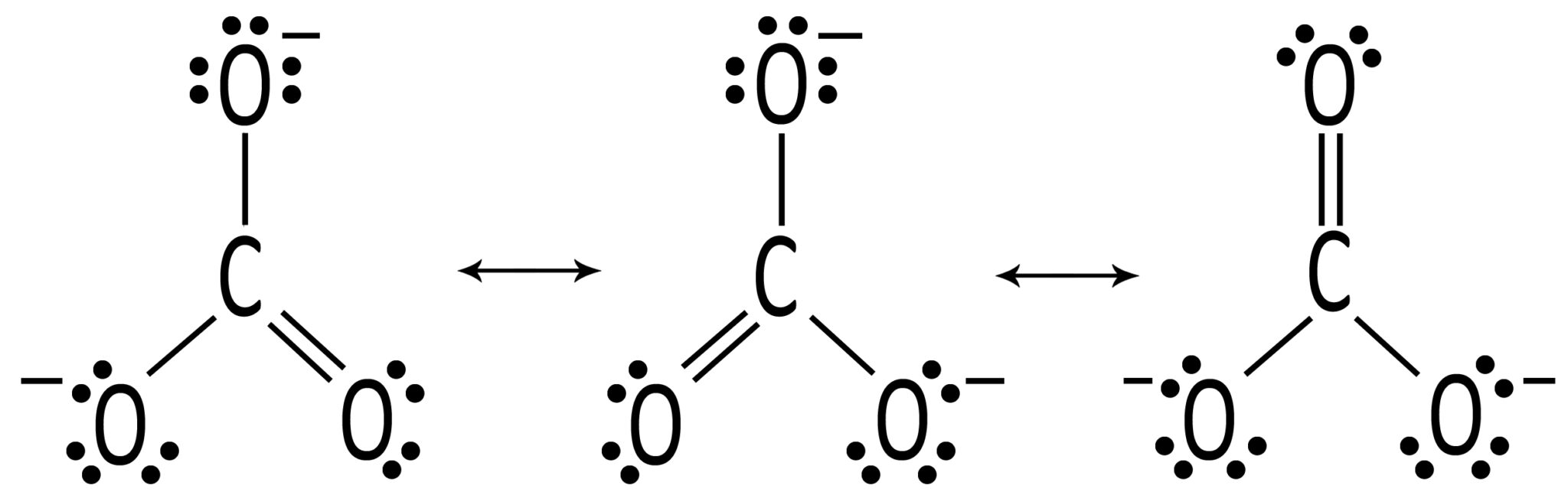
CO3= ione carbonato Presenta tre forme limite di risonanza |
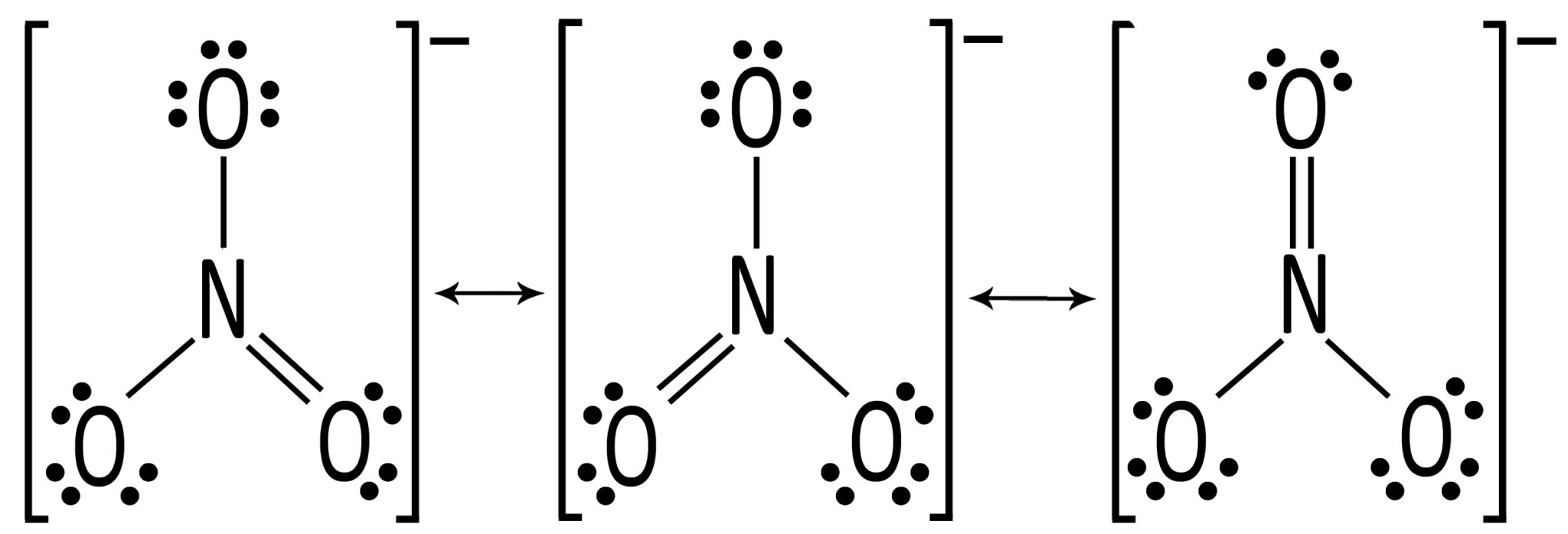
NO3– ione nitratato Presenta tre forme limite di risonanza |
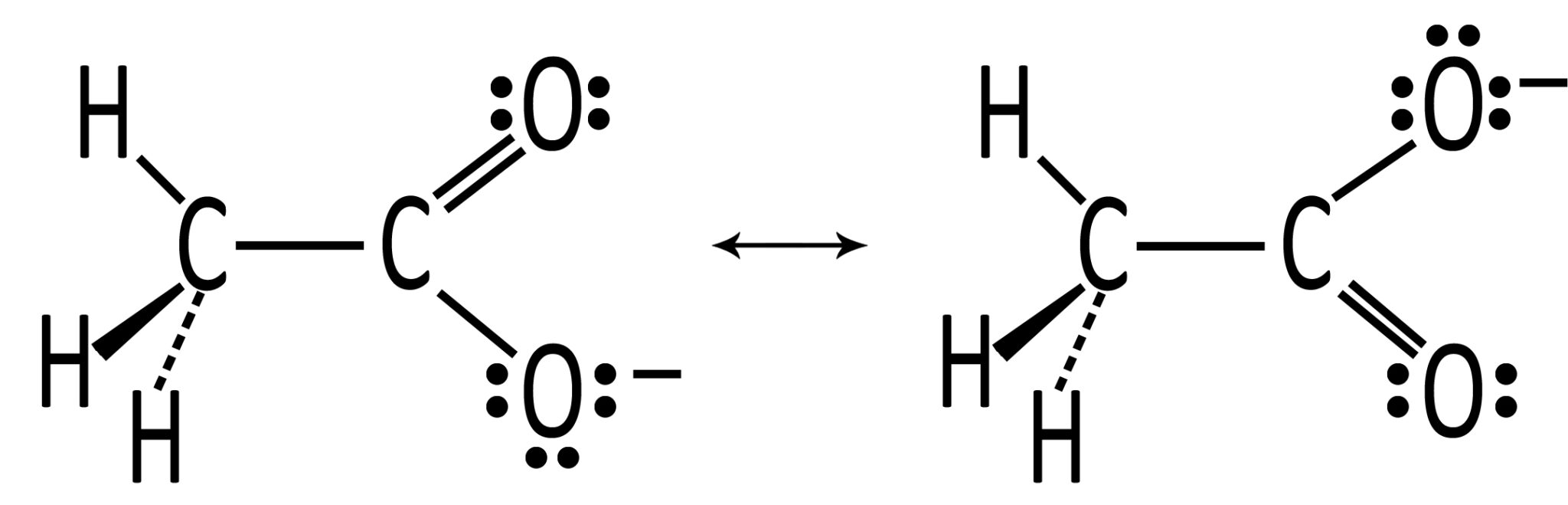
CH3COO– ione acetato Presenta due forme limite di risonanza |
© il testo è di esclusiva proprietà dell’autore ed è sottoposto a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito


