Visualizza questo post su Instagram
3.2 Ordine di riempimento degli orbitali e configurazione elettronica
3.2.1 principio dell’Aufbau
Studiamo gli elementi iniziando dal primo, l’idrogeno H, e andiamo avanti facendo crescere il numero atomico.
Seguiamo così il principio dell’Aufbau (=costruire in tedesco) in base al quale si possono “costruire“ gli atomi in forma progressiva all’aumentare del numero degli elettroni collocandoli in base al principio di minima energia.
|
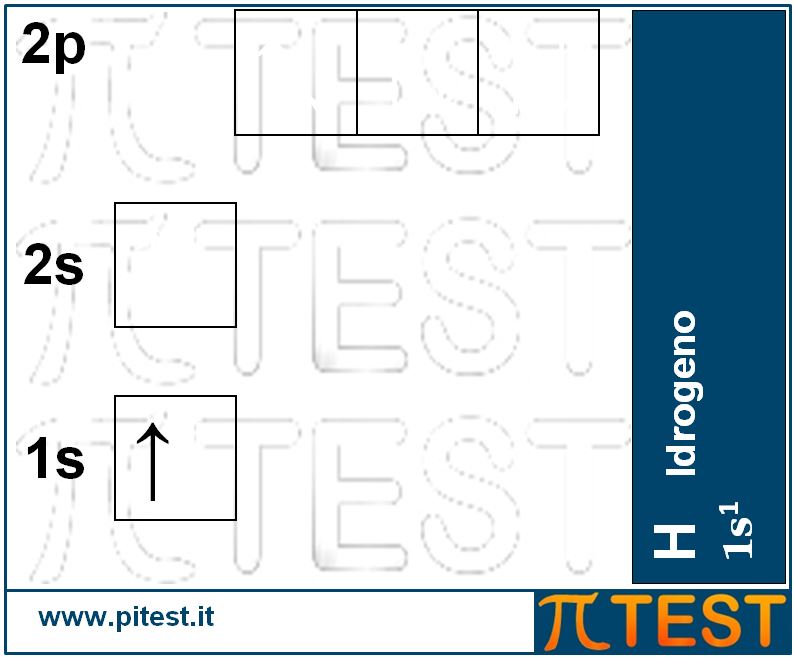
Consideriamo il primo elemento chimico, l’idrogeno H, che possiede un solo protone e di conseguenza un solo elettrone che si andrà a collocare nell’orbitale con minor energia, l’orbitale 1s. Diremo che la configurazione elettronica dell’idrogeno è 1s1. L’apice “1” sta ad indicare la presenza di un elettrone nell’orbitale 1s. Possiamo anche rappresentare graficamente la configurazione elettronica dell’idrogeno come nella figura seguente.
|
|
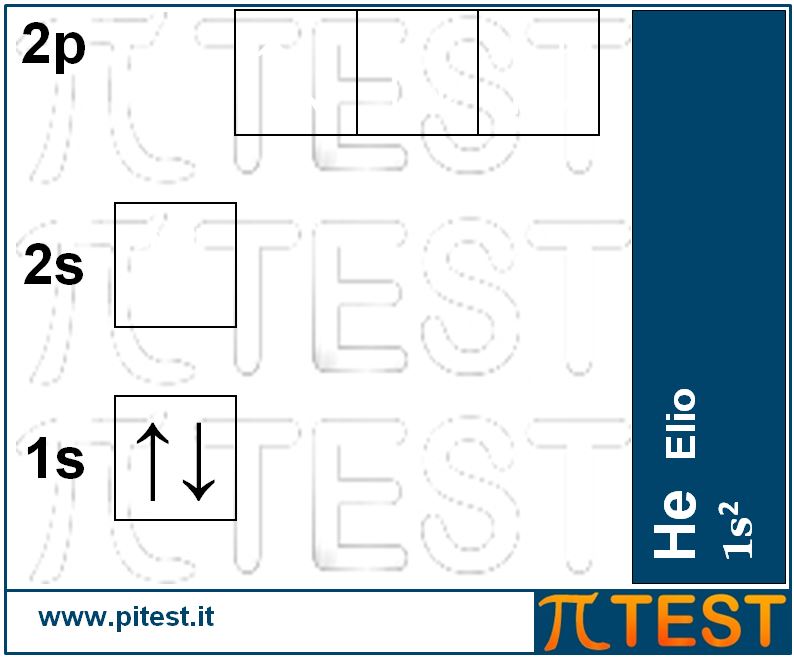
Consideriamo ora il secondo elemento chimico, l’elio He, che possiede nel nucleo due protoni e due neutroni e di conseguenza due elettroni che si andranno a collocare nell’orbitale con minor energia, l’orbitale 1s. Diremo che la configurazione elettronica dell’idrogeno è 1s2. L’apice “2” sta ad indicare la presenza di due elettroni nell’orbitale 1s. Consideriamo anche la rappresentazione grafica dell’elio. Le due frecce rappresentano i due elettroni ed hanno la punta orientata in verso opposto per ricordare che i due elettroni hanno un opposto senso di rotazione o spin. Si dice che l’elio ha il “duetto” pieno. Per duetto intendiamo i due elettroni presenti nel primo ed unico guscio elettronico dell’elio. Tale saturazione conferisce una caratteristica di NON reattività chimica. L’elio si presenta così in natura sotto forma di gas monoatomico.
|
|
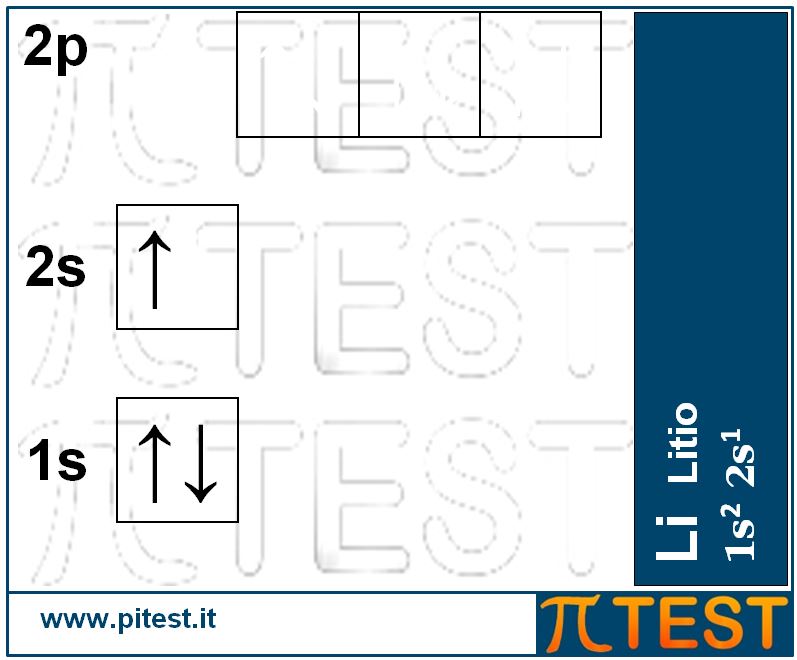
Il terzo elemento chimico, il litio Li, possiede tre elettroni. I primi due completano il primo livello energetico riempendo l’orbitale 1s; il terzo elettrone andrà a collocarsi al secondo livello nell’orbitale 2s. La configurazione elettronica è 1s22s1.
|
|
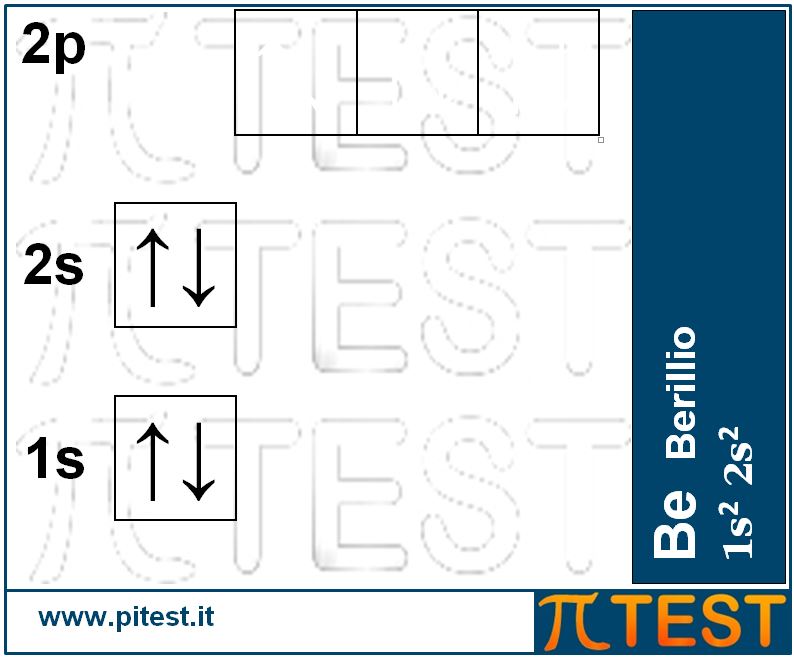
Il quarto elemento chimico, il berillio Be, possiede quattro elettroni. I primi due completano il primo livello energetico riempendo l’orbitale 1s; gli altri due elettroni andranno a collocarsi al secondo livello nell’orbitale 2s. La configurazione elettronica è 1s22s2.
|
|
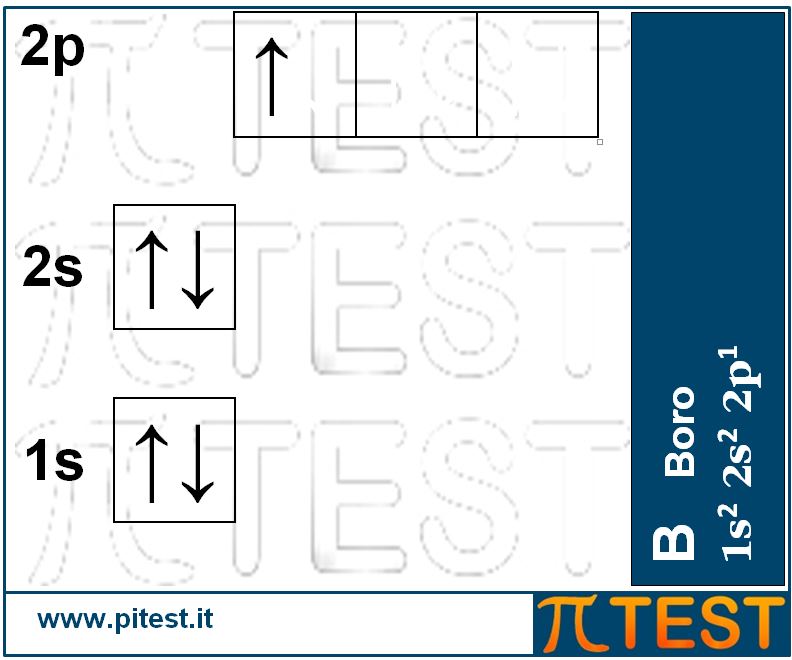
Il quinto elemento chimico, il boro B, possiede cinque elettroni. I primi due completano il primo livello energetico riempendo l’orbitale 1s; dei tre elettroni rimanenti due andranno a collocarsi al secondo livello nell’orbitale 2s e l’ultimo si collocherà in uno dei tre orbitali 2p. La configurazione elettronica è 1s22s22p1.
|
|
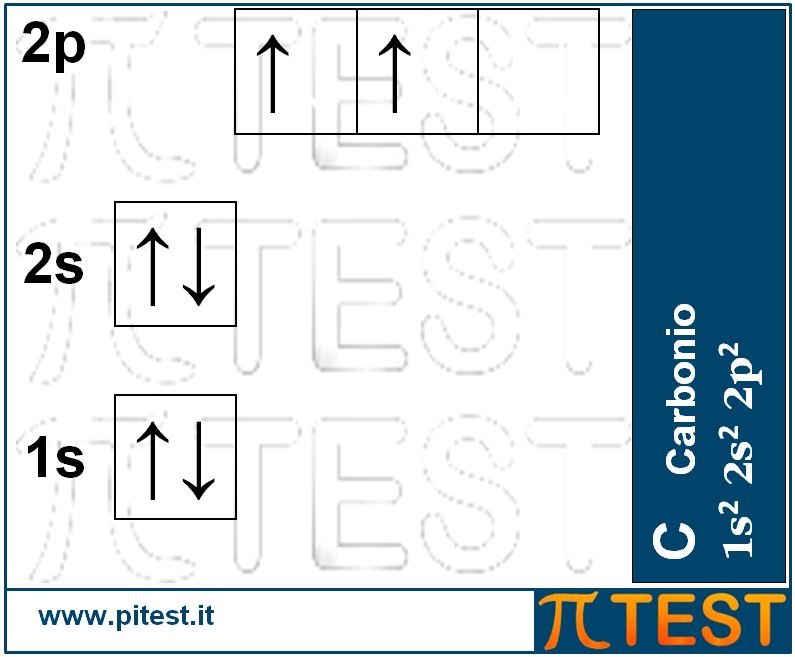
Il sesto elemento chimico, il carbonio C, possiede sei elettroni. I primi due completano il primo livello energetico riempendo l’orbitale 1s; dei quattro elettroni rimanenti due andranno a collocarsi al secondo livello nell’orbitale 2s e gli ultimi due si collocheranno negli orbitali 2p. La configurazione elettronica è 1s22s22p2. Gli ultimi due elettroni che si trovano negli orbitali 2p si collocano in due diversi orbitali di tipo p piuttosto che in un unico orbitale. Questo avviene per il Principio di Hund che afferma: « Se in un sottostrato si ha più di un orbitale, si associano gli elettroni con spin paralleli ad orbitali distinti nel sottostrato, anziché appaiarne due in uno stesso orbitale ». Per sottostrato si intende un gruppo di orbitali omologhi come i tre orbitali p. Gli spin paralleli sono rappresentati utilizzando frecce tutte rivolte verso l’alto. |
|
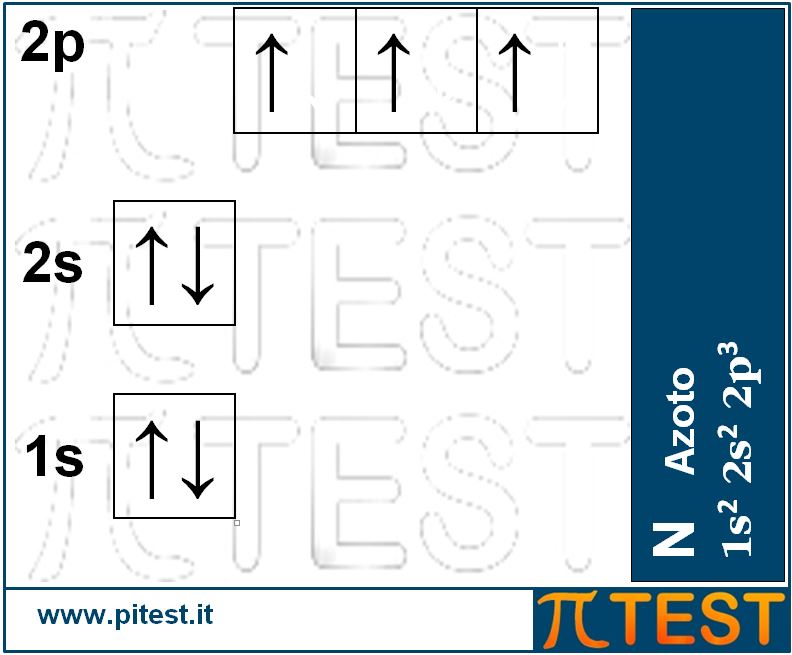
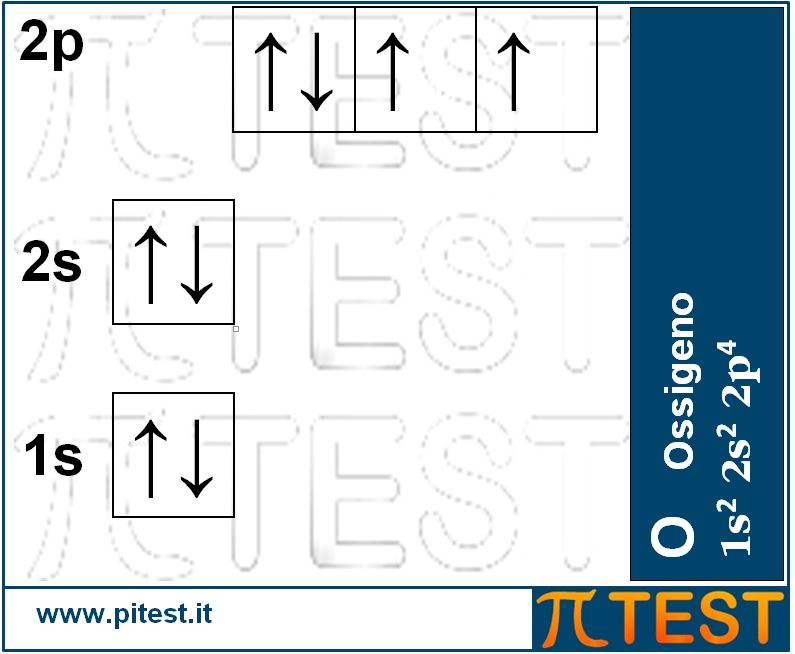
Continuando la serie crescente degli elementi chimici al crescere del numero atomico avremo le seguenti configurazioni.
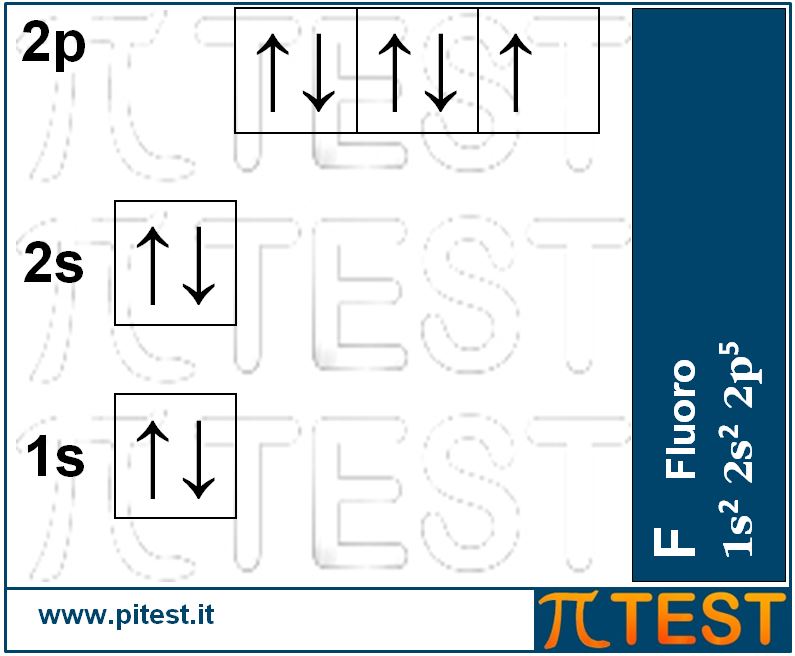
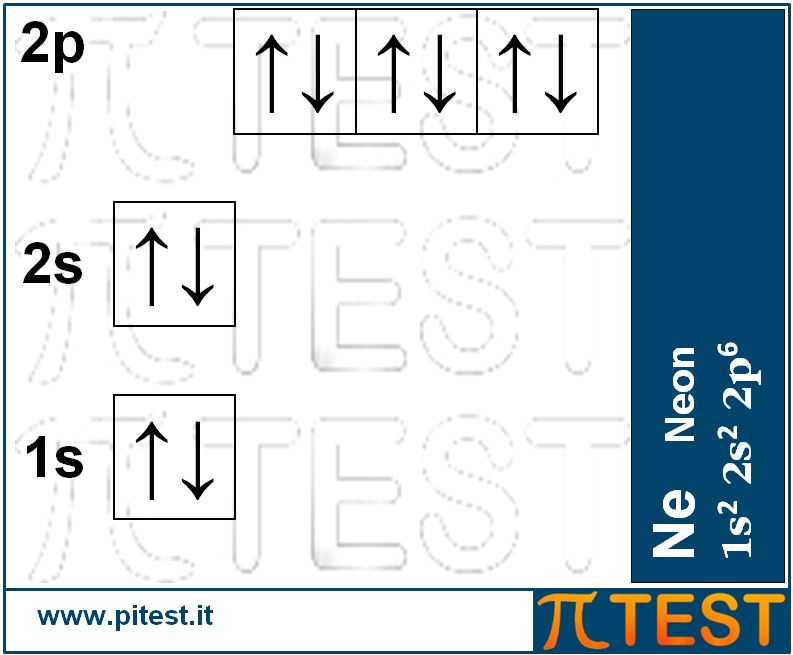
Il Neon Ne completa la serie. Con tutti gli orbitali pieni possiede una struttura molto stabile che gli conferisce la caratteristica di non aver bisogno di legarsi ad altri atomi e può esistere isolato come molecola monoatomica. Si dice che il neon ha l’ “ottetto” pieno. Per ottetto intendiamo gli otto elettroni presenti nel guscio elettronico esterno del neon (due elettroni in 2s e sei elettroni in 2p). Tale saturazione conferisce una caratteristica di NON reattività chimica. Per questo motivo il Neon si presenta in natura sotto forma di gas monoatomico. Tutti gli elementi come l’elio He e il neon Ne che hanno tutti gli orbitali del guscio esterno completamente riempiti di elettroni, sono chiamati “gas nobili”. |
|
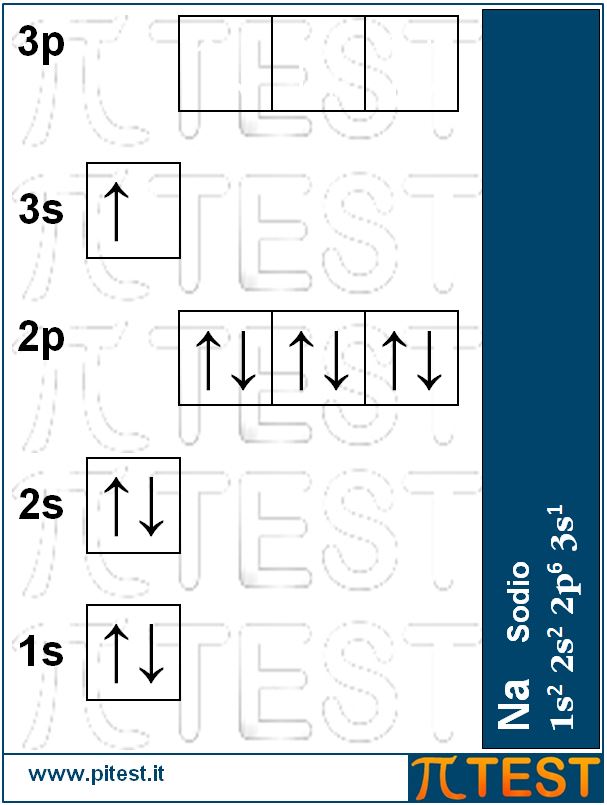
Dopo il Neon abbiamo il sodio Na con undici protoni ed undici elettroni. Collocherà l’undicesimo elettrone nel terzo livello nell’orbitale 3s. La sua configurazione sarà 1s22s22p63s1 .
|
|
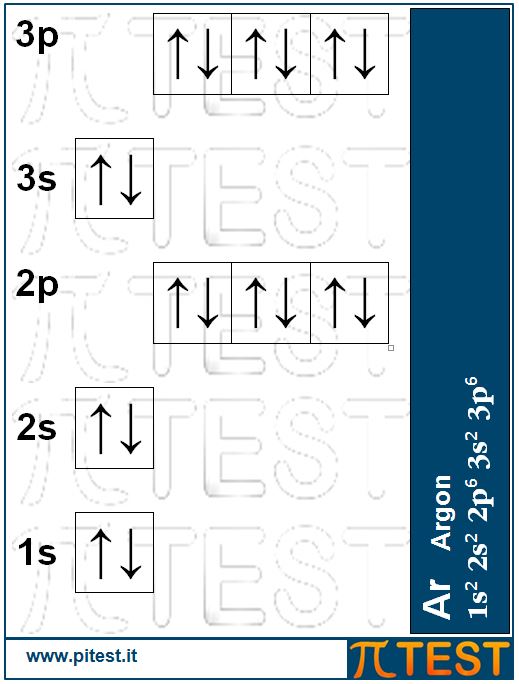
Continuiamo con lo stesso criterio, che abbiamo visto andando dal Litio fino al Neon nel riempimento del secondo livello, fino ad arrivare al completo riempimento degli orbitali 3s e 3p arrivando all’Argon Ar: 1s22s22p63s23p6.
|
A questo punto, dopo il riempimento degli orbitali 3s e 3p, non avviene subito il riempimento degli orbitali 3d, ma risulta energeticamente favorito il riempimento dell’orbitale 4s. Questo può sembrare una anomalia se ci aspettiamo che abbia la priorità il riempimento del terzo livello prima di poter avere elettroni nel quarto. Però l’orbitale 4s è energeticamente favorito in quanto possiede energia minore e in natura tutto tende alla minima energia. Quest’ordine di riempimento è molto importante da ricordare ed è rappresentato nella figura sotto a sinistra.
Questo avviene per il principio dell’Aufbau.
Nota: Si può esprimere il principio dell’Aufbau in funzione dei numeri quantici che troviamo nel capitolo 3.4. Dopo aver studiato i numeri quantici di può ritornare a leggere quanto segue.
In riferimento al numero quantico principale n ed al numero quantico secondario l, consideriamo la grandezza n + l . Vengono riempiti prima gli orbitali che hanno un valore n + l più basso. Applicando tale regola abbiamo che dopo l’orbitale 3p (n=3 , l =1 ; n + l = 4) si riempie l’orbitale 4s (n=4 , l =0 ; n + l = 4) piuttosto che il 3d (n=3 , l =2 ; n + l = 5).
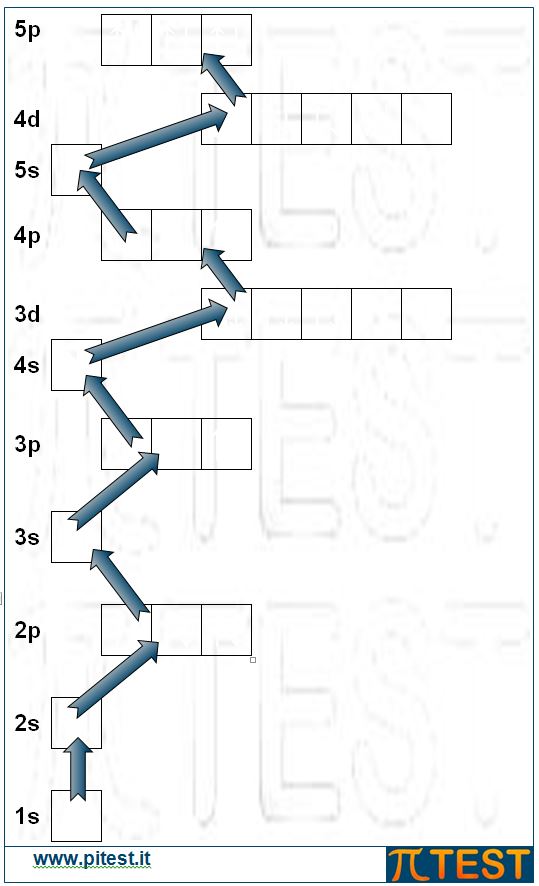
|
Posizionando così il diciannovesimo elettrone nell’orbitale 4s abbiamo il potassio K: 1s22s22p63s23p64s1 che possiede un elettrone del quarto guscio, nell’orbitale 4s.
|
|
Continuiamo la serie con il ventesimo elemento chimico il calcio Ca: 1s22s22p63s23p64s2 che possiede due elettroni nel quarto guscio, entrambi nell’orbitale 4s.
|
|
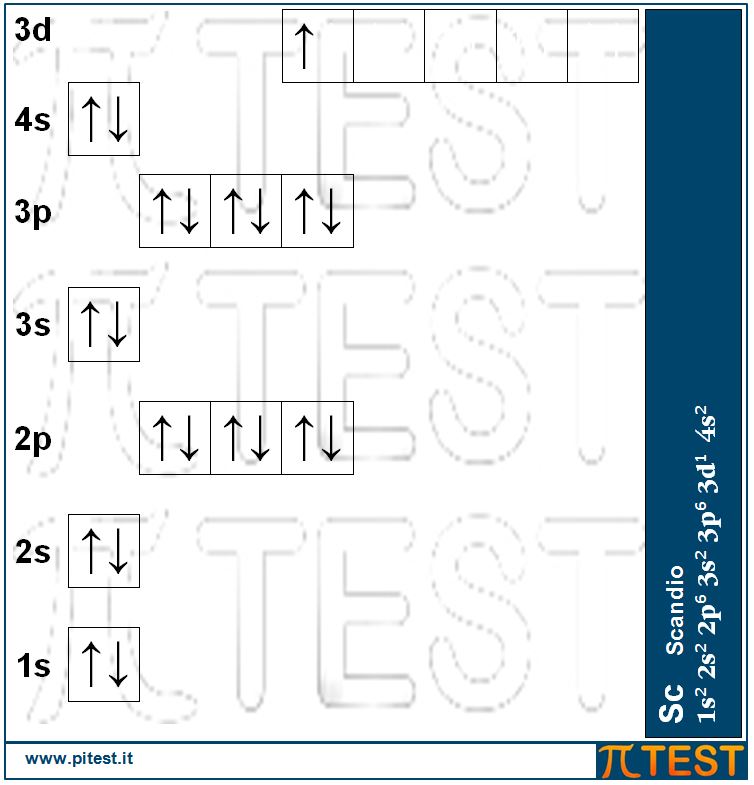
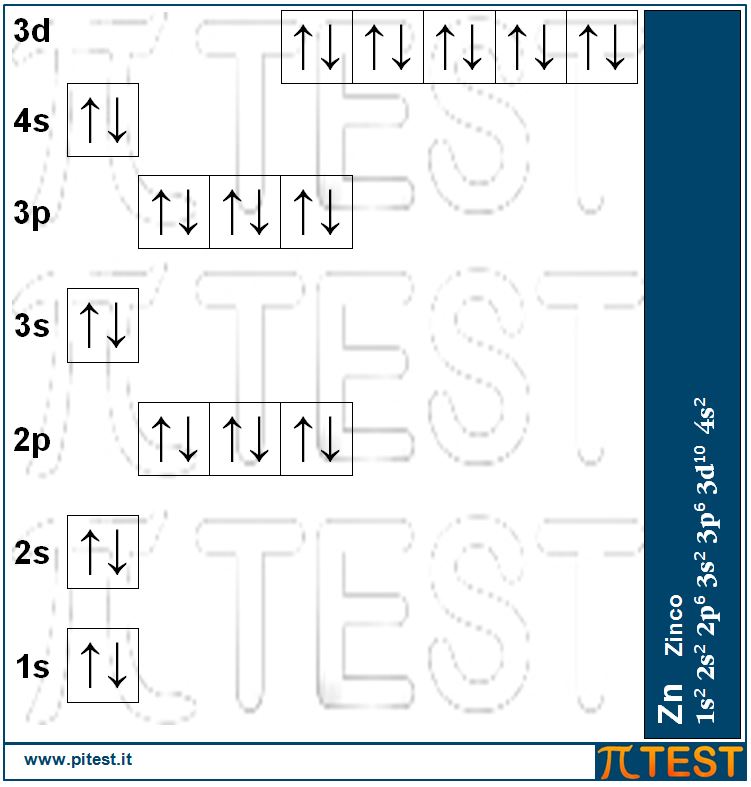
I cinque orbitali 3d che non erano stati finora interessati ora iniziano ad essere riempiti a partire dallo scandio Sc, per arrivare allo zinco Zn. Il riempimento dei cinque orbitali 3d utilizza dieci elettroni. Avremo così dieci elementi chimici dei quali è utile ricordare che il primo è lo scandio Sc e l’ultimo lo zinco Zn e tra questi abbiamo il ferro Fe, il rame Cu, il cromo Cr e il manganese Mn.
⇓ ⇓
|
|
Dopo gli orbitali 3d si passa al quarto livello nel quale già era stato riempito l’orbitale 4s. Si continua con la stessa logica fino all’ultimo elemento chimico conosciuto. Gli orbitali f che sono presenti a partire dal quarto livello vengono riempiti anche loro “in ritardo” come già succede per gli orbitali d. Nei quiz dei test di ammissione non sono mai state poste domande riguardanti il riempimento degli orbitali f. |
Il principio dell’Aufbau, può essere anche riportato in due possibili schemi.
Il primo schema segue il principio del riempimento secondo energia crescente.
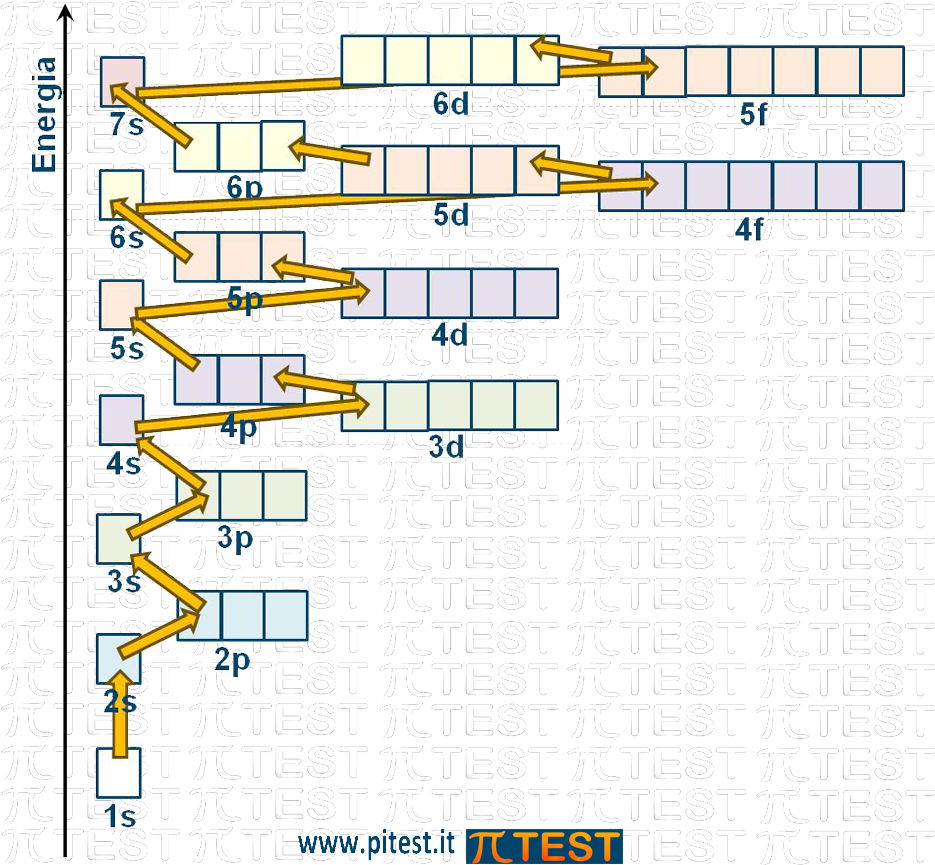
In un altro schema l’ordine di riempimento segue le frecce disegnate in diagonale.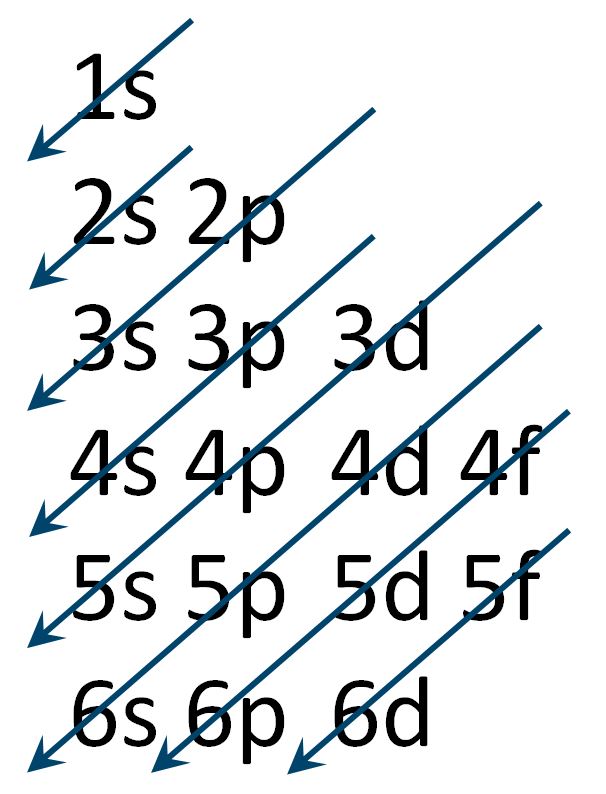
Un altro modo di scrivere la configurazione elettronica
Nello scrivere la configurazione elettronica possiamo anche raggruppare la scrittura dei livelli interni riportando il simbolo del gas nobile precedente.
Ad esempio consideriamo il neon Ne 1s22s22p6 e il magnesio Mg 1s22s22p63s2
Possiamo scrivere la configurazione del Magnesio così: [Ne]3s2. Abbiamo scritto [Ne] intendendo la sua configurazione.
3.2.2 Regola dell’ottetto e Strutture di Lewis
Con il termine ottetto facciamo riferimento agli otto elettroni del guscio esterno di un atomo, due nell’orbitale s e sei negli orbitali p.
Questi otto elettroni sono responsabili del comportamento chimico di un atomo perché sono loro che andranno a determinare quali legami chimici si potranno formare all’interno di una molecola.
Il chimico Lewis propose di rappresentare gli elementi disegnando intorno a loro puntini che rappresentano gli elettroni presenti nel guscio esterno dell’atomo.
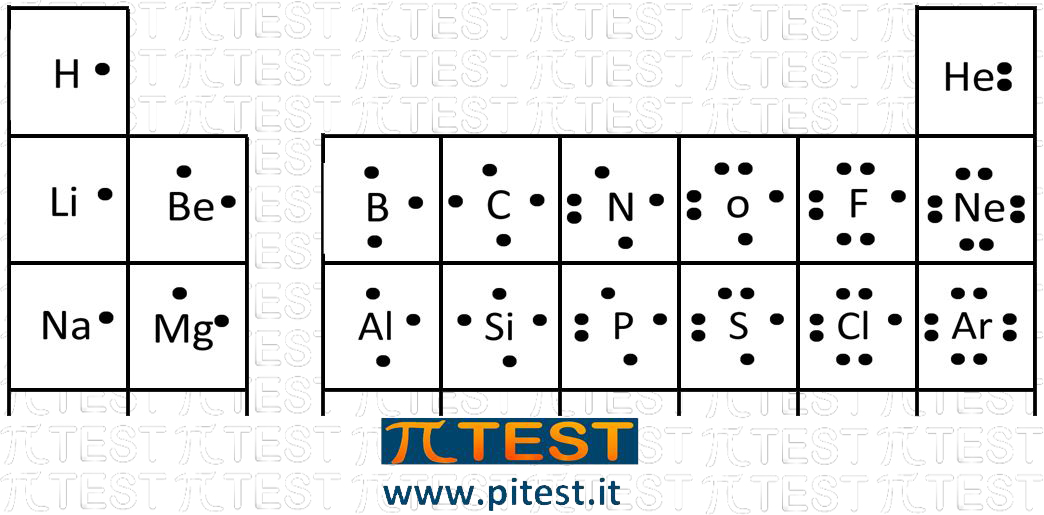
Questa rappresentazione scopriremo che è utile per visualizzare legami chimici che si formano all’interno delle molecole.
3.2.3 Stati eccitati
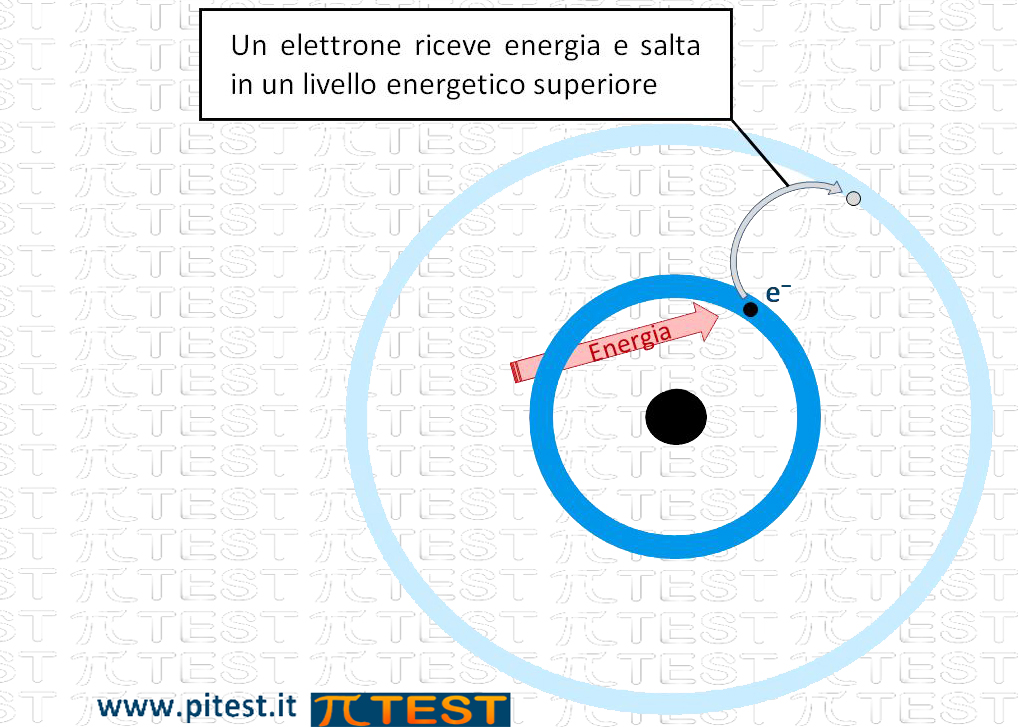
Un elettrone che si trova nell’orbitale di appartenenza può ricevere energia dall’esterno come calore, radiazione incidente (luce o altre frequenze) o passaggio di corrente elettrica. L’elettrone, possedendo una energia maggiore, si sposta in un orbitale ad energia superiore che trova libero da altri elettroni compiendo un “salto verso l’alto”. Questo stato è detto “eccitato“.
Ad un certo momento però l’elettrone rientrerà nell’orbitale iniziale cedendo l’energia che possiede sotto forma di radiazione emettendo un “fotone”.
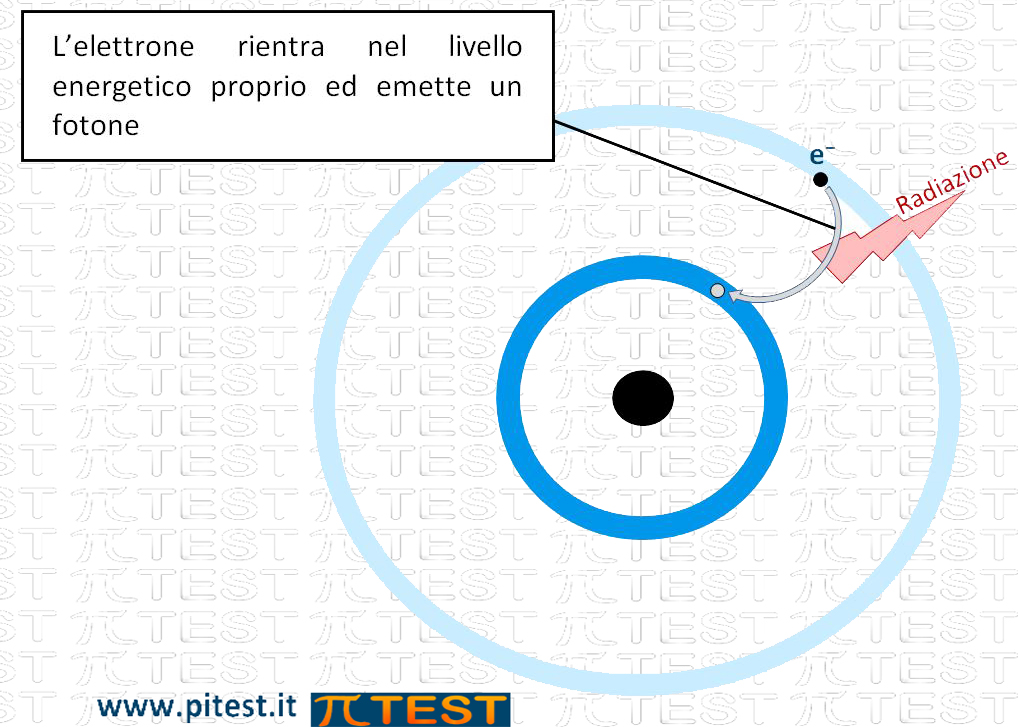
Un fotone corrisponde ad una precisa quantità di energia (un “quanto”) che si associa ad una frequenza della radiazione secondo la legge:
E = h • f ( h = costante di Plank; f = frequenza).
Questo fenomeno spiega il fatto che un corpo riscaldato ad una certa temperatura emette una radiazione e che se la temperatura è sufficientemente alta la radiazione arriva a frequenze tali da essere luminosa.
© il testo è di esclusiva proprietà dell’autore ed è sottoposto a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito
QUIZ 3.2 Sull'ordine di riempimento degli orbitali e configurazione elettronica |
|||
|---|---|---|---|



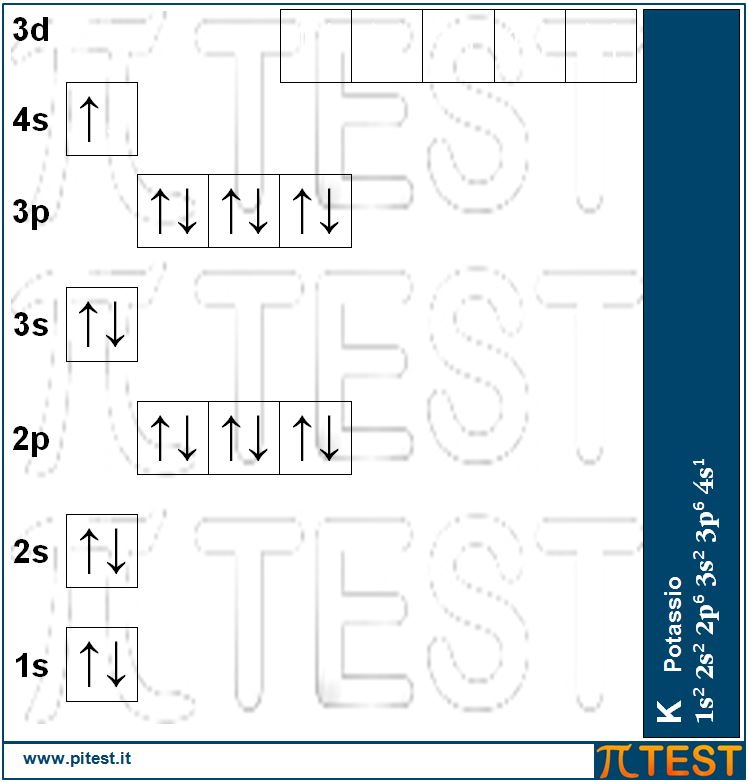
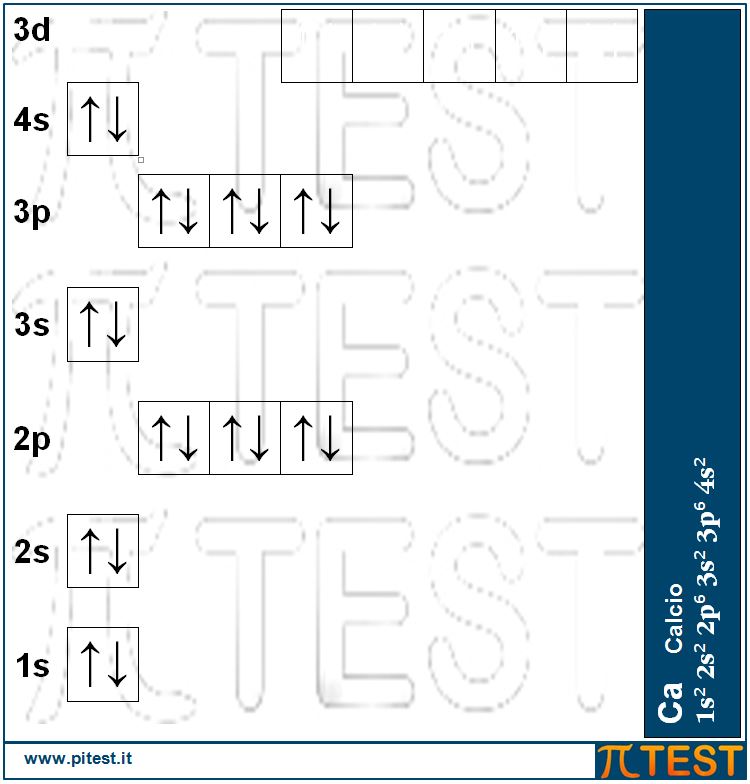 Molti quiz fanno riferimento al calcio Ca. È bene ricordare che è il ventesimo elemento (20 protoni nel nucleo e venti elettroni negli orbitali) e possiede una massa atomica pari a 40 u.m.a.
Molti quiz fanno riferimento al calcio Ca. È bene ricordare che è il ventesimo elemento (20 protoni nel nucleo e venti elettroni negli orbitali) e possiede una massa atomica pari a 40 u.m.a.