7.6 Cinetica chimica – velocità di reazione
Per valutare la rapidità di una reazione chimica utilizziamo la grandezza velocità di reazione.
Facciamo riferimento ad una reazione particolarmente semplice del tipo
X → Y + Z
nella quale un unico reagente X si decompone in Y e Z.
Definiamo la velocità di reazione come rapporto tra le variazioni di concentrazione del reagente [X] e la variazione di tempo Δt.
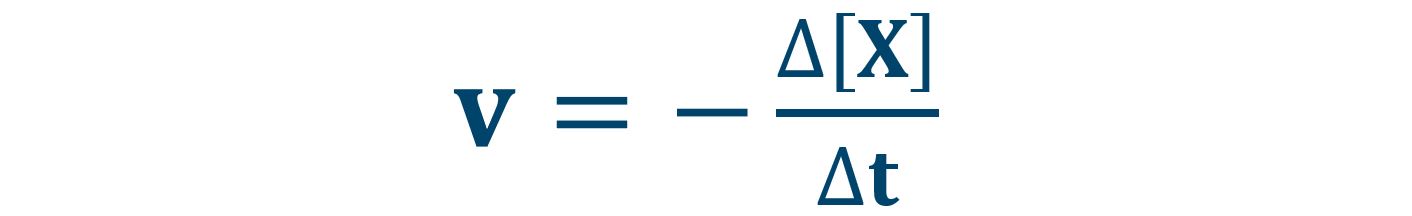
Il reagente X consumandosi al trascorrere della reazione diminuisce la propria concentrazione [X] e la variazione Δ[X] risulta negativa. Per avere un valore positivo della velocità abbiamo introdotto il segno meno nella definizione di v.
La velocità di reazione dipende dalla concentrazione del reagente X secondo la legge:
![]()
Per ogni reazione il valore di k e di n sono determinati sperimentalmente.
k è la costante di velocità ed è un valore che dipende dalla temperatura (cresce sempre al crescere della temperatura).
n è detto ordine di reazione e determina l’andamento della velocità di reazione in funzione della concentrazione. Consideriamo due possibili valori dell’ordine di reazione: 0 e 1.
- Reazioni di ordine zero (n=0):
Poiché qualsiasi numero elevato al valore zero vale 1 abbiamo v=k. ( [X]0=1)
Nelle reazioni di ordine zero la velocità assume sempre lo stesso valore a prescindere dalla presenza più o meno abbondante del reagente X.
- Reazioni di ordine 1 (n=1): v=k•[X]
Nelle reazioni di ordine 1 la velocità risulta direttamente proporzionale alla concentrazione [X].
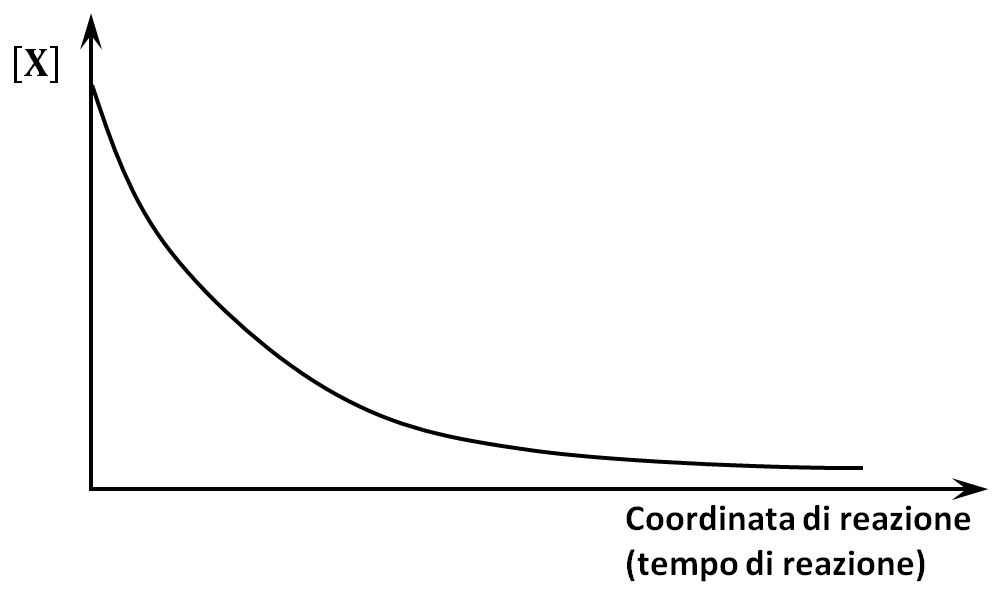
In questo tipo di reazione la velocità diminuisce via via che il reagente si consuma e la concentrazione ha un andamento asintotico come in figura (evitiamo la dimostrazione matematica).
Una tipica reazione di ordine 1 è quella del decadimento di isotopi radioattivi.
Abbiamo considerato l’esempio di una reazione molto semplice con un solo reagente. Se abbiamo due reagenti secondo una reazione del tipo
A + B → C
la velocità di reazione assume la seguente forma:
![]()
In questo caso l’ordine di reazione è dato da m+n.
© il testo e le immagini sono di esclusiva proprietà dell’autore e sono sottoposti a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito
QUIZ sulla Velocità di reazione |
|||
|---|---|---|---|


