4.10 I legami intermolecolari
QUIZ 01
Medicina 2018
Le forze intermolecolari di van der Waals agiscono solamente:
È un quiz che verte su un argomento di per sé noto, ma viene reso difficile dal termine “solamente” che richiede un ragionamento logica. Le forze di Van der Waals sono forze di interazione tra molecola e molecola e sono sempre molto deboli, se comparate con le altre forze intramolecolari. Pur essendo classificate deboli, sono sufficientemente forti “solamente” a piccola distanza e sono responsabili della coesione intermolecolare allo stato liquido e solido. Quanto detto giustifica la risposta D).
Altre risposte risultano vere ma non rappresentano situazioni uniche. Ad esempio è vero che agiscono fra molecole polari allo stato solido, ma questa non è l’unica situazione nella quale sono presenti.
Le molecole non polari presentano una attrazione intermolecolare anche se molto debole nota come Forze di Van der Waals. La spiegazione di queste forze è stata data dal fisico Fritz London.
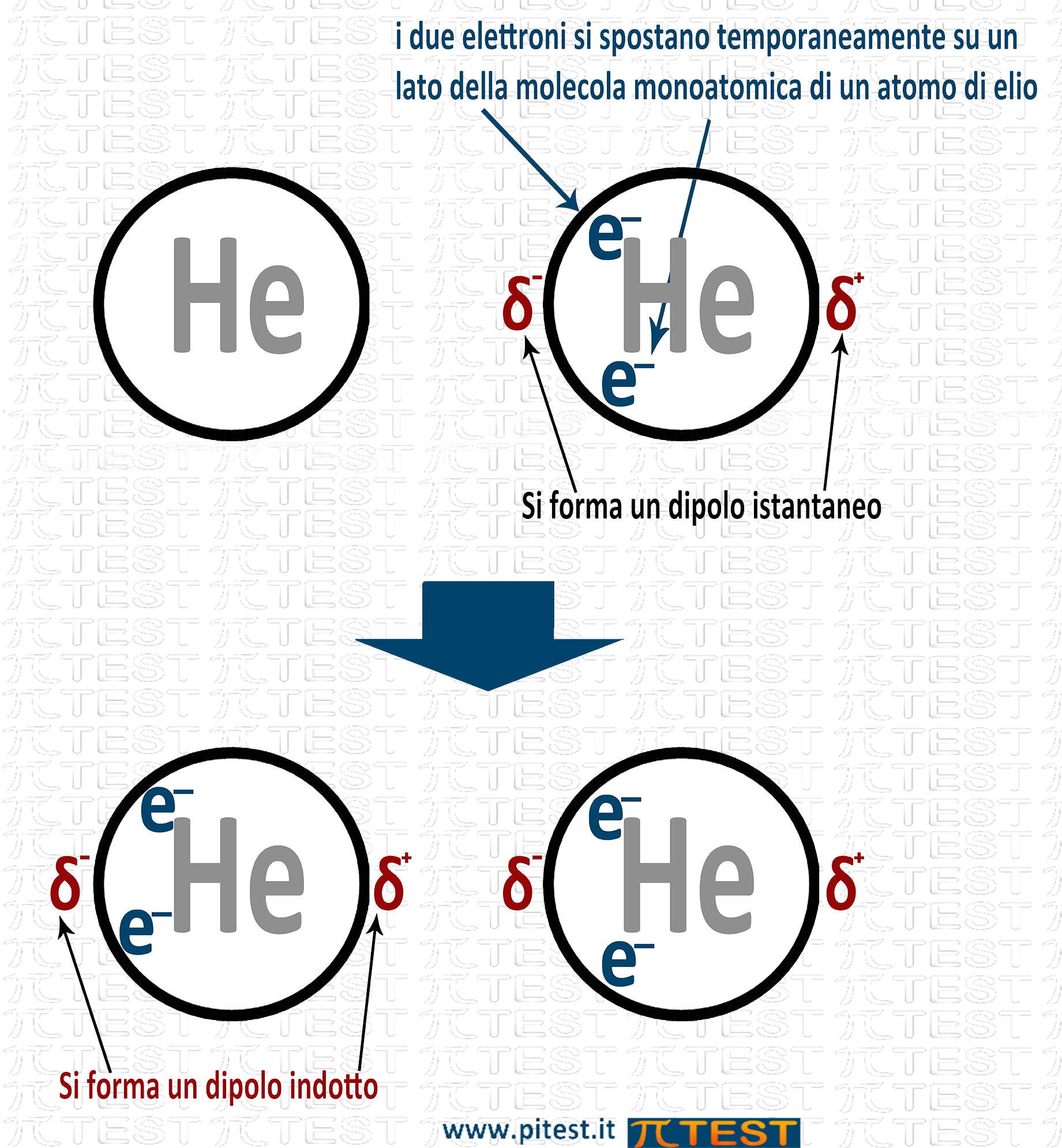
Secondo London le molecole apolari formano a volte per brevi istanti un dipolo a causa della distribuzione degli elettroni che, anche se mediamente è uniforme e senza polarità, per un istante possono trovarsi sbilanciati in eccesso da una parte della molecola formando un polo negativo temporaneo; dalla parte opposta rimane un polo positivo. Nel complesso si è formato un dipolo temporaneo o istantaneo (che dura un solo istante). Questo dipolo istantaneo crea un campo elettrico e induce nelle nuvole elettroniche delle molecole adiacenti un altro dipolo (dipolo indotto). Tra dipolo istantaneo e dipolo indotto si verifica una attrazione che pur breve nel tempo è sempre una attrazione.
Le forze di London sono più intense nelle molecole più grandi per la maggior facilità a polarizzarsi della nube elettronica più estesa.
Le forze di Van der Waals si manifestano solamente a breve distanza e sono presenti quindi solamente nella fase liquida e solida.
QUIZ sui Legami Intermolecolari |
|||
|---|---|---|---|
© il testo è di esclusiva proprietà dell’autore ed è sottoposto a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito


