3.5 Le proprietà periodiche
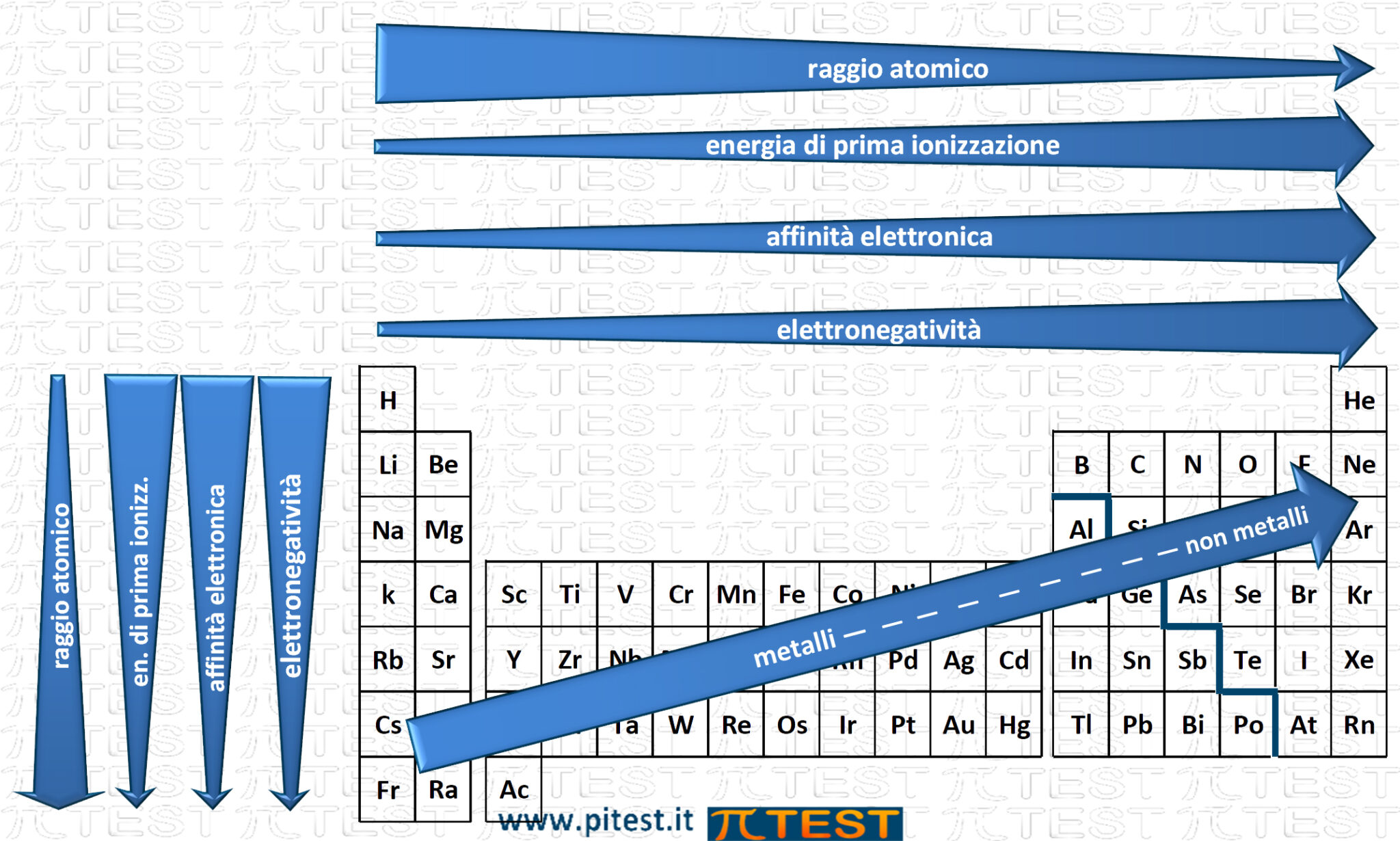
Alcune proprietà degli elementi presentano la caratteristica di avere valori che seguono un andamento crescente o decrescente quando ci spostiamo lungo i periodi (in orizzontale) e lungo i gruppi (in verticale) della tavola periodica degli elementi.
Se percorriamo la tavola periodica iniziando dal primo elemento, l’idrogeno, andando fino alla fine possiamo osservare che le configurazioni elettroniche dei gusci esterni si ripetono in modo periodico ed allo stesso modo si ripetono anche alcune proprietà degli elementi. Per questo motivo vengono dette proprietà periodiche.
3.5.1 Il raggio atomico
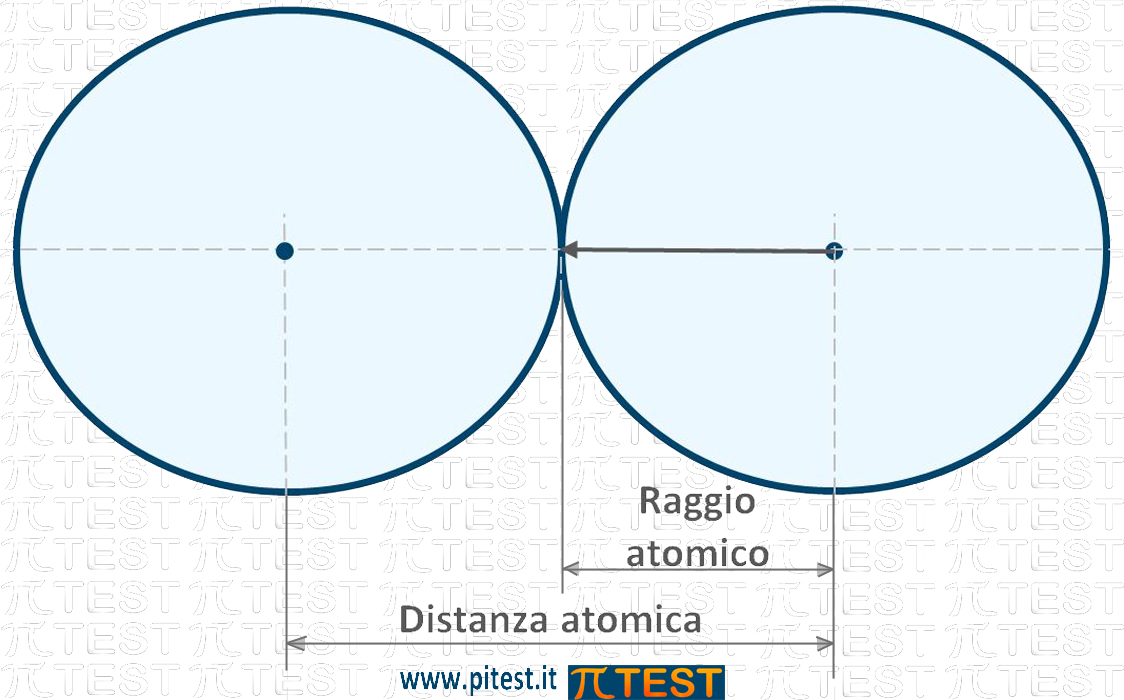
Assimilando la forma di un atomo ad una sfera, parlare del suo raggio equivale a parlare della dimensione atomica. Per una definizione più rigorosa immaginiamo due atomi identici che si avvicinano il più possibile e andiamo a misurare questa minima distanza che divisa per due fornisce il raggio atomico. Il raggio atomico misura in pratica la grandezza di un atomo.
Il raggio atomico viene misurato in picometri (1pm=10-12m) oppure in angstrom (1Å = 10-10m).
Come esempio consideriamo il più piccolo ed il più grande: Il raggio atomico dell’idrogeno vale 53pm (0,53Å) e il raggio atomico dell’uranio vale 156pm (15,6Å)
Spostiamoci dall’alto verso il basso all’interno di un gruppo, ad esempio nel primo gruppo dei metalli alcalini.
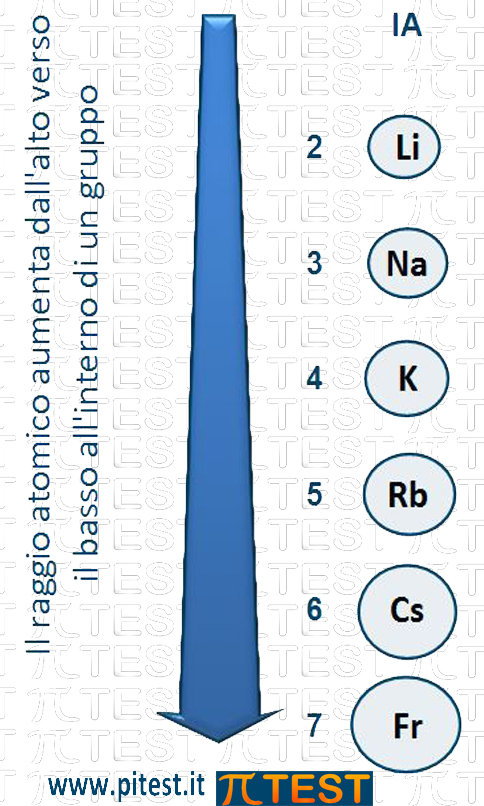
Nella tavola periodica incontriamo in alto il litio Li che contiene due elettroni nel primo livello ed un solo elettrone nel secondo livello (1s22s1); l’elemento sottostante, il sodio (1s22s22p63s1) possiede due livelli pieni di elettroni ed un solo elettrone nel terzo livello. Per quanto riguarda le dimensioni atomiche il sodio è più grande del litio perché la sua nuvola elettronica è più grande di un livello. Il discorso si ripete scendendo al potassio e poi al rubidio, al cesio e al francio.
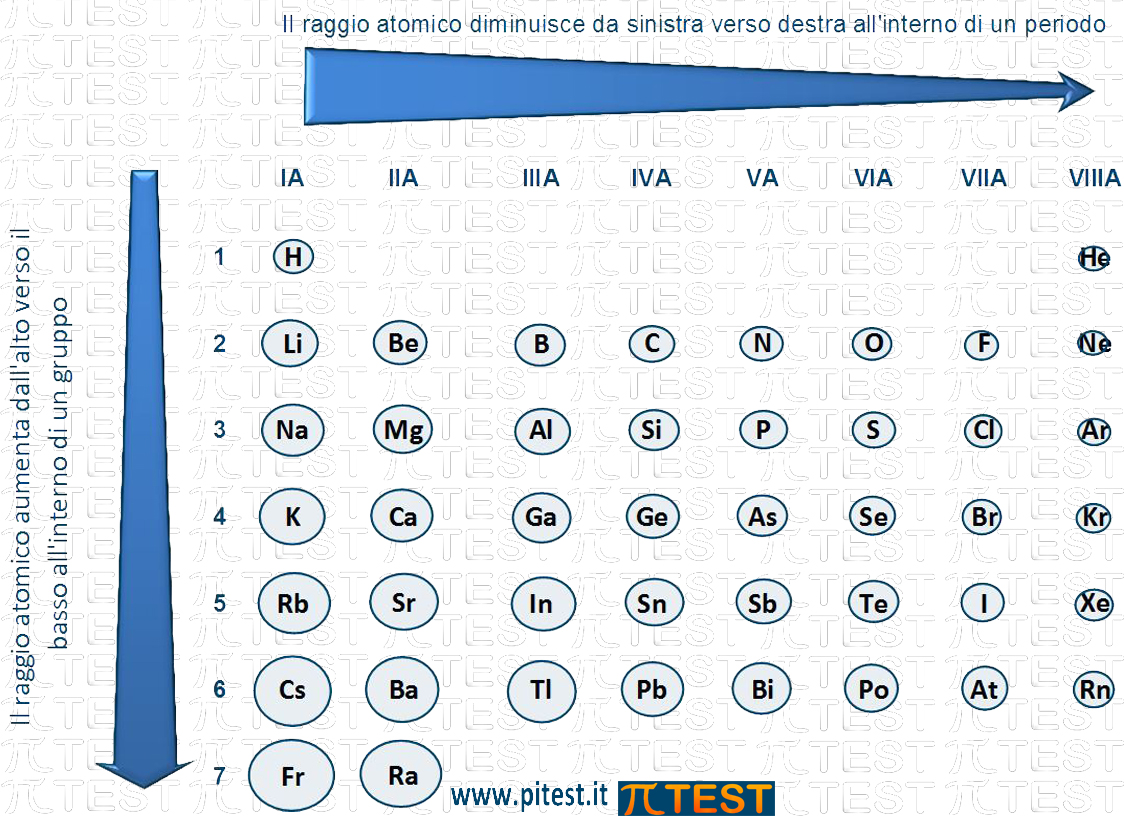
In generale possiamo dire che scendendo dall’alto verso il basso lungo un gruppo la dimensione atomica cresce.
Spostiamoci da sinistra verso destra all’interno di un periodo, ad esempio nel secondo periodo che va dal litio Li al neon Ne.
 Il litio Li (1s22s1) possiede un nucleo con 3 protoni e i suoi elettroni arrivano ad occupare il secondo livello o secondo guscio elettronico. L’elemento successivo lungo il periodo è il berillio Be (1s22s2) che possiede un propone in più rispetto al litio; i suoi elettroni occupano il secondo livello o secondo guscio elettronico così come il litio. Il guscio elettronico più esterno rimane lo stesso. Il nucleo del berillio rispetto al litio ha aumentato la sua carica positiva che attira tutti gli elettroni esterni (negativi) con più forza provocando un restringimento della nuvola di elettroni.
Il litio Li (1s22s1) possiede un nucleo con 3 protoni e i suoi elettroni arrivano ad occupare il secondo livello o secondo guscio elettronico. L’elemento successivo lungo il periodo è il berillio Be (1s22s2) che possiede un propone in più rispetto al litio; i suoi elettroni occupano il secondo livello o secondo guscio elettronico così come il litio. Il guscio elettronico più esterno rimane lo stesso. Il nucleo del berillio rispetto al litio ha aumentato la sua carica positiva che attira tutti gli elettroni esterni (negativi) con più forza provocando un restringimento della nuvola di elettroni.
Se continuiamo verso destra dal berillio Be al boro B, possiamo ripetere lo stesso ragionamento. In generale possiamo affermare che spostandosi da sinistra verso destra lungo un periodo la dimensione atomica diminuisce.
Andamento del raggio atomico
Vediamo ora tre proprietà degli elementi che riguardano caratteristiche elettriche. Tutte e tre queste grandezze sulla tavola periodica hanno un andamento opposto all’andamento del raggio atomico. Infatti diminuiscono scendendo lungo un gruppo ed aumentano andando verso destra lungo un periodo.
3.5.2 Energia di prima ionizzazione
Quando viene strappato un elettrone e‒ ad un atomo occorre una certa energia. Facciamo riferimento ad un generico atomo X che si trova allo stato gassoso e che viene scritto X(g)
X(g) + energia ➞ X(g)+ + e‒
Questa energia è detta energia di prima ionizzazione.
Definizione: L’energia di ionizzazione di un atomo è l’energia richiesta per allontanare un elettrone dall’atomo in forma gassosa.
Facendo riferimento ad un solo atomo l’energia di prima ionizzazione di misura in elettronvolt (eV); se invece ci riferiamo ad una mole di atomi, allora si utilizza come unità di misura kJ/mol (chilojoule per mole).
In generale l’atomo con un elettrone in meno ha una dimensione minore rispetto all’atomo neutro in quanto la nuvola elettronica diminuita di una carica negativa è sbilanciata rispetto alle cariche positive (protoni) nel nucleo che risultano maggiori in numero e attraggono maggiormente gli elettroni presenti.
Spostandoci sulla tavola periodica degli elementi l’andamento generale dei valori di energia di prima ionizzazione segue un andamento esattamente al contrario dell’andamento dei valori di raggio atomico. Decresce verso il basso lungo i gruppi e aumenta verso destra lungo i periodi.
| ! | Questa descrizione dell’andamento generale dell’energia di prima ionizzazione può essere sufficiente a risolvere molti quiz. |
Segue una trattazione più dettagliata che può anche essere trascurata in una prima fase di studio. Finora nei test di ammissione il seguente approfondimento è stato utile in un solo quiz (seguente quiz N.5 dell’anno 2020).
Analisi dettagliata dell’andamento dell’energia di prima ionizzazione
Se andiamo più in dettaglio, l’andamento del valore dell’energia di prima ionizzazione è rappresentato in figura (sono indicati gli elementi dei primi quatto periodi; per gli altri non rappresentati l’andamento è simile):
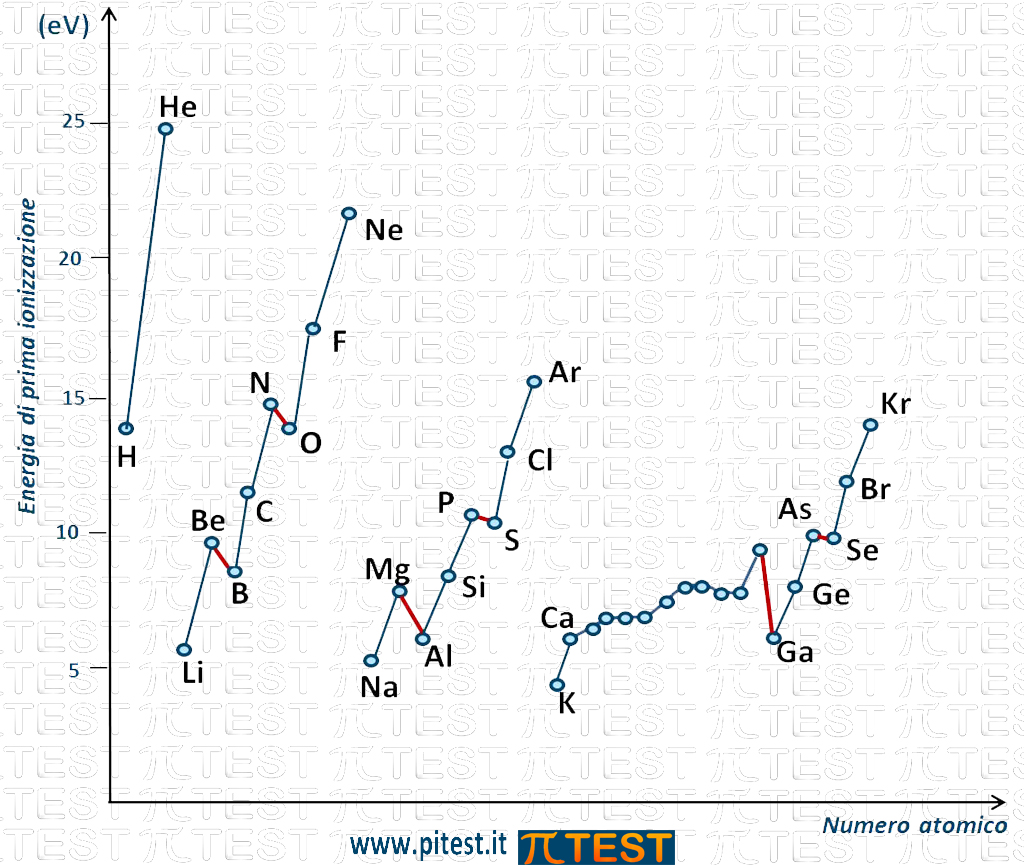
Abbiamo in ascissa il numero atomico e in ordinata l’energia di prima ionizzazione.
Andiamo ora a studiare l’andamento dei valori di energia di prima ionizzazione seguendo gli elementi chimici dettagliatamente lungo i gruppi e lungo i periodi.
Andamento lungo i gruppi
Possiamo osservare che lungo un gruppo della Tavola Periodica dall’alto verso il basso l’energia di prima ionizzazione diminuisce come indicato nella seguente figura dalle curve che seguono gli elementi di uno stesso gruppo.
La prima curva in alto passa per i punti che rappresentano le energie di prima ionizzazione degli elementi del gruppo VIIIA, i gas nobili (He, Ne, Ar, Kr, …). È una curva decrescente che indica il fatto che, passando dal gas nobile più in alto nella tavola periodica, l’elio He, andando verso i gas nobili sottostanti, l’energia di prima ionizzazione va decrescendo.
La stessa cosa accade per il gruppo VIIA degli alogeni con una curva decrescente che parte dall’alogeno più in alto nella tavola periodica, il fluoro F, e prosegue scendendo verso il cloro, il bromo , ecc.
E così via per tutti i gruppi. In figura sono rappresentate le linee che riguardano i gruppi VIA, IIA e IA.
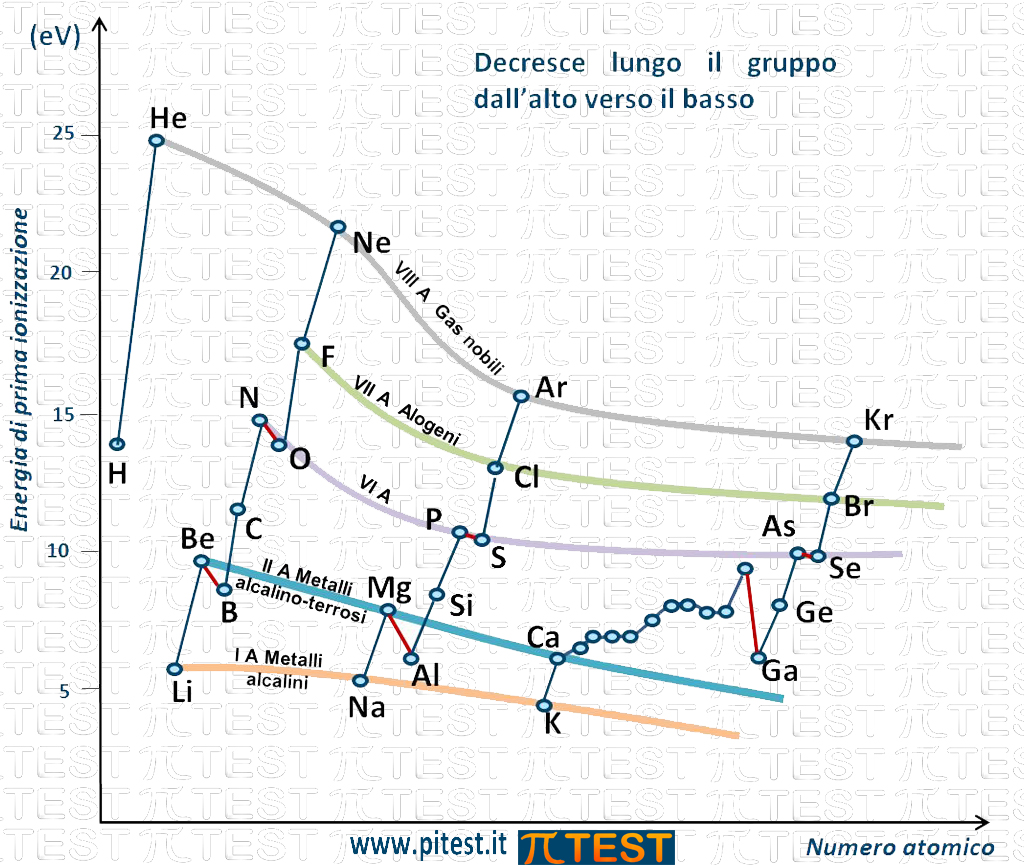
Il fenomeno si interpreta con il fatto che lungo un gruppo il guscio elettronico esterno è simile e cambia solo la dimensione del guscio che è più grande scendendo verso il basso. Ad esempio nel primo gruppo dei metalli alcalini la caratteristica è quella di avere un solo elettrone nell’orbitale s del guscio più esterno (guscio di valenza). Quello che cambia passando dal litio Li al sodio Na è la dimensione dell’orbitale s più esterno. Nel litio si tratta dell’orbitale 2s e nel sodio si tratta dell’orbitale 3s. Continuando abbiamo il potassio K con un solo elettrone nell’orbitale 4s e così via. Quando l’elettrone che verrà strappato all’atomo si trova in un orbitale più grande e più lontano dal nucleo il lavoro necessario è minore e di conseguenza è minore l’energia di prima ionizzazione.
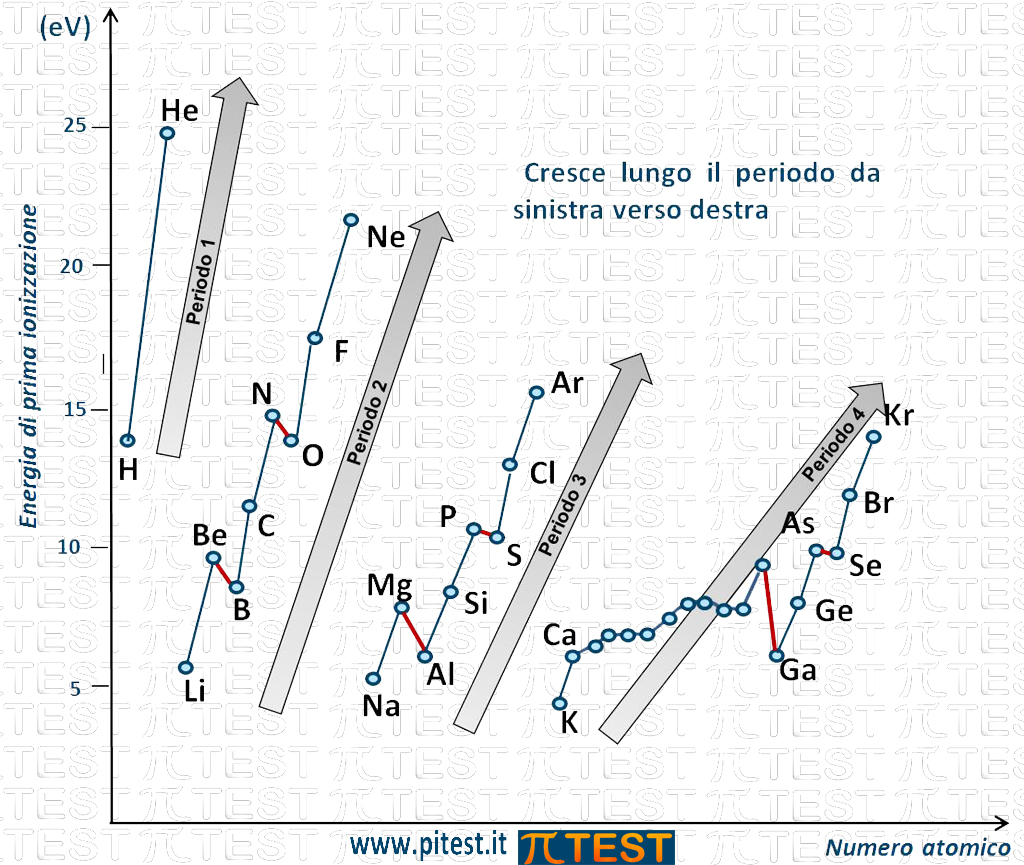
Andamento lungo i periodi
Possiamo osservare che lungo un periodo della Tavola Periodica da sinistra verso destra l’energia di prima ionizzazione aumenta come indicato nella figura dalle frecce che seguono gli elementi di uno stesso periodo:
Particolarità
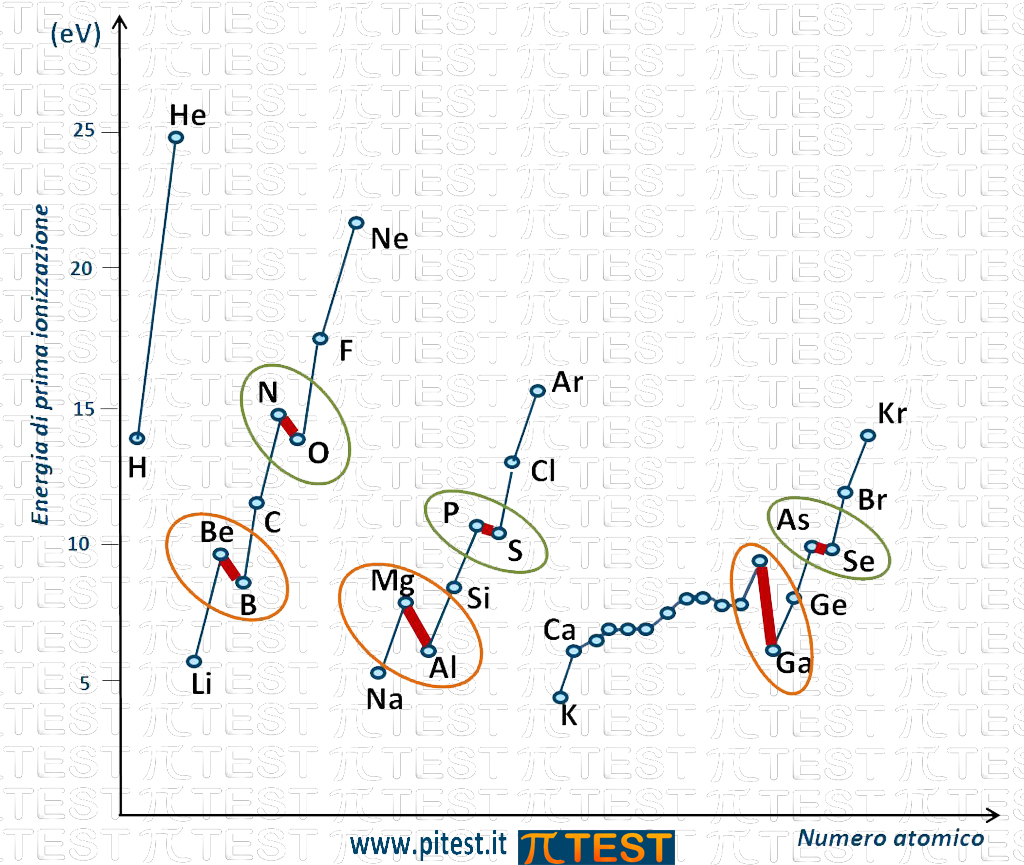
Facciamo una osservazione sull’andamento lungo i periodi. Passando dal sottogruppo s ed entrando nel sottogruppo p, come per esempio quando nel secondo periodo si passa dal berillio Be al boro B, vediamo una diminuzione del valore di energia di prima ionizzazione (cerchiati in figura); questo in controtendenza con il fatto che procedendo sulla Tavola Periodica verso destra l’energia di prima ionizzazione docrebbe invece aumentare.
Questo fenomeno si spiega con il fatto che il berillio Be ha raggiunto il completamento del sottogruppo s, fatto questo che lo rende abbastanza stabile. Proprio per questa stabilità la ionizzazione che comporta l’asportazione di un elettrone dal sottogruppo s richiede una certa energia. L’elemento seguente, il boro B, possiede l’ultimo elettrone nel sottogruppo p. Il sottogruppo p, costituito da tre orbitali, può avere fino a sei elettroni, ma nel caso del boro ne possiede solo uno. Questo unico elettrone in p non è stabile come i due elettroni che completano il sottogruppo s, e può essere asportato con minor spesa energetica.
Questo fenomeno si ripete identicamente anche per i livelli maggiori come osserviamo in figura nel passaggio dal magnesio Mg all’alluminio Al (cerchiati in figura).
La particolarità si ripete anche all’interno del sottogruppo p, quando si passa dal gruppo VA (o 15) al gruppo VIA (o 16). Ad esempio lungo il secondo periodo passando dall’azoto N all’ossigeno O vediamo che per l’ossigeno l’energia di prima ionizzazione è più bassa di quella dell’azoto anche se l’ossigeno si trova a destra dell’azoto; questo in controtendenza con il fatto che procedendo verso destra l’energia di prima ionizzazione va invece aumentando. Per spiegare questo fenomeno osserviamo che l’azoto possiede tre elettroni nel sottogruppo p. Questi tre elettroni per il principio di Hund si distribuiscono uno per orbitale. Questa configurazione è stabile e proprio per questa stabilità la ionizzazione che comporta l’asportazione di un elettrone dal sottogruppo p richiede una certa energia. L’elemento seguente, l’ossigeno O, possiede quattro elettroni nel sottogruppo p. Questa è una configurazione meno stabile e l’asportazione di un elettrone richiede minor spesa energetica rispetto all’azoto.
Ionizzazioni successive
Negli anni 2014 e 2015 (cedi si seguenti quiz N. 21, 22, 23 e 24) i quiz hanno riguardato le ionizzazioni successive alla prima. Per lo studio si vedano le spiegazioni di questi quiz richiamate dai QR code.
3.5.3 Affinità elettronica
Quando un atomo neutro (non ionizzato) allo stato gassoso acquista un elettrone e‒ , si libera una certa energia. Facciamo riferimento ad un generico atomo X che si trova allo stato gassoso e che viene scritto X(g)
X(g) + e‒ ➞ X(g)‒ + energia
Questa energia è detta affinità elettronica.
Definizione: L’affinità elettronica è l’energia liberata quanto un atomo gassoso neutro acquista un elettrone e diventa uno ione negativo (anione) monovalente (‒1).
Facendo riferimento ad un solo atomo l’affinità elettronica di misura in elettronvolt (eV); se invece ci riferiamo ad una mole di atomi, allora si utilizza come unità di misura kJ/mol (chilojoule per mole).
In generale l’atomo con un elettrone in più ha una dimensione maggiore rispetto all’atomo neutro in quanto la nuvola elettronica aumentata di una carica negativa non ha il corrispondente bilanciamento in cariche positive (protoni) nel nucleo.
Spostandoci sulla tavola periodica degli elementi, così come già abbiamo visto per l’energia di prima ionizzazione, l’andamento generale dei valori di affinità elettronica segue un andamento esattamente al contrario dell’andamento dei valori di raggio atomico. Decresce verso il basso lungo i gruppi e aumenta verso destra lungo i periodi.

I valori più alti li troviamo negli alogeni (settimo gruppo) che possiedono una configurazione elettronica nel guscio di valenza s2p5; manca solo un elettrone per completare l’ottetto e raggiungere la configurazione stabile di gas nobile. Infatti la tendenza a completare il doppietto elettronico è la chiave di interpretazione dell’andamento dei valori di affinità elettronica.
Particolarità
Una eccezione nell’andamento la troviamo nei metalli alcalino-terrosi (secondo gruppo). Questi elementi possiedono il sottogruppo s completo e non hanno alcun elettrone nel seguente sottogruppo p; questa è una situazione stabile e l’aggiunta di un elettrone non “è gradita” perché l’elettrone andrebbe ad occupare, da solo, un orbitale p, fenomeno non favorito che non libera energia, anzi la necessita. Per questi elementi il valore di affinità elettronica è negativo e significa che la reazione di acquisto di un elettrone richiede energia piuttosto che liberarla.
Lo stesso discorso vale per gli elementi del gruppo 12 (gli ultimi del sottogruppo d) come lo zinco Zn, il cadmio Cd e il mercurio Hg. Questi hanno il sottogruppo d completo e “non gradiscono” un ulteriore elettrone.
Anche l’azoto N “non gradisce” un elettrone in più perché possiede tre elettroni negli orbitali p distribuiti uno per ciascun orbitale secondo il principio di Hund; questa distribuzione uniforme conferisce stabilità e non è gradito un elettrone in più.
3.5.4 Elettronegatività
In una molecola parliamo di elettroni condivisi intendendo gli elettroni coinvolti nei legami chimici. Li chiamiamo anche elettroni di valenza.
Questi elettroni sono distribuiti tra i due atomi coinvolti nel legame chimico. I due atomi li attirano a sé ciascuno con una certa forza. A questa capacità di attrarre gli elettroni di valenza si associa la grandezza elettronegatività.
L’elettronegatività non si può misurare direttamente e deve essere determinata a partire da altre proprietà atomiche o molecolari. Si utilizza il metodo di calcolo di Pauling.
Definizione: L’elettronegatività è una proprietà chimica che descrive la tendenza di un atomo ad attrarre verso di sé elettroni condivisi.
Come abbiamo già visto per l’energia di prima ionizzazione e l’affinità elettronica, spostandoci sulla tavola periodica degli elementi l’andamento generale dei valori di elettronegatività segue un andamento esattamente al contrario dell’andamento dei valori di raggio atomico. Decresce verso il basso lungo i gruppi e aumenta verso destra lungo i periodi.
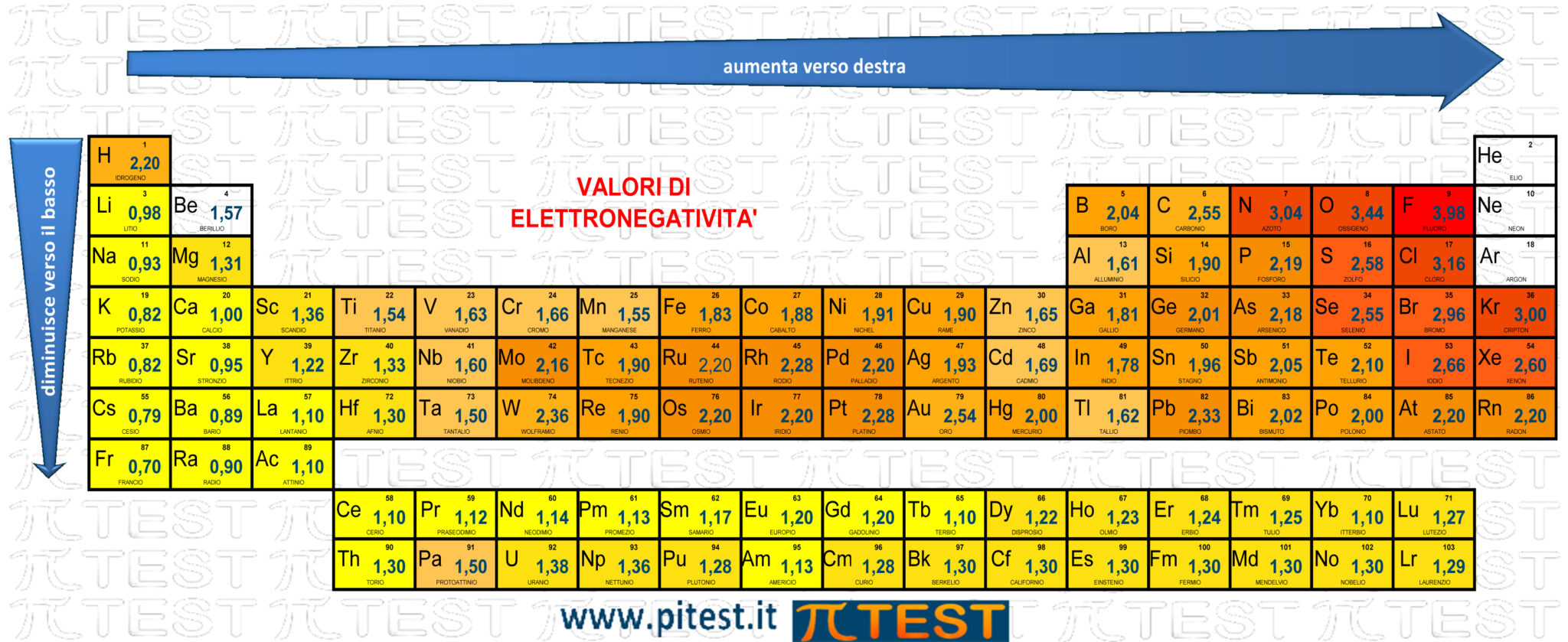
In base alla differenza di elettronegatività tra i due atomi coinvolti in un legame chimico si determina la natura del legame chimico stesso (covalente o ionico) e si valuta anche la polarità del legame.
3.5.5 Carattere metallico e non-metallico
Gli elementi chimici possono essere suddivisi nelle due categorie dei metalli e dei non metalli.
Nella tavola periodica vediamo una linea di demarcazione parte dal boro e scende in diagonale come nella figura. Gli elementi lungo la linea di confine sono detti semimetalli e assumono comportamento a volte metallico e a volte non metallico.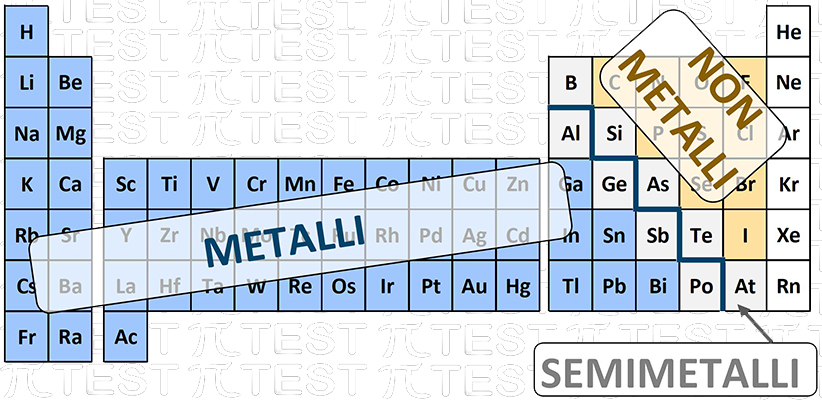 Caratteristiche
Caratteristiche
| Metalli | Non metalli |
|
|
3.5.6 Schema sintetico delle proprietà periodiche
© il testo è di esclusiva proprietà dell’autore ed è sottoposto a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito
QUIZ sulle proprietà periodiche |
|||
|---|---|---|---|


